下口鲇烂尾病病原的分离与鉴定
徐赟霞 崔露文 赵良炜 邓威 冯守明

摘 要:对患烂尾病下口鲶(Hypostomus plecostomus)的肝脏、脾脏、肾脏进行病原菌分离,分离到NY635菌株,用NY635菌株人工感染体重在20~30 g的健康鱼,人工感染的下口鲇出现与自然发病鱼相似的症状,并从人工感染的下口鲇病灶中分离出菌落形态相同的细菌。初步证明NY635是引起下口鲇烂尾病的病原。对NY635进行菌落形态观察、生理生化鉴定和16S rDNA基因序列分析,确定菌株NY635为碱性假单胞菌(Pseudomonas alcaligenes),并对其进行了药敏试验。
关键词:下口鲇(Hypostomus plecostomus);烂尾病;碱性假单胞菌
下口鲇(Hypostomus plecostomus)俗名清道夫、吸盘鱼、琵琶鱼,属鲇形目(Siluriformes)、甲鲇科(Loricariidae)、下口鲇亚科(Hypostominae)、下口鲇属(Hypostomus)。原产于巴西、委内瑞拉。鱼体呈半圆筒型,侧宽,尾鳍呈浅叉型,口下位,背鳍宽大,腹部扁平,左右腹鳍相连形成圆扇型吸盘。从腹面看,很像一个小琵琶,故又称为琵琶鱼[1]。鱼体呈暗褐色,体上布满黑色斑点。喜欢弱酸性软水,适宜水温20 ℃以上,常吸附在水族箱壁或者养殖池壁上,以舔食青苔或者池中的残饵为食,是水族箱和养殖池里最好的清道夫,经常与大型热带鱼混养,随着休闲渔业的发展,清道夫越来越受人青睐。
对于下口鲇细菌性疾病,国内外没有报道。对于同属于鲇形目的大口鲇、黄颡鱼等已有不少报道,病原菌主要有嗜水气单胞菌、爱德华氏菌、蛭弧菌、普通变杆菌、温和气单胞菌、维氏气单胞菌、哈维弧菌和阪崎肠杆菌等[2-8],到目前为止还未报道过由碱性假单胞菌所引起的细菌性疾病。
2018年6月,天津市西青区某养殖场观赏鱼养殖车间的下口鲇发病,病鱼尾部黏液脱落,进而尾部到腹部肌肉出血、溃烂,严重时尾部烂掉,死亡。本研究对病鱼体表及病灶、肝脏、脾脏、肾脏进行病原菌分离,通过人工感染实验验证其致病性,并对病原菌的形态特征、生理生化特性、分类地位进行了研究。初步证明引起此次下口鲇疾病的病原为碱性假单胞菌(Pseudomonas alcaligenes),并对该细菌的药物敏感性等进行了分析。这是中国首例碱性假单胞菌引起下口鲇疾病报道,为采取有效防治下口鲇烂尾病提供理論依据和参考。
1 材料与方法
1.1 实验对象
病鱼来自天津市西青区某养殖场,呈濒死状态,具有典型的出血、烂尾症状;人工感染用鱼购于天津宝坻区某观赏鱼养殖场,平均体重(25±3)g,平均体长(5±1)cm。
1.2 主要试剂
BHI琼脂、TSB琼脂、MH琼脂、普通营养琼脂、药敏纸片均购自Oxoid公司;VITEK GN鉴定卡及相关生化鉴定试剂及相关配套试剂均购自法国梅里埃生化公司;PCR所用的试剂购于普洛麦格(Promega)生物技术有限公司。
1.3 病原菌分离纯化与寄生虫观察
采用无菌操作,挑取典型症状病鱼病灶、肝脏、脾脏、肾脏等组织,在BHI琼脂平板上划线分离,并置于(28±1) ℃的恒温培养箱内培养24 h后,从平板上选取优势菌落,进一步划线分离,经纯化培养后用30%甘油冻存管于-80 ℃超低温冰箱保存,供人工感染实验和细菌学鉴定用。
取患病鱼病灶处组织黏液、鳍条、鳃等样品在显微镜下检查寄生虫。
1.4 人工感染实验
将分离纯化的优势菌株接种于TSB琼脂上,(28±1) ℃培养24 h后,用3%灭菌生理盐水冲洗菌苔,经分光光度法和平板计数法测定菌悬液浓度为7.5×108 CFU/mL,然后用生理盐水对该菌悬液进行梯度稀释后分别制成7.5×107 CFU/mL、7.5×106 CFU/mL用于感染试验的注射菌液。将购买的健康下口鲇暂养3 d后,开始进行人工感染试验,将150尾健康的试验鱼分成5组,分别为3个实验组、1个阴性对照组和1个空白对照组,每组30尾。实验组从腹部注射0.1 mL的菌液,对照组注射0.1 mL的生理盐水、空白组不做任何处理。注射后观察鱼的发病状况和死亡情况,并且对濒死病鱼及时进行病原菌的分离和鉴定。
1.5 分离菌株的形态学观察与生理生化指标鉴定
将病原菌接种在TSB琼脂上,观察细菌形态和大小,并对其进行革兰氏染色。在无菌条件下挑取单个菌落制成菌悬液,采用VITEK GN鉴定卡对其进行生理生化特性测定。
1.6 16S rDNA基因序列测定和系统发育树分析
挑取单个菌落于30 μL去离子水中,100 ℃金属浴10 min后,12 000 r/min离心1 min后取上清作为PCR模板。16S rDNA序列扩增引物27F:5'-AGAGTTTGATCCTGGCTCAG-3';1 492R:5'-GGTTACCTTGTTACGACTT-3'[9]反应体系50 μL:10×buffer 5 μL;Mg2+(25 mmol/L)3 μL;dNTP 4 μL;27F(20 um)1 μL,1 492R(20 μm)1 μL;ddH2O 33.6 μL;Taq(5 U/μL,TaKaRa)0.4 μL;DNA模板2 μL。扩增条件:94 ℃预变性 5 min,94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min 20 s,30 个循环,72 ℃延伸 10 min,4 ℃保存。扩增产物经电泳检测后送金唯智生物科技(北京)有限公司测序。测序结果通过NCBI中BLAST软件进行在线比对,选取与其相似性最高的细菌16S rDNA基因序列,用MEGA6软件构建系统发育树。选用邻位相连法(Neighbor-joining)获得系统发育树,通过自举分析(Bootstraping)进行系统进化树的评估自举数据集为1 000次。
1.7 药物敏感性实验
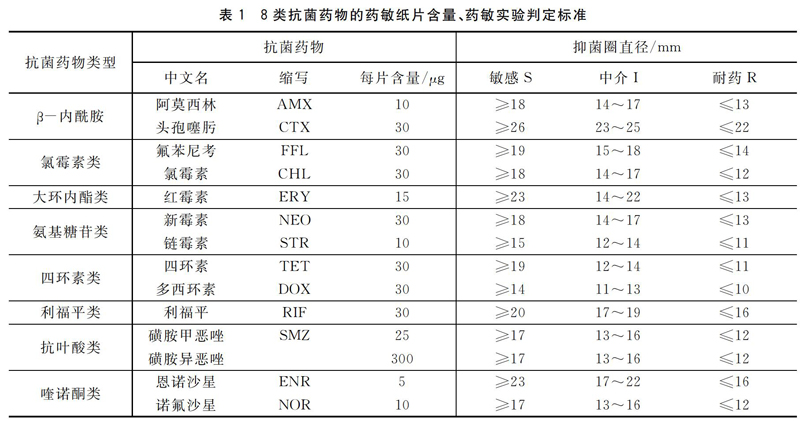
将耐药菌株用生理盐水稀释到0.5麦氏浓度,用无菌的棉蘸子蘸取稀释好的菌悬液,挤去多余的菌液,然后均匀涂布于MH平板上,静置数分钟待平板表面干燥后,用镊子夹取药敏纸片置于平板表面并压紧,28 ℃倒置培养24 h后用直尺量取抑菌圈,结果判断参照美国临床实验室标准化委员会(CLSI)标准[10]。药敏纸片购自Oxoid公司,在有效期内使用。抗菌药物的药敏纸片含量、药敏实验判定标准见表1。
2 结果与分析
2.1 病原菌的形态学观察和生理生化鉴定结果
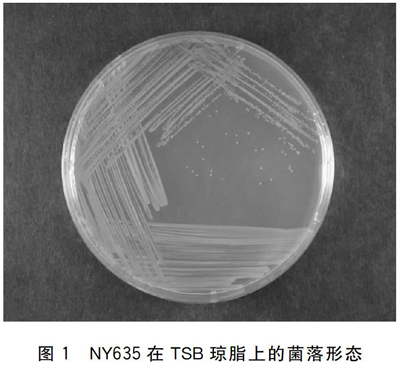
通过镜检,未从发病的下口鲇病灶处组织黏液、鳍条、鳃等处检验出寄生虫。从发病的下口鲇病灶出分离出一株优势菌,命名为NY635。对其进行分离纯化培养,在TSB琼脂平板上培养18~24 h后,菌落为黄色,圆形,表面湿润,不透明,边缘整齐(见图1)。革兰氏染色为阴性,菌体呈杆状,(0.3~0.4)μm ×(1.0~2.1)μm,单个或成对排列(见图2)。使用VITEK GN鉴定卡对其进行生理生化鉴定,结果为碱性假单胞菌,生理生化反应见表2。
2.2 致病性验证
感染实验共进行了7 d,如图3所示,7.5×108 CFU/mL、7.5×107 CFU/mL、7.5×106 CFU/mL,在24 h内均有鱼出现死亡,7.5×108 CFU/mL在第六天全部死亡,7.5×107 CFU/mL、7.5×106 CFU/mL两组在实验结束后死亡累计率分别为63%和27%。阴性对照组和空白对照组均无死亡(见图3)。人工感染后实验鱼游动缓慢,活力下降,鱼体鳞片脱落,尾部出现红肿,肌肉出血、溃烂,与自然感染下症状一致。而阴性对照组和空白对照组未出现任何异样。参考李长红[11]等(2009)的改良寇氏法,计算出菌株NY635对下口鲇7d的LD50为3.98×106 CFU/mL。
2.3 病原菌16S rDNA基因序列测定和系统发育树分析
由引物 27F 和 1 492R 扩增菌株NY635的16S rDNA基因序列,获得有效基因序列长度为1 351 bp,通过Blast 检索发现其与假单胞菌属序列同源性最高。从中找出相似度较高的10株菌株的16S rDNA基因序列构建系统发育树,如图4所示菌株NY635与Pseudomonas alcaligenes NBRC 14159T(BATI01000076)聚成一个分支,序列相似度在99%,亲缘关系最为相近,再综合生化鉴定结果,我们判定NY635为碱性假单胞菌。
2.4 药物敏感性实验结果
将MH平板放入28 ℃的培养箱内24 h后,用直尺量取抑菌圈直径,结果见表3。从结果上看NY635仅对头孢噻肟、新霉素、利福平敏感,对其余的药物均耐药。
3 讨论
目前有关养殖鱼类烂尾病病原菌的研究已有很多,鲇鱼苗烂尾病是由一种气单胞菌引起[12]。南方大口鲶烂尾病,李成伟[3]等的研究结果是由爱德华氏菌感染引起的,舒妙安[13]等从患烂尾病的黄鳝中分离出碱性假单胞菌。本研究从患烂尾病的下口鲇中分离出来的NY635菌株为优势菌株,通过回感实验验证该菌对清道夫具有较强的致病性,人工感染的清道夫表现出尾部溃烂等与自然感染相同的症状。经细菌形态特征、生理生化和16S rDNA基因序列比对等多种方法将该菌鉴定为碱性假单胞菌。目前碱性假单胞菌导致下口鲇患烂尾病并导致大量死亡的报道国内外尚属首次。
药物敏感性试验表明,NY635仅对头孢噻肟、新霉素和利福平敏感,对其他药物均严重耐药。磺胺类药物、多西环素等最早应用于水产养殖[14],抗菌药物使用的时间越长,鱼类病原菌的敏感率越低。另外观赏鱼在防治病害时,不需要考虑药物残留的因素,对抗菌药物使用剂量和使用频率问题也没有限制,也是造成NY635对抗菌药物敏感性低的原因。David[15]等对观赏鱼源细菌的药物敏感性研究也证实了这一点,徐立蒲[16]等研究也发现,不同种类鱼源病原菌中,观赏鱼源病原菌对抗菌药物敏感性最低。虽然在观赏鱼养殖过程中滥用药物,不会危及食品安全也无需考虑药物残留的因素,但是抗生素滥用也会破坏水域生态环境,未进行正确诊断病原和筛选敏感药物,而随意选择抗菌药物用于防治细菌性疾病,治疗失败的风险增大,而且延误治疗的最佳时机,应该引起人们的思考。本研究中,下口鲇烂尾病主要是由于清道夫受到损伤后感染碱性假单胞菌而引起的,因此预防此病必须在运输、放养、捕捞的过程中尽量避免机械损伤,并且保持池中水质良好。治疗此病的时候不要盲目滥用药,以免造成病原菌对药物选择的压力变大。
参考文献:
[1] 张静,张劲松,刘园园,等.罗非鱼与清道夫鱼温泉水混养实验[J].河北渔业,2014(5):36.
[2] 林春友,金宝全,樊振忠.天津地区养殖南方大口鲶常见病记述[J].水利渔业,2004,24(04):74-75.
[3] 李成伟,耿毅,袁旦一.南方鲶鱼种烂尾、断须病的診治[J].科学养鱼,2011(10):53-54.
[4] 杨移斌,肖国初,欧仁建,等.一例大口鲶体表溃烂病的诊断与治疗[J].科学养鱼,2013(6):64-65.
[5] 李永文,朱文漓,顾继锐,等.大口鲶病原菌蛭弧菌的分离及其生物学特性研究[J].淡水渔业,2006,36(2):9-12.
[6] 曹海军,李永文,雷雨,等.大口鲇致病菌的分离鉴定、系统发育分析及相关特性的研究[J].微生物学报,2007,47(1):1-6.
[7] 张锡林,王有模,唐学清,等.大口鲶细菌性肠炎的病原分离和病理学研究[J].淡水渔业,1998,28(3):6-7.
[8] 刘杰,韦斯祺,刘斌,等.一例南方大口鲶烂尾病病原阪崎肠杆菌的分离鉴定与药敏实验[J].广西畜牧兽医,2015,31(2):96-99.
[9] LANE D J.16S/23S rRNA sequencing.Nucleic acid techniques in bacterial systematics. E.Stackebrandt and [M].Goodfellow,eds.NewYork,NY,John Wiley and Sons,1991:115-175.
[10] National Committee for Clinical Laboratory Standards.Performance standards for antimicrobial susceptibility testing,fiveteenth informational supplement Nccls document [M]100-S15.Wayne:NCCLS,2005:1-159.
[11] 李长红,陈炯,史雨红,等.宁海地区香鱼弧菌病病原菌鉴定[J].微生物学报,2009,49(7):931-937.
[12] 黄文芳,段圣和,温桂芳,等.鲇鱼苗烂尾病病原体的初步研究[J].华南师范大学学报,1994(04):18-24.
[13] 舒妙安,马有智.黄鳝烂尾病病原的研究[J].中国兽医学报,2000,20(5):465-467.
[14] 李爱华.水产养殖中使用的抗菌药物及细菌耐药性[J].中国水产科学,2002,9(1):87-91.
[15] VERNER-JEFFREYS D W, WELCH T J,SCHWARZ T, et al.High prevalence of multidrug-tolerant bacteria and associated antimicrobial resistance genes isolated from ornamental fish and their carriage water[J].PLoS one,2009,4(12):1-9.
[16] 徐立蒲,王静波,曹欢,等.北京市主要养殖鱼类病原菌药物敏感性分析[J].北京农业,2012(36):79-81.
Isolation and identification of pathogen which caused tail rot disease of Hypostomus plecostomus
XU Yun-Xia,CUI Lu-Wen,ZHAO Liang-Wei,DENG Wei, FENG Shou-Ming
(TianJinCenter for Control and Prevention of Aquatic Animal Infectious Disease,Tianjin 300221,China)
Abstract:The characteristics of pathogenic bacteria causing tail rot were isolated from the liver,spleen and the kidney in Hypostomus plecostomus,obtained NY635 strain,and used NY635 strain to infect the Hypostomus plecostomus which weighted at 20~30 g/ind.The infected Hypostomus plecostomus caused symptoms similar to those of naturally occurring,and same bacteria were isolated from infected Hypostomus plecostomus.It can be confirmed that NY635 is the pathogen bacteria of Hypostomus plecostomus rotten tail disease.According to the morphological? features ,physiological and biochemical characteristics and 16S rDNA gene sequencing,NY635 stain was identified as Pseudomonas alcaligenes,and drug sensitivity test was carried out.
Key words:Hypostomus plecostomusis; tail rot disease; Pseudomonas alcaligenes
(收稿日期:2019-10-23)
作者簡介:冯守明(1965-),男,博士,研究员,研究方向:免疫学。E-mail:[email protected]。

