利用化学实验异常现象提升学生核心素养
何婷婷
摘 要:科学探究与创新意识是五个化学核心素养之一。化学实验不仅是科学探究的重要载体,也是提升学生核心素养的有效手段。但是由于各种原因,实验过程中有时会出现异常情况,若教师不及时分析,必然会对学生的认知造成错误的影响。为此,针对实验异常现象进行分类,继而分析产生异常现象的原因,让学生理解“异常现象”蕴含的“合理现象”,从而提升学生的化学学科核心素养和完善化学学科的知识框架。
關键词:化学实验;异常现象;核心素养
“我听说了,就忘记了,我看见了,就领会了,我做过了,就理解了。”美国华盛顿大学的这句话突出了“做中学”的重要性。“做中学”不可或缺的重要手段便是化学实验,化学实验不仅能激发学生学习化学的兴趣,而且是提升学生科学探究能力的最佳方式。但是在具体教学过程中进行的实验,教师演示或者学生实验,由于多种不确定原因,会出现各种“异常现象”。实验过程中“异常现象”的出现,有时是教师深入分析的契机,但大部分还是会对学生掌握正确的实验现象造成困扰。因此教师若不及时加以指导和分析,学生会对“异常现象”耿耿于怀,知识层面上留下误区,能力层面上得不到很好的发展,从而影响教学效果和学生能力的发展。因此,教师在教学过程中要变“异常”为“正常”,深挖“异常现象”中的化学道理,这不仅是培养学生实事求是的态度、提升科学探究和科学态度的核心素质的一种有效的方法和途径,同时也对教师提出了更高的专业要求和临场发挥的能力要求。
一、从已有知识迁移产生的“异常现象”
学习迁移是指一种学习对另一学习的影响,即已获得的知识技能、过程方法、情感态度等在变化的情境中的运用。学习的迁移现象多种多样,按性质可将其分为正迁移和负迁移。正迁移是指已获得的知识对另一种学习起积极的促进作用。负迁移也称干扰迁移,是指已有经验对另一种学习起阻碍或干扰作用。
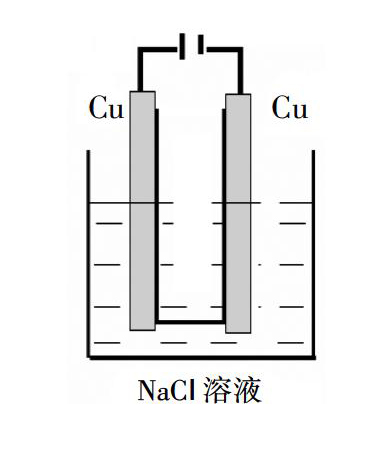
例1:电解精炼铜时,阳极材料为粗铜,阴极材料为纯铜,电解质溶液为硫酸铜。让学生写出电极反应,学生可以很熟练地写出阳极:Cu-2e-=Cu2+;阴极:Cu2++2e-=Cu。于是在《实验化学》中用Cu做电极电解NaCl溶液,给出以下装置,请同学们猜测实验现象。
同学甲:阳极上产生黄绿色气体,阴极有大量气泡,且滴加酚酞阴极溶液变红。
同学乙:不对,阳极没有黄绿色气体产生,阳极的Cu棒变细,溶液变成蓝色。
“那么是不是像同学们刚才分析的那样呢?请同学们按装置组装仪器,仔细观察。”
现象:与外界直流电源接通后,阴极的Cu丝上产生大量气泡,阳极Cu丝由粗变细。电解半分钟内,阳极周围出现白色浑浊,接着有橙黄色沉淀,一段时间后,橙黄色沉淀沉聚在电解槽底部。实际电解过程中的实验现象始终没有出现同学预测的溶液变蓝现象。
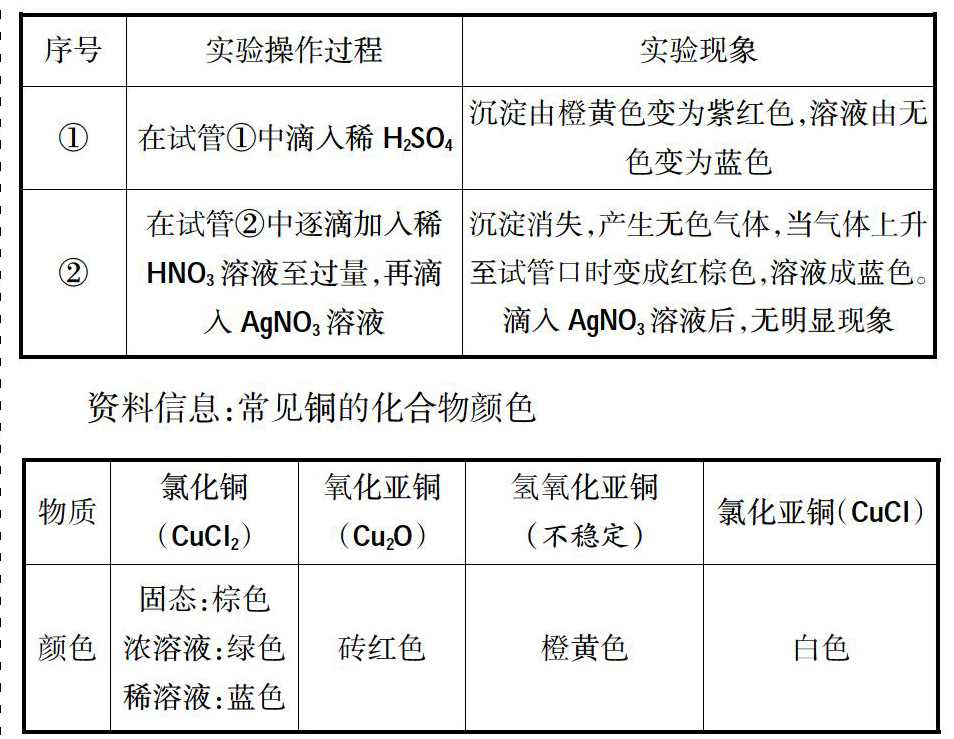
实验探究:将电解槽底部的橙黄色沉淀取出,用蒸馏水洗涤沉淀2~3次,分装在两支小试管①、②中的实验操作和现象:
反思:同学甲、同学乙的分析都不错,阳极产物是Cl2,阴极产物是H2和NaOH,而不进行分析理解,这样往往就掉入我明明“懂”的,为什么得不了高分的怪圈中。同学乙的迁移还是有一定道理的,当活泼Cu做电极时,阳极Cu是活泼金属失去电子,当同学认定是“就是这样”时,“异常现象”充分激起了学生的学习兴趣,很想知道为什么会这样?
同时通过“实验异常现象”,可以让学生体会到化学变化需要一定的条件并遵循一定的规律,遇到任何化学问题都需要具体内容具体分析,以提升学生变化观念的核心素养。
例2:在电化学内容时,教师一般会说有两个活泼性不同的电极是构成原电池装置的条件之一,且活泼性较强的电极一般做负极,于是在实验中设置了两组原电池Mg—Al(HCl溶液)和Mg—Al(NaOH溶液),当电解质是HCl溶液时,同学们观察到Al电极上产生了大量气泡,于是同学们验证了活泼Mg做负极这一结论。当电解质换成NaOH溶液时,同学们惊奇地问道:“为什么是Mg电极上产生气体呢?Mg不是比Al活泼吗?”“确实Mg比Al活泼,但是设计成原电池的首要条件是能发生自发进行的氧化还原反应,在NaOH溶液中,Al能发生反应,而Mg不能,因此判定原电池的正负极时,我们还需要考虑电解质溶液!”
反思:通过实验中的“异常现象”,让学生深刻体会到活泼金属做负极只是判断电极的一般规律,当电解质溶液等外部条件发生变化时,电极的正负极也可能产生相应的变化。
二、因试剂用量的差异引起的“异常现象”
学生实验是让教师既爱又恨的课型。因为实验过程中,学生的实验习惯非常差,就连最简单的药瓶取用,固体药瓶是用药匙的大头还是小头,液体药品体积的多少都要强调很多遍,然而学生在实际操作过程中仍然没有量多量少的概念,很是随意。量变引起质变,往往就是这些坏习惯,导致了一些“异常现象”。
例如,《实验化学》中铁元素的检验,以补血药“速力菲”说明书部分内容为情景进行实验探究。
【规格】每片琥珀酸亚铁含量约为0.1g。
【组成与性状】内含Fe2+的无水碱式盐,含量约为34.0%~36.0%的薄膜糖衣片。
【适用症状】用于缺铁性贫血症预防及治疗。
【用法用量】预防量成人:0.1g/日、30~60mg/日;治疗量0.2g~0.4g/日、小儿:0.1g~0.3g/日或遵医嘱。
【储藏】密封、干燥避光、阴凉处保存。
【药物相互作用】与维生素C同时服用,可增加本品吸收效果。
为了探究药品“速力菲”中确实存在Fe2+且没有变质,学生设计了如下实验步骤:(1)取一颗药片研碎后的粉末少量置于试管中,在该试管中加入少量蒸馏水溶解;(2)在该溶液中加入KSCN溶液,然后滴入H2O2溶液,若看到滴入KSCN不变红,滴入H2O2后,溶液变成血红色,则“速力菲”中含有Fe2+。事实胜于雄辩,按照同学设计的方案进行实验后,一组同学小声嘀咕:“为什么变红后颜色又褪去了啊?”
探究:利用Fe2+的还原性,Cl2将Fe2+氧化到Fe3+,氧化得到的Fe3+与溶液中的SCN-结合显血红色。后血红色褪去,可能的情况是:Fe3+被还原了或者SCN-反應了。到底是哪种情况,也可设计实验验证。方案一:在褪色的溶液中再滴加H2O2,若仍变血红色,说明是Fe3+被还原了;方案二:在褪色的溶液中滴加KSCN,若变血红色,说明是KSCN反应了。
实验证明是KSCN与H2O2发生了反应出现了“异常现象”。KSCN为什么能与H2O2发生反应呢?原来SCN-离子C和N共用三对电子对,C和S共用一对电子对,S又从外界得到一个电子,因此SCN-具有一定的还原性。因此当H2O2过量时,SCN-会被氧化,从而出现了血红色溶液褪去的现象。
反思:在血红色溶液褪去的探究实验中,让学生控制H2O2溶液少量和过量做对比实验,直观地感受实验过程中的用量对实验也起着至关重要的作用,“过多”或“过少”都有可能观察不到正常的实验现象。当出现“异常现象”时,教师如果能正确引导,积极参与,共同分析不仅提升自身课堂的驾驭能力,而且能培养学生敢于质疑、勇于创新、严谨求实的科学态度。
三、因“副反应”引起的实验异常
例如,苏教版必修1 P88的观察与思考的实验3的实验过程如下:取一支试管并加入5 mL二氧化硫溶液,滴加氯化钡溶液,再滴加0.5 mL 3%的过氧化氢溶液,振荡,放置片刻后滴加稀盐酸,观察实验现象。
学生观察到的实验现象是滴入BaCl2溶液有少量浑浊;再加0.5 mL的3%的H2O2溶液后有大量白色沉淀生成,静置后加稀HCl,白色沉淀不溶解。善于思考的同学立刻提出质疑,为什么滴入BaCl2溶液会有浑浊,因为弱酸不能制备强酸。
反思:教师肯定了学生的分析并表扬该学生观察仔细,逻辑清晰。于是抛砖引玉让学生谈谈他们的猜测,白色浑浊既然不是BaSO3只能是BaSO4了。学生顿时豁然开朗,宏观现象的背后是微观过程电子的转移,那么能得电子的氧化剂是什么?我想,大部分教师都能很好地引导学生仔细观察实验现象,深入进行探究,从而提升学生的化学核心素养。
参考文献:
[1]杨文斌.走出化学实验教学的误区[J].化学教学,2009(3).
[2]覃孔彪.学生自主实验的课题研究与思考[J].中学化学教学参考,2009(12).
[3]方陈结.对高一化学两个实验的改进[J].中学化学教学参考,2009(3).

