“四步法”突破新情境下氧化还原方程式的书写
胡罕瑾

摘? ?要:以“新情景下氧化还原方程式的书写”复习为课例,从“情境-模型”双向建构入手,注重化学概念的理解,通过剖析典例、引导学生自主分析、归纳提炼出解题的思维模型,并进行针对性练习,让学生在实践中不断深入理解和完善思维模型,完成证据推理和模型认知,提升高三化学复习的质量和效率,提升化学学科素养。
关键词:“四步法”;氧化还原方程式的书写;高三化学;复习
建构主义理论认为,学生是主动地建构知识而不是简单被动地接受信息。“情境-模型”的双向建构是一种重要的科学研究方法,是指通过设计“情境问题串”和构建“思维模型”两个教学方向,使之相互协调、持续发力。在了解学生已有知识和经验的基础上,驱动学生进入相关的教学情境,通过自主探索发现的方式,驱动学生建立个性的知识和能力结构的思维模型,引导学生将化学知识与技能进行梳理整合,由此建立整体思维模型,并运用模型揭示问题的本质和规律,培养学生分析问题、解决问题的能力,内化知识体系,强化学科的实践应用,最终实现核心知识与核心素养的双向自我构建[ 1 ]。
氧化还原反应是中学阶段的基本核心概念,在化学基础理论知识中占有极其重要的地位,贯穿于中学化学课程的始终。它不仅是一种十分重要的化学反应类型,还是元素及其化合物学习的重要理论载体,具有重要的学科价值、社会价值和较为丰富的化学学科核心素养发展价值[ 2 ]。
新情景下氧化还原反应方程式的书写是一种新题型,没有在教材中学过的新知识、新概念作为试题信息给与。这类方程式多以化工流程或文字描述的形式,叙述反应的过程,需要学生从题中信息中提炼出氧化剂和还原剂,进而分析反应中得失电子情况。
这类试题大都是中学教材没有见过的方程式,在新情境中,学生很难快速准确地提取有用的信息,再加上学生没有掌握正确的思维方法、整合提炼信息的能力不强、基本概念模糊不清、氧化还原反应方程式配平和离子方程式书写不熟练等因素,导致这一类试题的得分率不高。笔者通过教学实践,认为思维建模可以帮助学生建立做这类题的思维模型,通过双向建构有效提高高三化学复习效率和质量。本文基于发展化学学科素养进行整合设计,通过“情境-模型”双向建构思维模型,用“四步法”进行实施,突破新情境下氧化还原方程式的书写,强化对氧化还原反应的认识、理解和应用,教学设计如下。
1? 教学目标
(1)知识与技能 :通过题给信息正确书写氧化还原方程式或离子方程式,培养学生整合、提炼信息的能力。
(2)过程与方法:通过典型例题分析,引导学生归纳出信息方程式书写的方法,准确快速地书写信息方程式。
(3)情感态度与价值观:①通过信息方程式的书写,培养学生树立正确的化学学科思想(如守恒观、微粒观、变化观等),并用于解决化学问题。②通过合作、交流的学习体验,使学生认识到交流与合作的重要性,让他们敢于提出不同的见解,敢于修正自己的错误观点。
2? 教学重难点
(1)重点:方程式配平步骤和规律。
(2)难点:新情境下方程式的产物推测。
3? 教学过程
环节一:剖析典型例题,感知模型,让学生了解题型并初步建构模型。
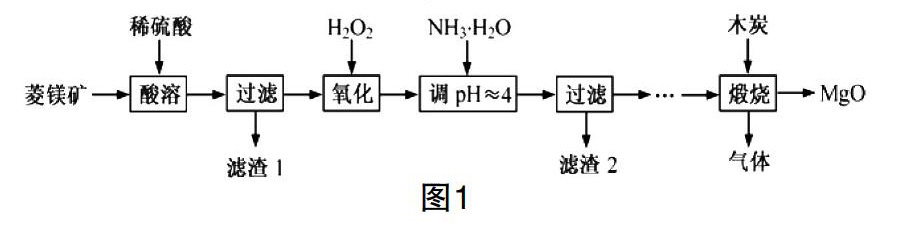
【例题 】(节选)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如图1[ 3 ]:
写出加入H2O2 氧化时,发生反应的离子方程式。
【分析】这道典型例题以化学工艺流程做为载体,需要学生从情境中获取、整合有效信息去书写。
第一步:依题意可知“加入H2O2 氧化”过程中氧元素化合价降低,H2O2作氧化剂,H2O是还原产物;在此基础上引导学生分析题干信息,获知菱镁矿原料中含少量FeCO3,结合微粒的性质分析可得还原剂为Fe2+,对应的氧化产物是Fe3+。把离子方程式按“还原剂+氧化剂 — 氧化产物+还原产物”的模式初步写成:Fe2+ +H2O2 — Fe3++ H2O。
第二步:紧接着让学生分析反应前后元素化合价的升降数量,由Fe2+→Fe3+,铁元素升了1价,由H2O2→H2O,氧元素降了1价;1molH2O2共得到2mol e-,1mol Fe2+失去1mol e-,故在Fe2+前配2,在氧化產物Fe3+前配2;在H2O2前配1,H2O前配2,即:H2O2 +2Fe2+ — 2H2O+2Fe3+。
第三步:反应在稀硫酸中进行,在左边补充H+即:2Fe2++H2O2+ H+ — 2Fe3++2H2O。
第四步:分析反应前后阴阳离子所带的电荷总数,依据电荷守恒及H、O原子守恒在H+前配2,完成离子方程式的书写:2Fe2++H2O2+2H+ = 2Fe3++2H2O。
这里通过剖析典型例题,引导学生自主分析梳理,让学生认识到这类方程式书写有着程序性的步骤,初步感知书写这类方程式的思维模型,为之后思维模型的建构奠定了基础[ 4 ]。
环节二:引导分析试题的背景及考查的知识点,通过书写、评价、归纳完善模型。
通过导学案引导自主思考、小组进行交流展示,设计问题串如:配平所有化学反应方程式的核心思想是什么?如何分析化合价的变化?有机物中元素化合价的标定有何技巧?溶液中的氧化还原反应,常见物质反应产物如何预测?“新情境”通常是指题给的哪些信息?如:溶液的酸碱性、给定的生成物、原电池或电解池中的电解质、离子交换膜等等。“情境-模型”是指学生依据具体的情境问题,理解化学原理,自主发现内在的化学规律,建构属于学习者的知识经验及方法的思维模型。再利用所构建的思维模型来解决实际问题,学生通过检查再完善思维模型,加深对原理知识的深化,达到发展学生思维的目的[ 1 ]。在典例剖析的基础上,引导学生小组合作归纳出这类方程式的书写步骤。总结步骤如下:
(1)列两侧物质——两“剂”两产物
根据题干的信息或流程图,明确题目给出的反应物和生成物,确定氧化剂和还原剂,氧化产物和还原产物。按“还原剂+氧化剂——氧化产物+还原产物”初步列出方程式。
(2)配电子守恒——标价态、析升降
根据化合价升降守恒规律,标出四物中变价元素的化合价升降数目并分析,实现反应前后化合价升降总数相等。配平氧化剂、还原剂的化学计量数。
(3)配电荷守恒——看环境、补离子
结合题干信息中溶液所处的环境,根据电荷守恒补上缺项离子,使反应前后阴阳离子所带的电荷总数相等。在补离子时应注意:酸性环境中,反应物或生成物都可补H+,但不能出现OH-。碱性环境中,反应物或生成物都可补OH-,但不能出现H+。而在中性环境中,H2O可以在任意溶液的配平过程中灵活使用,反应物或生成物补OH-、H+均可。
(4)配原子守恒
为确保反应前后各元素的原子数目相同,再次根据原子守恒配平方程式。
守恒思想是配平氧化还原化学反应方程式的核心,依据变价元素、列出四物是基础,标价态、析升降是关键,看环境、补离子是难点,根据守恒规律确定系数是保证。引导学生自主建构思维模型,帮助学生理解氧化还原反应的核心概念,提高了解题能力,掌握核心知识,提升学科的核心素养。
通过精选一道高考真题进行当堂练习,引导学生根据氧化还原反应方程式的书写模型,巩固模型的运用、提高分析和解决问题的能力。建构合理的思维模型,巩固提升解决问题的能力,促进发展学科核心素养思维。在模型建构的基础上精选有针对性的练习题,强化训练,加深学生对思维模型的理解和应用[ 3 ]。
环节三:归纳总结信息方程式书写规律,建构解题模型。
借助一道练习题,通过小组合作学习让学生明确解题方法,规范解题步骤,再次理清知识线索,帮助学生理解新情境下氧化还原反应方程式的书写模型。突破缺项微粒的确定这个难点,快速准确的运用模型,提高有效解决相关问题的能力。
建构思维模型,挖掘问题的本质,建立解决方案。并通过相关练习实现模型的应用,在解题过程中检验和完善思维模型,提炼出能反映问题本质的模型,能普遍适用于相似问题情境来解决这一类的问题[ 4 ]。引导学生自主归纳总结书写的規律见图2。
4? 教学反思
新情景下信息方程式书写考查范围广,内容多,形式多样,要求学生具有扎实的基础知识和在陌生的情景中快速准确地提取有用信息并整合信息的能力,学生书写是不注意题目环境、书写速度比较慢、错误率高。教师需要教学中反复让学生训练,并引导学生归纳总结、提速高效书写。
综上所述,通过问题讨论,层层深入,解题建模、突破难点,激活了学生的学习热情,使每个学生都能融入课堂,积极参与,主动思考。运用“情境-模型”模型,提升思维广度的同时也突破了书写的难点。通过针对性练习,有助于学生深刻理解新情境下氧化还原反应方程式书写的规律,即“为理解而学习”[ 4 ]。
在高三化学复习过程中,通过双向模型的建构和运用来引导学生积极参与解题方法的提炼与归纳,进行思维模型的建构,获得解决问题的“支架”。让学生解决问题有“法”可依,引导学生形成清晰的解题思路,多渠道获取知识来实现高效复习课堂。
参考文献:
[1]黄秀娟,陈迪妹.高中化学“情境·模型”教学模式的实例研究——以苏教版化学1“从铝土矿中提取铝”为例[J].化学教与学,2017(11):87-90.
[2]张仿刚,朱思光,盛连蔚.发展核心素养下的高三主题式复习教学设计——以“氧化还原反应”为例[J].化学教与学,2018(11):25 .
[3]吴学录,在化学教学中注重提升学生的信息素养——以2013年江苏化学高考试题为例[J].中学课程辅导(江苏教师), 2014(3):37.
[4]林立豪.思维模型建构在高三化学复习中的实践——以“陌生情境下氧化还原反应离子方程式的书写”复习课为例[J].中学教学参考,2019(6):68—70.

