质谱快速分析猪肉中痕量沙丁胺醇及克伦特罗
肖义坡 卢海艳 吕邵军 谢少贤 王兆征 陈焕文
摘要采用内部萃取电喷雾电离质谱(iEESIMS)技术,在无需样品预处理的前提下,采用标准加入法直接对猪肉组织中沙丁胺醇与克伦特罗进行定性和定量分析。结果表明,本实验对猪肉组织中沙丁胺醇与克伦特罗具有较高的灵敏度,单个样品单一指标的检测时间少于30s。在0.01~1000μg/kg浓度范围内,信号强度对数(Y)与浓度对数(X)具有较好的线性关系,定量限分别为6.2和9.8ng/kg。本方法分析速度快、样本耗量少、灵敏度高,适用于猪肉中痕量沙丁胺醇与克伦特罗等“瘦肉精”的快速检测。
关键词内部萃取电喷雾电离;沙丁胺醇;克伦特罗;“瘦肉精”;组织分析
1引言
“瘦肉精”是指一类具有相似结构的β激动剂化合物,常见的主要有沙丁胺醇与克伦特罗,临床上一般用于治疗休克和哮喘等疾病[1\]。由于该类药物具有抑制动物脂肪的合成、促进瘦肉生长和重新分配家畜脂肪与瘦肉比例等作用,常被非法添加在家畜的饲料中来提高畜牧生产效率。根据农业部公告第235号,沙丁胺醇与克伦特罗为禁用物质,在食品(肉中)不得检出。常规情况下猪肉中“瘦肉精”检测为阳性的含量水平在0.1~100μg/kg之间。人食用含沙丁胺醇与克伦特罗等“瘦肉精”成分的肉类产品后,会导致血压升高、心率加快等反应,甚至影响水上及部分田径运动项目的成绩,长期服用也对心血管系统带来严重的危害,甚至导致生命危险[2\]。因此,建立一种肉质食品中“瘦肉精”的快速、准确的检测方法,对保障食品安全具有重要意义[3~6\]。
目前,动物组织中“瘦肉精”的检测方法主要包括胶体金免疫层析法[7,8\]、酶联免疫吸附法(ELSA)[9,10\]和表面等离子体共振生物芯片[11,12\]、气相色谱质谱法(GCMS)[13,14\]、高效液相色谱质谱法(HPLCMS)[15~17\]、高效液相色谱法[18,19\]等。胶体金免疫层析法,主要用于大量筛查,但检测结果因受环境或者人为因素的影响而存在一定误差,适合初步判定;酶联免疫吸附法,虽然灵敏度较高,但存在假阳性结果,重现性与特异性较差;HPLCMS法与GCMS法操作过程繁琐检测效率较低,难以满足大批量的样品检测要求。
内部萃取电喷雾电离质谱(iEESIMS)技術直接将萃取剂导入到组织样品内部,可实现组织样品内部小分子代谢产物等组分的直接质谱分析[20~23\]。本研究基于iEESIMS技术,开发能直接判断肉质食品内部沙丁胺醇与克伦特罗的内部萃取电喷雾电离线性离子阱质谱(iEESILTQMS)检测平台,建立对猪肉中沙丁胺醇与克伦特罗进行准确定性及快速定量的检测方法,并用于分析猪肉实际样品。
2实验部分
2.1仪器与试剂
内部萃取电喷雾电离源(iEESI)为本实验室自制;LTQXL线性离子阱质谱仪并配有Xcalibur数据处理系统(美国ThermoScientific公司);石英毛细管(内径0.10mm,外径0.19mm,美国Agilent公司);甲醇(色谱纯,美国ROE公司);实验用水为二次蒸馏水。
标准品:克伦特罗(批号00435479)、沙丁胺醇(批号103578453245)均来自LaboratorienBerlinAdlershofGmbH公司。标准储备液:称取适量沙丁胺醇与克伦特罗各标准品,加蒸馏水使溶解,各制成10mg/L的标准贮备液,
18℃避光保存。标准品溶液:将标准储备液分别配制成浓度为0.01,0.1,1,10,100和1000μg/L的标准溶液,按2.2节操作,供iEESIMS检测使用。
猪肉样品由江西省体育科学研究所提供,经国家标准方法检测不含沙丁胺醇与克伦特罗等β受体激动剂。
2.2实验方法
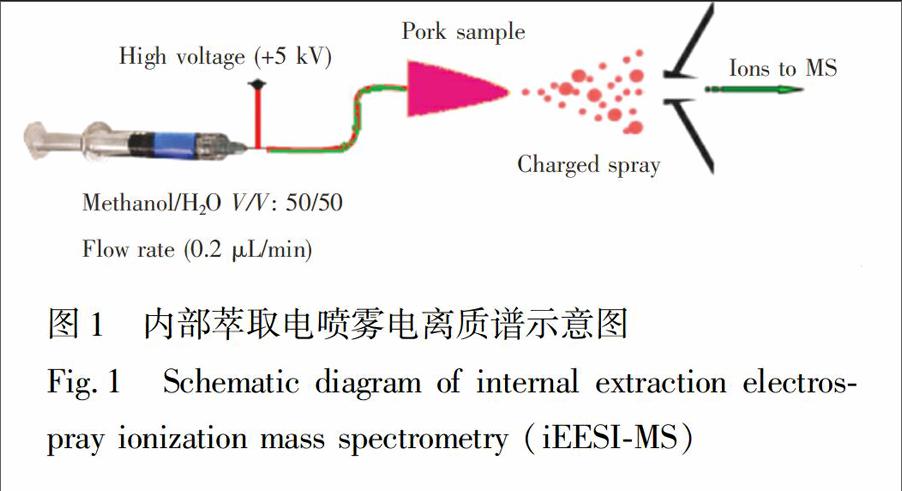
iEESIMS原理如图1所示。将石英毛细管插入组织样品内部,毛细管尖端与样品顶端相距2mm;样品顶端到质谱进样口的距离为4~5mm;实验选择甲醇水(1KG-3∶KG-51,V/V)作为萃取剂,将萃取溶剂由毛细管直接导入到猪肉样品内部,流速为1μL/min。
在微量进样针的钢针部位施加正高电压,在电场的作用下,猪肉样品尖端产生大量承载猪肉化学组分的微小带电液滴(电喷雾),微小带电液滴中的分析物去溶剂化后得到待测物离子,进行质谱检测。质谱仪设置为正离子检测模式,PS05351.eps,Y,PZ#TS((1HT5”SS
(iEESIMS))TS)质量扫描范围m/z50~400,离子源电压为5kV,离子传输管温度设置为150℃。在进行串联质谱分析时,母离子隔离宽度为1Da,碰撞能量为16%~25%,碰撞时间为50ms;离子透镜电压及其它检测参数由LTQTune系统自动优化。JP
2.3定性与定量分析
选择采用国家标准方法[24,25\]及iEESIMS方法均检测不到沙丁胺醇或克伦特罗信号的猪肉为空白样品;其次采用加标法处理样品,将空白猪肉样本切成体积一致的小长条(20mm×2mm×2mm,155mg)浸泡在沙丁胺醇与克伦特罗标准溶液中,浸泡10h后进行iEESIMS分析,获得沙丁胺醇与克伦特罗的特征碎片,完成定性分析;最后采用加标浓度法结合目标离子的二级特征碎片离子信号进行定量分析,建立在0.01~1000μg/kg范围内待测物离子特征碎片强度的对数(Y)与加标浓度的对数(X)之间的关系曲线,并采用此曲线完成定量分析。
3结果与讨论
3.1猪肉中沙丁胺醇与克伦特罗的定性分析
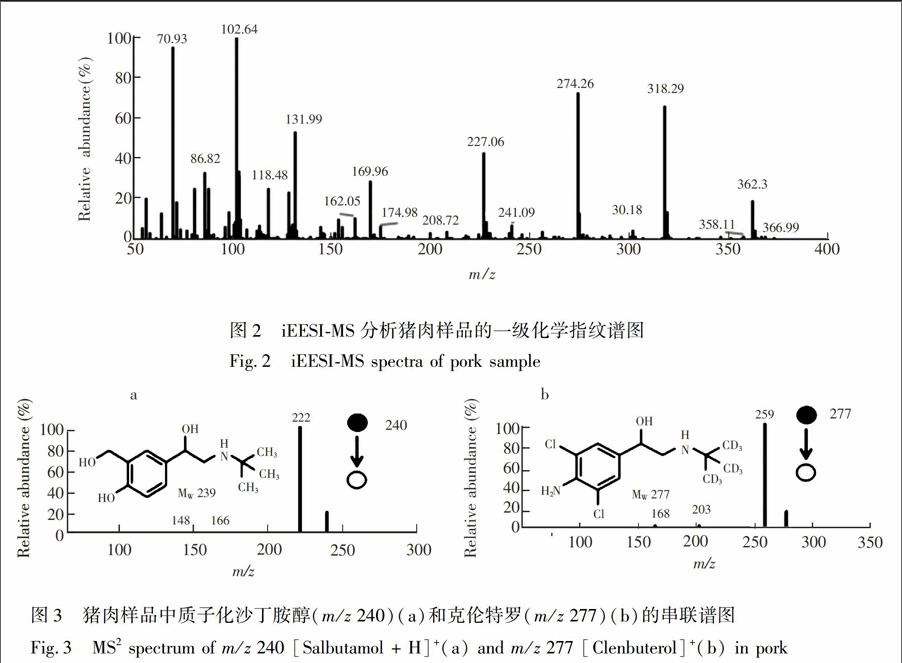
图2为在m/z50~400质量范围内猪肉样品的iEESIMS一级化学指纹谱图。在实验条件下,沙丁胺醇(MW239)与克伦特罗(MW277)都能够在iEESI过程中形成质子化准分子离子,分别在一级质谱中形成准分子离子峰m/z240及277。但是,猪肉中沙丁胺醇与克伦特罗的含量远小于其它猪肉中常见组分,如氨基酸、磷脂等,所以在一级质谱中(图2),二者的信号几乎淹没在其它大量组分物质的信号中。因此,仅依赖一级质谱难以对猪肉中是否含有微量沙丁胺醇与克伦特罗进行判断。
为避免假阳性结果,按照实验条件对离子m/z240\[Salbutamol+H\]+和m/z277\[Clenbuterol\]+进行CID实验,所获得的MS/MS谱图如图3所示。在CID条件下,母离子m/z240主要碎片离子为m/z222,166和148,碎片离子m/z222是由母离子丢失一个水分子得到的,这与文献\[26\]报道一致。经分析推断,碎片离子m/z166可能是由m/z222继续失去\[-C(CH3)3\](m/z57)得到,碎片离子m/z148是由m/z166失去一个水分子得到的。同样地,选择质子化的m/z277进行CID实验,主要碎片离子为m/z259和203,碎片离子m/z259由母离子丢失一个水分子后产生,该碎片离子不稳定,继续丢失\[-C(CH3)3\](m/z57)得到碎片离子m/z203,这与文献\[27\]报道一致。
3.2猪肉中沙丁胺醇与克伦特罗的定量分析
3.2.1线性范围和检出限实验配制10倍递增的系列梯度浓度0.01~1000μg/L的沙丁胺醇与克伦特罗标准溶液,按上述方法进行实验。每个浓度的标准样品测定5次,以其净响应信号强度平均值与对应的标准溶液浓度绘制标准对数曲线。实验表明,在0.01~1000μg/L范围内,二级离子信号强度的对数(Y)与加标浓度的对数(X)具有较好的线性关系。其中,沙丁胺醇线性回归方程为Y=0.2314X+1.9076,相关系数R2=0.9940;克伦特罗线性回归方程为Y=0.2223X+1.8940,相关系数R2=0.9938。
对浸泡在浓度为c的沙丁胺醇与克伦特罗标准品的猪肉样本进行测定,获得净相应的信号强度S(n=5),并测得3倍标准偏差3σ(S/N≥3,n=5)。根据LOD=c3σ/S[28,29\],当c值取标准曲线的最低点时,计算本方法对两种“瘦肉精”的检出限。测得本方法对沙丁胺醇和克伦特罗的检出限分别为6.2和9.8ng/kg。
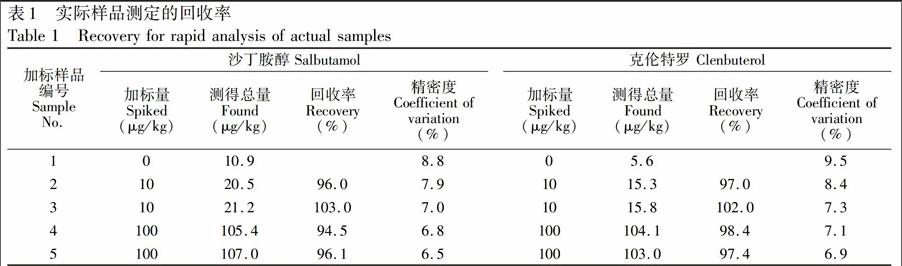
3.2.2回收率和精密度在5份155mg猪肉样品中,向1份样品中加入10μL蒸馏水,向2份样品中分别加入10μL浓度均为10μg/L的沙丁胺醇和克伦特罗标准溶液,向另2份样品中分别加入10μL浓度均为100μg/L的沙丁胺醇和克伦特罗标准溶液。设定标准品溶液密度为1kg/L,将浓度单位统一转换为μg/kg。按照本方法进行测定,每个水平重复测定10次。加标回收率为94.5%~103.0%,精密度在7.0%~9.5%之间,见表1。采用手动进样,单个样品测定时间少于30s,分析速度较快。实验结果中精密度较大的原因可能是由于手动进样时的不稳定性造成的[30,31\]。
3.3实际样品分析
采用本方法对猪肉样品进行测定,每个样品在0.5min内即获得了检测结果。为了获得猪肉样品中两种“瘦肉精”的定量信息,单个样品连续测定10次,分别得到二级离子的净响应信号强度,通过工作曲线,由线性回归方程求出“瘦肉精”含量,得到所检测5个批次样品中沙丁胺醇与克伦特罗的含量。并同时采用国标法(GB/T5009.1922003,动物性食品中克伦特罗残留量的测定)对样品进行检测,对比两种方法的检测结果并計算准确度。结果表明,5批猪肉样品中两种瘦肉精含量10次测定结果的准确度在87.4%~107.6%之间,结果如表2所示。
实验结果表明,本方法分析速度快、样品耗量少、灵敏度高,在大批量肉质食品中“瘦肉精”的快速检测方面具有较好的应用前景。
4结论
本研究建立了iEESIMS串联质谱直接检测猪肉中痕量沙丁胺醇与克伦特罗含量的快速质谱检测方法,快速准确地进行猪肉中“瘦肉精”的定性与定量分析。本方法单个样品检测时间小于30s,方法定量限分别为6.2和9.8ng/kg,加标回收率94.5%~103.0%。单个猪肉样品检测耗量只需毫克级,可以达到“瘦肉精”检测工作中节约样品耗量、直接快速分析及多种类样品检测等基本要求,为食品监管中“瘦肉精”检测提供一种快速高效的质谱分析新方法。
References
1(#SHENJianZhong,JIANGHaiYang.ChinaAnim.HealthInspection,2011,28(6):27-28
沈建忠,江海洋.HTK中国动物检疫,2011,28(6):27-28
2ZHANGQingAn,FANXueHui.FoodFerment.Ind.,2004,30(9):108-111
张清安,范学辉.HTK食品与发酵工业,2004,30(9):108-111
3BureauofAnimalHusbandryofMinistryofAgriculture.Chin.J.VeterinaryDrug,2003,37(7):10-11
农业部畜牧兽医局.HTK中国兽药杂志,2003,37(7):10-11
4GUOGuoFu,QIJinChao.MeatHygiene,2000,3:24
郭国富,齐金朝.HTK肉品卫生,2000,3:24
5MinistryofAgriculture.Chin.J.VeterinaryDrug,2003,37(4):15-20
农业部.HTK中国兽药杂志,2003,37(4):15-20
6LUHaiYan,ZHANGHua,ZHOUWei,CHENHuanWen.ModernFoodScienceandTechnology,2016,6:298-303
卢海艳,张华,周炜,陈焕文.HTK现代食品科技,2016,6:298-303
7HONGXiaoYang,DAIYongKang,ZHANGShengJian.GuangdongChem.Ind.,2013,40(5):150-151
冯晓阳,戴永康,张晟剑.HTK广东化工,2013,40(5):150-151
8CUIXi,XIONGQiRong,XIONGYongHua,SHANShan,LAIWeiHua.ChineseJ.Anal.Chem.,2013,41(12):1812-1816
崔希,熊齐荣,熊勇华,山珊,赖卫华.HTK分析化学,2013,41(12):1812-1816LM
9LiMX,YangH,LiSQ,ZhaoK,LiJG,JiangDN,LuluS,DengAP.J.Agric.FoodChem.,2014,62(45):10896-10902
10ZHENGHaiSong,LIYunFei,YANGXiaoJiao,YUXiaoFeng,CHENXueJiao,SUNJuanJuan,LIGang.FoodScienceandTechnology,2011,36(11):120-123
郑海松,李云飞,杨小娇,余晓峰,陈雪娇,孙娟娟,李刚.HTK食品科技,2011,36(11):120-123
11LIYing,QIPan,MAXiao,ZHONGJinGang,CHENJiangHan,ZHANGGuanWen.ModernFoodScience&Technology,2013,29(11):2747-2751
李莹,齐攀,马骁,钟金钢,陈江韩,张冠文.HTK现代食品科技,2013,29(11):2747-2751
12LIANGShiZheng,PANJiaRong,ZHANGChi,FENGTao,FULiLi.ChineseJ.Anal.Chem.,2016,44(4):640-646
梁世正,潘家荣,张弛,冯涛,傅丽丽.HTK分析化学,2016,44(4):640-646
13PinheiroI,JesuinoB,BarbosaJ,FerreiraH,RamosF,MatosJ,daSilveiraMI.J.Agric.FoodChem.,2009,57(3):910-914
14HeL,SuY,ZengZ,LiuY,HuangX.Anim.FeedSci.Technol.,2007,132(3):316-323
15GANSheng,SHIXiaoGuang.Mod.FoodSci.Technol.,2011,27(9):1146-1149
甘盛,施晓光.HTK现代食品科技,2011,27(9):1146-1149
16MIJieBo,LIShuJing,WANGFei,DONGXiangChao,XUHong,GEBaoKun,CHENQiYong.JournalofInstrumentalAnalysis,2014,33(12):1356-1361
宓捷波,李淑静,王飞,董襄朝,许泓,葛宝坤,陈其勇.HTK分析测试学报,2014,33(12):1356-1361
17DuvivierWF,BeekTAV,MeijerT,PeetersRJ,GrootMJ.J.Agric.FoodChem.,2015,63(2):493-499
18MoralesTrejoF,LeónVY,EscobarMedinaA,GutiérrezTolentinoR.J.FoodDrugAnal.,2013,21(4):414-420
19GigososPG,Ferna′NdezTF,Mari′ZOC,SampayoCAF,Abui′NCF.J.Chromatogr.Biomed.Appl.,1996,677(1):167-171
20LUHaiYan,ZHANGHua,ZHOUPeng,YANGMeiLing,ZHONGTao,YAOGuoChan,CHENHuanWen.Chem.J.ChineseUniversities,2015,36(10):1912-1918
盧海艳,张华,周鹏,杨美玲,钟涛,姚国灿,陈焕文.HTK高等学校化学学报,2015,36(10):1912-1918
21ZhangH,ZhuL,LuoLP,WangNN,KonstantinC,GuoXL,ChenHW.J.Agric.FoodChem.,2013,61(45):10691-10698
22ZhangH,LuH,ChinginK,ChenH.Anal.Chem.,2015,87(14):7433-7438
23ZhangH,LuHY,HuangHC,LiJC,FangXW,YuanBF,FengYQ,ChenHW.Anal.Chim.Acta,2016,926:72-78
24GB/T5009.1922003,DeterminationofClenbuterolResiduesinAnimalFoods.NationalStandardsofthePeople′sRepublicofChina.
HTK动物性食品中克伦特罗残留量的测定.中华人民共和国国家标准.GB/T5009.1922003
25GB/T222862008,DeterminationofβΑgonistsResiduesinFoodstuffofAnimalOriginLiquidChromatographywithTandemMassSpectrometricMethod.NationalStandardsofthePeople′sRepublicofChina
HTK动物源性食品中多种β受体激动剂残留量的测定.中华人民共和国国家标准.GB/T222862008
26LIUChang,CHENYan,LIXiaoWen,QINFeng,WANGKe.Chin.J.FoodHygiene,2014,26(5):464-469
刘畅,陈燕,李晓雯,秦峰,王柯.HTK中国食品卫生杂志,2014,26(5):464-469
27DomínguezRomeroaJC,GarcíaReyesaJF,MartínezRomerobR,MartínezLarabE,DelMoralLealbML,MolinaDíazaA.J.Chromatogr.B,2013,923:128-135
28DingJH,GuHW,YangSP,LiM,LiJQ,ChenHW.Anal.Chem.,2009,81:8632-8638
29ZhangH,ZhuL,LuoL,WangN,ChinginK,GuoX,ChenH.J.Agric.FoodChem.,2013,61(45):10691-10698
30ZHANGYan,PANSuSu,ZHUZhiQiang,ZHANGXingLei,XUGaoSi,WEIYiPing,CHENHuanWen,DINGJianHua.ChineseJ.Anal.Chem.,2013,41(8):1220-1225
張燕,潘素素,朱志强,张兴磊,徐高四,魏益平,陈焕文,丁健桦.HTK分析化学,2013,41(8):1220-1225
31ZHANGYan,SHENYan,HANChao,CHENHuanWen,ZHANGXingLei.Mod.Sci.Instrum.,2011,(5):86-90
张燕,沈燕,韩超,陈焕文,张兴磊.HTK现代科学仪器,2011,(5):86-90)
AbstractSalbutamolandClenbuterolareoftenusedasβagonistsandillegallyaddedinpigfeed,resultinginporkcontaminatedandevenleadingathletesexcessiveexcitability.Therefore,ithasgreatsignificanceforestablishinganewrapiddetectionmethodofsalbutamolandclenbuterolinpork.Inthisstudy,internalextractionelectrosprayionizationmassspectrometry(iEESIMS)technologywasusedfordirectlyqualitativeandquantitativeanalysisofsalbutamolandclenbuterolinporktissueswithoutsamplepretreatment.Theresultsshowedthatthismethodhadahighsensitivitytosalbutamolandclenbuterolanalysiswithdetectionlimitsof(LOD)6.2and9.8ng/kg,respectively,whiletheanalysistimefordetectingsinglesampleandsingleindexwaslessthan30s.Inaconcentrationrangeof0.01-1000μg/kg,thelogarithmofsignalintensity(Y)andthelogarithmofconcentration(X)haveagoodlinearrelationship.Thismethodhasmanyadvantagessuchasrapidanalysis,lowsampleconsumptionandhighsensitivity,whichisidealforrapiddetectionoftracesalbutamolandclenbuterol.
KeywordsInternalextractionelectrosprayionization;Salbutamol;Clenbuterol;βAgonists;Organizationalanalysis
HQWT6JY(Received14July2016;accepted14September2016)
ThisworkwassupportedbytheprogramforchangjiangScholarsandInnovationResearchTeaminUniversities(No.IRT13054),JiangxiProvinceScienceandTechnologyLandmarkProject(No.KJLD13051),ChinaAcademyofMetrologyScienceandTechnology(No.40AKYKF1601)



摘要采用内部萃取电喷雾电离质谱(iEESIMS)技术,在无需样品预处理的前提下,采用标准加入法直接对猪肉组织中沙丁胺醇与克伦特罗进行定性和定量分析。结果表明,本实验对猪肉组织中沙丁胺醇与克伦特罗具有较高的灵敏度,单个样品单一指标的检测时间少于30s。在0.01~1000μg/kg浓度范围内,信号强度对数(Y)与浓度对数(X)具有较好的线性关系,定量限分别为6.2和9.8ng/kg。本方法分析速度快、样本耗量少、灵敏度高,适用于猪肉中痕量沙丁胺醇与克伦特罗等“瘦肉精”的快速检测。
关键词内部萃取电喷雾电离;沙丁胺醇;克伦特罗;“瘦肉精”;组织分析
1引言
“瘦肉精”是指一类具有相似结构的β激动剂化合物,常见的主要有沙丁胺醇与克伦特罗,临床上一般用于治疗休克和哮喘等疾病[1\]。由于该类药物具有抑制动物脂肪的合成、促进瘦肉生长和重新分配家畜脂肪与瘦肉比例等作用,常被非法添加在家畜的饲料中来提高畜牧生产效率。根据农业部公告第235号,沙丁胺醇与克伦特罗为禁用物质,在食品(肉中)不得检出。常规情况下猪肉中“瘦肉精”检测为阳性的含量水平在0.1~100μg/kg之间。人食用含沙丁胺醇与克伦特罗等“瘦肉精”成分的肉类产品后,会导致血压升高、心率加快等反应,甚至影响水上及部分田径运动项目的成绩,长期服用也对心血管系统带来严重的危害,甚至导致生命危险[2\]。因此,建立一种肉质食品中“瘦肉精”的快速、准确的检测方法,对保障食品安全具有重要意义[3~6\]。
目前,动物组织中“瘦肉精”的检测方法主要包括胶体金免疫层析法[7,8\]、酶联免疫吸附法(ELSA)[9,10\]和表面等离子体共振生物芯片[11,12\]、气相色谱质谱法(GCMS)[13,14\]、高效液相色谱质谱法(HPLCMS)[15~17\]、高效液相色谱法[18,19\]等。胶体金免疫层析法,主要用于大量筛查,但检测结果因受环境或者人为因素的影响而存在一定误差,适合初步判定;酶联免疫吸附法,虽然灵敏度较高,但存在假阳性结果,重现性与特异性较差;HPLCMS法与GCMS法操作过程繁琐检测效率较低,难以满足大批量的样品检测要求。
内部萃取电喷雾电离质谱(iEESIMS)技術直接将萃取剂导入到组织样品内部,可实现组织样品内部小分子代谢产物等组分的直接质谱分析[20~23\]。本研究基于iEESIMS技术,开发能直接判断肉质食品内部沙丁胺醇与克伦特罗的内部萃取电喷雾电离线性离子阱质谱(iEESILTQMS)检测平台,建立对猪肉中沙丁胺醇与克伦特罗进行准确定性及快速定量的检测方法,并用于分析猪肉实际样品。
2实验部分
2.1仪器与试剂
内部萃取电喷雾电离源(iEESI)为本实验室自制;LTQXL线性离子阱质谱仪并配有Xcalibur数据处理系统(美国ThermoScientific公司);石英毛细管(内径0.10mm,外径0.19mm,美国Agilent公司);甲醇(色谱纯,美国ROE公司);实验用水为二次蒸馏水。
标准品:克伦特罗(批号00435479)、沙丁胺醇(批号103578453245)均来自LaboratorienBerlinAdlershofGmbH公司。标准储备液:称取适量沙丁胺醇与克伦特罗各标准品,加蒸馏水使溶解,各制成10mg/L的标准贮备液,
18℃避光保存。标准品溶液:将标准储备液分别配制成浓度为0.01,0.1,1,10,100和1000μg/L的标准溶液,按2.2节操作,供iEESIMS检测使用。
猪肉样品由江西省体育科学研究所提供,经国家标准方法检测不含沙丁胺醇与克伦特罗等β受体激动剂。
2.2实验方法
iEESIMS原理如图1所示。将石英毛细管插入组织样品内部,毛细管尖端与样品顶端相距2mm;样品顶端到质谱进样口的距离为4~5mm;实验选择甲醇水(1KG-3∶KG-51,V/V)作为萃取剂,将萃取溶剂由毛细管直接导入到猪肉样品内部,流速为1μL/min。
在微量进样针的钢针部位施加正高电压,在电场的作用下,猪肉样品尖端产生大量承载猪肉化学组分的微小带电液滴(电喷雾),微小带电液滴中的分析物去溶剂化后得到待测物离子,进行质谱检测。质谱仪设置为正离子检测模式,PS05351.eps,Y,PZ#TS((1HT5”SS
(iEESIMS))TS)质量扫描范围m/z50~400,离子源电压为5kV,离子传输管温度设置为150℃。在进行串联质谱分析时,母离子隔离宽度为1Da,碰撞能量为16%~25%,碰撞时间为50ms;离子透镜电压及其它检测参数由LTQTune系统自动优化。JP
2.3定性与定量分析
选择采用国家标准方法[24,25\]及iEESIMS方法均检测不到沙丁胺醇或克伦特罗信号的猪肉为空白样品;其次采用加标法处理样品,将空白猪肉样本切成体积一致的小长条(20mm×2mm×2mm,155mg)浸泡在沙丁胺醇与克伦特罗标准溶液中,浸泡10h后进行iEESIMS分析,获得沙丁胺醇与克伦特罗的特征碎片,完成定性分析;最后采用加标浓度法结合目标离子的二级特征碎片离子信号进行定量分析,建立在0.01~1000μg/kg范围内待测物离子特征碎片强度的对数(Y)与加标浓度的对数(X)之间的关系曲线,并采用此曲线完成定量分析。
3结果与讨论
3.1猪肉中沙丁胺醇与克伦特罗的定性分析
图2为在m/z50~400质量范围内猪肉样品的iEESIMS一级化学指纹谱图。在实验条件下,沙丁胺醇(MW239)与克伦特罗(MW277)都能够在iEESI过程中形成质子化准分子离子,分别在一级质谱中形成准分子离子峰m/z240及277。但是,猪肉中沙丁胺醇与克伦特罗的含量远小于其它猪肉中常见组分,如氨基酸、磷脂等,所以在一级质谱中(图2),二者的信号几乎淹没在其它大量组分物质的信号中。因此,仅依赖一级质谱难以对猪肉中是否含有微量沙丁胺醇与克伦特罗进行判断。
为避免假阳性结果,按照实验条件对离子m/z240\[Salbutamol+H\]+和m/z277\[Clenbuterol\]+进行CID实验,所获得的MS/MS谱图如图3所示。在CID条件下,母离子m/z240主要碎片离子为m/z222,166和148,碎片离子m/z222是由母离子丢失一个水分子得到的,这与文献\[26\]报道一致。经分析推断,碎片离子m/z166可能是由m/z222继续失去\[-C(CH3)3\](m/z57)得到,碎片离子m/z148是由m/z166失去一个水分子得到的。同样地,选择质子化的m/z277进行CID实验,主要碎片离子为m/z259和203,碎片离子m/z259由母离子丢失一个水分子后产生,该碎片离子不稳定,继续丢失\[-C(CH3)3\](m/z57)得到碎片离子m/z203,这与文献\[27\]报道一致。
3.2猪肉中沙丁胺醇与克伦特罗的定量分析
3.2.1线性范围和检出限实验配制10倍递增的系列梯度浓度0.01~1000μg/L的沙丁胺醇与克伦特罗标准溶液,按上述方法进行实验。每个浓度的标准样品测定5次,以其净响应信号强度平均值与对应的标准溶液浓度绘制标准对数曲线。实验表明,在0.01~1000μg/L范围内,二级离子信号强度的对数(Y)与加标浓度的对数(X)具有较好的线性关系。其中,沙丁胺醇线性回归方程为Y=0.2314X+1.9076,相关系数R2=0.9940;克伦特罗线性回归方程为Y=0.2223X+1.8940,相关系数R2=0.9938。
对浸泡在浓度为c的沙丁胺醇与克伦特罗标准品的猪肉样本进行测定,获得净相应的信号强度S(n=5),并测得3倍标准偏差3σ(S/N≥3,n=5)。根据LOD=c3σ/S[28,29\],当c值取标准曲线的最低点时,计算本方法对两种“瘦肉精”的检出限。测得本方法对沙丁胺醇和克伦特罗的检出限分别为6.2和9.8ng/kg。
3.2.2回收率和精密度在5份155mg猪肉样品中,向1份样品中加入10μL蒸馏水,向2份样品中分别加入10μL浓度均为10μg/L的沙丁胺醇和克伦特罗标准溶液,向另2份样品中分别加入10μL浓度均为100μg/L的沙丁胺醇和克伦特罗标准溶液。设定标准品溶液密度为1kg/L,将浓度单位统一转换为μg/kg。按照本方法进行测定,每个水平重复测定10次。加标回收率为94.5%~103.0%,精密度在7.0%~9.5%之间,见表1。采用手动进样,单个样品测定时间少于30s,分析速度较快。实验结果中精密度较大的原因可能是由于手动进样时的不稳定性造成的[30,31\]。
3.3实际样品分析
采用本方法对猪肉样品进行测定,每个样品在0.5min内即获得了检测结果。为了获得猪肉样品中两种“瘦肉精”的定量信息,单个样品连续测定10次,分别得到二级离子的净响应信号强度,通过工作曲线,由线性回归方程求出“瘦肉精”含量,得到所检测5个批次样品中沙丁胺醇与克伦特罗的含量。并同时采用国标法(GB/T5009.1922003,动物性食品中克伦特罗残留量的测定)对样品进行检测,对比两种方法的检测结果并計算准确度。结果表明,5批猪肉样品中两种瘦肉精含量10次测定结果的准确度在87.4%~107.6%之间,结果如表2所示。
实验结果表明,本方法分析速度快、样品耗量少、灵敏度高,在大批量肉质食品中“瘦肉精”的快速检测方面具有较好的应用前景。
4结论
本研究建立了iEESIMS串联质谱直接检测猪肉中痕量沙丁胺醇与克伦特罗含量的快速质谱检测方法,快速准确地进行猪肉中“瘦肉精”的定性与定量分析。本方法单个样品检测时间小于30s,方法定量限分别为6.2和9.8ng/kg,加标回收率94.5%~103.0%。单个猪肉样品检测耗量只需毫克级,可以达到“瘦肉精”检测工作中节约样品耗量、直接快速分析及多种类样品检测等基本要求,为食品监管中“瘦肉精”检测提供一种快速高效的质谱分析新方法。
References
1(#SHENJianZhong,JIANGHaiYang.ChinaAnim.HealthInspection,2011,28(6):27-28
沈建忠,江海洋.HTK中国动物检疫,2011,28(6):27-28
2ZHANGQingAn,FANXueHui.FoodFerment.Ind.,2004,30(9):108-111
张清安,范学辉.HTK食品与发酵工业,2004,30(9):108-111
3BureauofAnimalHusbandryofMinistryofAgriculture.Chin.J.VeterinaryDrug,2003,37(7):10-11
农业部畜牧兽医局.HTK中国兽药杂志,2003,37(7):10-11
4GUOGuoFu,QIJinChao.MeatHygiene,2000,3:24
郭国富,齐金朝.HTK肉品卫生,2000,3:24
5MinistryofAgriculture.Chin.J.VeterinaryDrug,2003,37(4):15-20
农业部.HTK中国兽药杂志,2003,37(4):15-20
6LUHaiYan,ZHANGHua,ZHOUWei,CHENHuanWen.ModernFoodScienceandTechnology,2016,6:298-303
卢海艳,张华,周炜,陈焕文.HTK现代食品科技,2016,6:298-303
7HONGXiaoYang,DAIYongKang,ZHANGShengJian.GuangdongChem.Ind.,2013,40(5):150-151
冯晓阳,戴永康,张晟剑.HTK广东化工,2013,40(5):150-151
8CUIXi,XIONGQiRong,XIONGYongHua,SHANShan,LAIWeiHua.ChineseJ.Anal.Chem.,2013,41(12):1812-1816
崔希,熊齐荣,熊勇华,山珊,赖卫华.HTK分析化学,2013,41(12):1812-1816LM
9LiMX,YangH,LiSQ,ZhaoK,LiJG,JiangDN,LuluS,DengAP.J.Agric.FoodChem.,2014,62(45):10896-10902
10ZHENGHaiSong,LIYunFei,YANGXiaoJiao,YUXiaoFeng,CHENXueJiao,SUNJuanJuan,LIGang.FoodScienceandTechnology,2011,36(11):120-123
郑海松,李云飞,杨小娇,余晓峰,陈雪娇,孙娟娟,李刚.HTK食品科技,2011,36(11):120-123
11LIYing,QIPan,MAXiao,ZHONGJinGang,CHENJiangHan,ZHANGGuanWen.ModernFoodScience&Technology,2013,29(11):2747-2751
李莹,齐攀,马骁,钟金钢,陈江韩,张冠文.HTK现代食品科技,2013,29(11):2747-2751
12LIANGShiZheng,PANJiaRong,ZHANGChi,FENGTao,FULiLi.ChineseJ.Anal.Chem.,2016,44(4):640-646
梁世正,潘家荣,张弛,冯涛,傅丽丽.HTK分析化学,2016,44(4):640-646
13PinheiroI,JesuinoB,BarbosaJ,FerreiraH,RamosF,MatosJ,daSilveiraMI.J.Agric.FoodChem.,2009,57(3):910-914
14HeL,SuY,ZengZ,LiuY,HuangX.Anim.FeedSci.Technol.,2007,132(3):316-323
15GANSheng,SHIXiaoGuang.Mod.FoodSci.Technol.,2011,27(9):1146-1149
甘盛,施晓光.HTK现代食品科技,2011,27(9):1146-1149
16MIJieBo,LIShuJing,WANGFei,DONGXiangChao,XUHong,GEBaoKun,CHENQiYong.JournalofInstrumentalAnalysis,2014,33(12):1356-1361
宓捷波,李淑静,王飞,董襄朝,许泓,葛宝坤,陈其勇.HTK分析测试学报,2014,33(12):1356-1361
17DuvivierWF,BeekTAV,MeijerT,PeetersRJ,GrootMJ.J.Agric.FoodChem.,2015,63(2):493-499
18MoralesTrejoF,LeónVY,EscobarMedinaA,GutiérrezTolentinoR.J.FoodDrugAnal.,2013,21(4):414-420
19GigososPG,Ferna′NdezTF,Mari′ZOC,SampayoCAF,Abui′NCF.J.Chromatogr.Biomed.Appl.,1996,677(1):167-171
20LUHaiYan,ZHANGHua,ZHOUPeng,YANGMeiLing,ZHONGTao,YAOGuoChan,CHENHuanWen.Chem.J.ChineseUniversities,2015,36(10):1912-1918
盧海艳,张华,周鹏,杨美玲,钟涛,姚国灿,陈焕文.HTK高等学校化学学报,2015,36(10):1912-1918
21ZhangH,ZhuL,LuoLP,WangNN,KonstantinC,GuoXL,ChenHW.J.Agric.FoodChem.,2013,61(45):10691-10698
22ZhangH,LuH,ChinginK,ChenH.Anal.Chem.,2015,87(14):7433-7438
23ZhangH,LuHY,HuangHC,LiJC,FangXW,YuanBF,FengYQ,ChenHW.Anal.Chim.Acta,2016,926:72-78
24GB/T5009.1922003,DeterminationofClenbuterolResiduesinAnimalFoods.NationalStandardsofthePeople′sRepublicofChina.
HTK动物性食品中克伦特罗残留量的测定.中华人民共和国国家标准.GB/T5009.1922003
25GB/T222862008,DeterminationofβΑgonistsResiduesinFoodstuffofAnimalOriginLiquidChromatographywithTandemMassSpectrometricMethod.NationalStandardsofthePeople′sRepublicofChina
HTK动物源性食品中多种β受体激动剂残留量的测定.中华人民共和国国家标准.GB/T222862008
26LIUChang,CHENYan,LIXiaoWen,QINFeng,WANGKe.Chin.J.FoodHygiene,2014,26(5):464-469
刘畅,陈燕,李晓雯,秦峰,王柯.HTK中国食品卫生杂志,2014,26(5):464-469
27DomínguezRomeroaJC,GarcíaReyesaJF,MartínezRomerobR,MartínezLarabE,DelMoralLealbML,MolinaDíazaA.J.Chromatogr.B,2013,923:128-135
28DingJH,GuHW,YangSP,LiM,LiJQ,ChenHW.Anal.Chem.,2009,81:8632-8638
29ZhangH,ZhuL,LuoL,WangN,ChinginK,GuoX,ChenH.J.Agric.FoodChem.,2013,61(45):10691-10698
30ZHANGYan,PANSuSu,ZHUZhiQiang,ZHANGXingLei,XUGaoSi,WEIYiPing,CHENHuanWen,DINGJianHua.ChineseJ.Anal.Chem.,2013,41(8):1220-1225
張燕,潘素素,朱志强,张兴磊,徐高四,魏益平,陈焕文,丁健桦.HTK分析化学,2013,41(8):1220-1225
31ZHANGYan,SHENYan,HANChao,CHENHuanWen,ZHANGXingLei.Mod.Sci.Instrum.,2011,(5):86-90
张燕,沈燕,韩超,陈焕文,张兴磊.HTK现代科学仪器,2011,(5):86-90)
AbstractSalbutamolandClenbuterolareoftenusedasβagonistsandillegallyaddedinpigfeed,resultinginporkcontaminatedandevenleadingathletesexcessiveexcitability.Therefore,ithasgreatsignificanceforestablishinganewrapiddetectionmethodofsalbutamolandclenbuterolinpork.Inthisstudy,internalextractionelectrosprayionizationmassspectrometry(iEESIMS)technologywasusedfordirectlyqualitativeandquantitativeanalysisofsalbutamolandclenbuterolinporktissueswithoutsamplepretreatment.Theresultsshowedthatthismethodhadahighsensitivitytosalbutamolandclenbuterolanalysiswithdetectionlimitsof(LOD)6.2and9.8ng/kg,respectively,whiletheanalysistimefordetectingsinglesampleandsingleindexwaslessthan30s.Inaconcentrationrangeof0.01-1000μg/kg,thelogarithmofsignalintensity(Y)andthelogarithmofconcentration(X)haveagoodlinearrelationship.Thismethodhasmanyadvantagessuchasrapidanalysis,lowsampleconsumptionandhighsensitivity,whichisidealforrapiddetectionoftracesalbutamolandclenbuterol.
KeywordsInternalextractionelectrosprayionization;Salbutamol;Clenbuterol;βAgonists;Organizationalanalysis
HQWT6JY(Received14July2016;accepted14September2016)
ThisworkwassupportedbytheprogramforchangjiangScholarsandInnovationResearchTeaminUniversities(No.IRT13054),JiangxiProvinceScienceandTechnologyLandmarkProject(No.KJLD13051),ChinaAcademyofMetrologyScienceandTechnology(No.40AKYKF1601)

