例谈高中化学化工流程题解题思路
耿曼莉
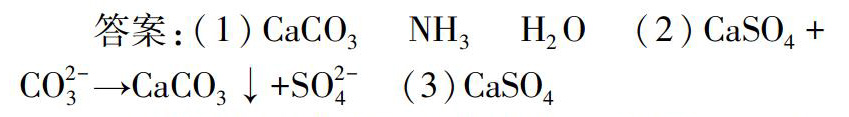
随着新课改的不断深入,高考化学中化工题已逐渐成为一种热门题型.这类题将高中化学与某些化工生产很好地融合在一起,题目新颖,综合性强,思维量大,非常具有挑战性.有专家预测,在新課改背景下,无机化工题可能会逐渐取代以往高考化学试题中的无机框图型推断题.下面我们通过一个例题来分析解答化工流程题的一般思路和主要策略,希望能为大家提供借鉴.
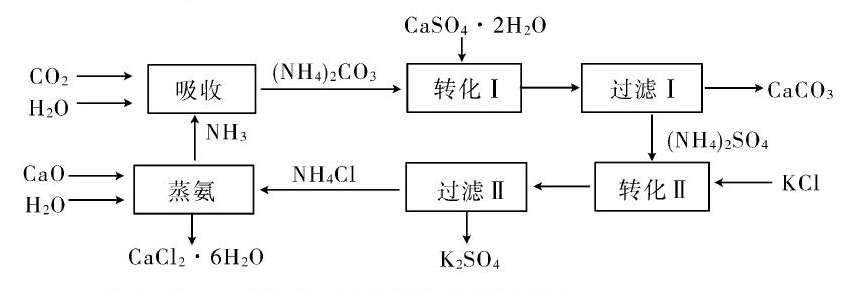
例 将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.
(1)本工艺中所用的原料除CaSO4·2H2O,KCl外,还需要等.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:.
(3)过滤I操作所得固体中,除CaCO3外还含有(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO2-3的方法是: .
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下:
温度(℃)02060
K2SO4溶解的量(g)7.411.118.2
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体g.
(6)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是.
A.熔点较低(29℃熔化)
B.能导电
C.能制冷
D.无毒
(7)上述工艺流程中体现绿色化学理念的是:.
解析:此题是一道以工业生产为背景的实验题,考查了实验基本操作、离子检验、溶解度计算等知识.
从生产流程图可以看出,所需原料除CaSO4·2H2O,KCl外,还需要氨气、石灰石和水.
硫酸钙是微溶的,碳酸钙是难溶的,因此石膏悬浊液中加入碳酸铵溶液后生成了碳酸钙和硫酸铵,生成的碳酸钙中混有石膏.
碳酸根的检验可用酸化的方法,若产生气泡,说明滤液中含有碳酸根.
硫酸钾饱和溶液在结晶过程中溶剂的量不变,查表可知不同温度下的溶解度,先求出591g饱和液中含有的水是500g,在0℃可溶解硫酸钾37g,所以析出晶体54g.
作为储热材料,需要能在室温左右的温度下工作,且对人体无害,故选A,D.
绿色化学要求整个生产过程中不排放污染物,原子利用率高,因此生产流程中碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用.
答案:(1)CaCO3 NH3 H2O
(2)CaSO4+CO2-3→CaCO3↓+SO2-4
(3)CaSO4
(4)滤液中滴加盐酸产生气泡
(5)54g
(6)A D
(7)碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中).
小结:工业生产流程的设计和实验方案设计原理非常相似,只是在工业生产中对经济性、环保性等许多细节方面有着更高的要求.因此,在解题时学生应在实验室原理的基础上结合实际因素,充分读懂工业流程的每一个步骤的意义.
总之,解好这一类题,要克服畏惧心理,此外,还要认真审题,仔细分析,明确考点内容,分析流程中的每一步骤,从题中获取信息,运用化学原理分析制备产品的最佳条件以辅助帮助解题,这样学生才能在高考化学中稳操胜券.

