参芪抑瘤方药物血清对胃癌MKN—45细胞周期阻滞及抗侵袭转移的影响
马春林 吴红彦 李海龙 等
摘要:目的 探讨不同浓度参芪抑瘤方药物血清对胃癌MKN-45细胞周期阻滞及抗侵袭转移作用的相关机制。方法 60只SPF级Wistar大鼠,随机分为对照组和参芪抑瘤方低、中、高剂量组,每组15只。参芪抑瘤方低、中、高剂量组分别给予0.25、0.50、1.00 g原药材/mL药液灌胃,空白组给予等量饮用水灌胃,每日2次,连续7 d,末次灌胃2 h后取血,分离血清。MKN-45细胞经不同浓度药物血清处理后,流式细胞术检测细胞周期,免疫组化检测COX-2、PTEN蛋白表达。结果 药物血清干预后细胞G0~G1期比例增加,S期比例减少;药物血清可降低MKN-45细胞COX-2蛋白阳性表达率,升高PTEN蛋白阳性表达率(P<0.05)。结论 参芪抑瘤方药物血清阻滞细胞周期及抗侵袭转移作用可能与影响COX-2、PTEN蛋白表达有关。
关键词:参芪抑瘤方;胃癌;MKN-45细胞;细胞周期;COX-2蛋白;PTEN蛋白;大鼠
DOI:10.3969/j.issn.1005-5304.2016.04.017
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)04-0064-04
Effects of Shenqi Yiliu Decoction Medicated Serum on Blocking Cell Cycle and Inhibiting Invasion and Metastasis of Gastric Cancer Cell Lines MKN-45 MA Chun-lin1, WU Hong-yan1,2,3, LI Hai-long1,2, CHEN Jie1, ZHANG Xuan1 (1. Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China; 2. Key Laboratory of Traditional Chinese Medicine Excavation Innovation and Transformation of Gansu Province, Lanzhou 730000, China; 3. Laboratory for TCM New Products Development Engineering of Gansu Province, Lanzhou 730000, China)
Abstract: Objective To investigate the relevant mechanism of different concentrations of Shenqi Yiliu Decoction medicated serum on blocking cell cycle and inhibiting invasion and metastasis of gastric cancer cell lines MKN-45. Methods Sixty SPF Wistar rats were randomized into Shenqi Yiliu Decoction low-, medium-, and high-dose groups and control group, with 15 rats in each group. Low-, medium- and high-dose groups were fed with different concentrations of TCM liquid from which containing crude medicine (0.25, 0.50, 1.00 g/mL) separately for gavage. Rats in the blank group were given the same amount of drinking water for gavage, twice a day, for 7 days. 2 h after the last gavage, rat blood was taken and serum was separated. After MKN-45 cells were dealt with different concentrations of medicinal serum, FCM was used to detect cell cycle and immunohistochemistry technology was used to detect the expressions of COX-2 and PTEM proteins. Results FCM analysis showed that medicated serum could increase G0-G1 phase and shorten S phase of cells; medicated serum could reduce the positive expression rate of COX-2 of the MKN-45 cells and increase positive expression rate of PTEN proteins (P<0.05). Conclusion Shenqi Yiliu Decoction medicated serum can block the cell cycle and inhibit invasion and metastasis of MKN-45 cell lines, which may be related to the intervention in the expression levels of COX-2 and PTEN proteins.
Key words: Shenqi Yiliu Decoction; gastric cancer; MKN-45 cell; cell cycle; COX-2; PTEN; rats
优势,并越来越受到关注。当归贝母苦参丸出自《金匮要略》,原用于治疗妊娠小便困难。现代研究显示,其对肝癌、胃癌细胞等有明显的抑制作用[1-3]。参芪抑瘤方为临床经验方,用于多种肿瘤疾病的治疗,由当归贝母苦参丸加黄芪、全蝎、山慈菇等组成,契合了肿瘤正气不足,痰(湿)浊、癌毒、瘀血内阻的发病机制[4]。方中药材所含有效成分黄芪多糖、当归多糖、贝母碱、苦参碱等对多种癌细胞有明显的抑制作用[5-8]。本实验在前期研究基础上,进一步探索其抗肿瘤的相关作用机制,为抗肿瘤中药研发提供一定的实验依据。
1 实验材料
1.1 动物
60只SPF级Wistar大鼠,雌雄各半,6~8周龄,体质量(200±20)g,甘肃中医药大学科研中心动物实验室,合格证号SYXK(甘)2001-0001。室温20~25 ℃、湿度45%~55%分笼饲养,喂标准饲料(甘肃中医药大学科研中心动物实验室提供),自由饮水。
1.2 药物和细胞
参芪抑瘤方由苦参、黄芪、山慈菇、全蝎、当归、浙贝母等组成,所有饮片购自甘肃中医药大学附属医院中药房,经甘肃中医药大学中药鉴定教研室杨扶德教授鉴定符合《中华人民共和国药典》规定。胃癌MKN-45细胞,中国医学科学院肿瘤医院肿瘤研究所提供。
1.3 主要试剂与仪器
DMEM高糖培养基(Gibco公司),四季青胎牛血清(杭州四季青公司),胰蛋白酶(Gibco公司),二抗(中杉金桥生物技术有限公司),RNAisoTMPlus(D9810A),the PrimeScript RT reagent、kit(DRRO37A),SYBR Premix Ex TaqTM(DRR081A,TakarBio),国产分析纯试剂(北京化学试剂公司)。细胞培养箱(上海申力,HF212),高速冷冻离心机(德国Eppendorf公司,5804R),倒置显微镜(日本OLYMPUS公司,CKX41+DP21),流式细胞仪(美国COULTER EPICS XL)。
2 实验方法
2.1 分组、给药及药物血清制备
将60只SPF级Wistar大鼠随机分为对照组和参芪抑瘤方低、中、高剂量组,每组15只。参芪抑瘤方低、中、高剂量组予0.25、0.50、1.00 g原药材/mL药液灌胃,对照组予等量饮用水灌胃。给药体积均为1.5 mL/100 g,每日2次,连续7 d。末次灌胃2 h后取血,3000 r/min低温离心15 min,分离血清,0.22 μm微孔滤膜过滤,56 ℃、30 min灭活,-80 ℃保存。
2.2 细胞培养
MKN-45细胞经常规传代培养,采用含10%灭火胎牛血清及青链霉素(100 U/mL)的DMEM培养基,于37 ℃、5%CO2饱和湿度恒温培养箱中贴壁生长,每2~3 d换液1次。倒置显微镜下观察细胞情况,当生长状态良好且铺满瓶底时,采用25%胰酶消化、传代,并取处于对数生长期细胞进行实验。
2.3 流式细胞术检测MKN-45细胞周期
取对数生长期的MKN-45细胞接种于6孔板中,增殖为80%时,加入20%药物血清处理48 h,检测前用胰酶消化,1500 r/min离心5 min,弃上清液,PBS洗2次,70%乙醇固定,4 ℃固定过夜。用PBS配制成单细胞悬液,50 μg/mL碘化丙啶染色液室温染色30 min后,流式细胞仪分析细胞周期。
2.4 免疫组化检测MKN-45细胞COX-2、PTEN蛋白表达
将无菌10 mm×10 mm的24片盖玻片置入24孔培养板中,取对数生长期的MKN-45细胞消化后,制成单细胞悬液,以500 μL/孔接种于24孔培养板中。待细胞贴壁后,对照组加50 μL完全培养基,余孔依次加空白血清和高、中、低剂量药物血清各50 μL,每组设3个复孔。细胞爬满盖玻片后,取爬片浸入4%多聚甲醛中过夜。用PBS洗3次,5 min/次,加50 μL 0.1%Triton X-100室温下孵育15 min后,再用PBS洗5 min×3次,加3%H2O2室温下孵育30 min,继续用PBS洗5 min×3次,滴加50 μL 5%BSA封闭液。室温封闭20 min后,甩去多余液体,滴加50 μL稀释过的Rabbit Anti-collagen TypeⅡ(1∶100),置湿盒中4 ℃孵育过夜。并以PBS代替一抗,作为阴性对照,PBS洗3次,2 min/次,加生物素化山羊抗兔IgG,37 ℃孵育20 min,再用PBS洗2 min×3次。然后加SABC,37 ℃继续孵育20 min,PBS洗5 min×4次。DAB显色,自来水冲洗1 min。苏木素复染5 min,0.5%盐酸乙醇分化10 s,氨水返蓝10 s。梯度乙醇脱水干燥,每一梯度5 min,二甲苯透明10 s,甘油封片。倒置相差显微镜观察爬片,每组选6张爬片,每张爬片选择3个高倍视野照相,用Leica Qwin病理图像分析系统对所拍照片进行分析,测定相对灰度值。
3 统计学方法
采用SPSS16.0统计软件进行分析。计量资料以—x±s表示,根据方差齐性检验结果,多组间比较采用方差分析。检验水准α=0.05。
4 结果
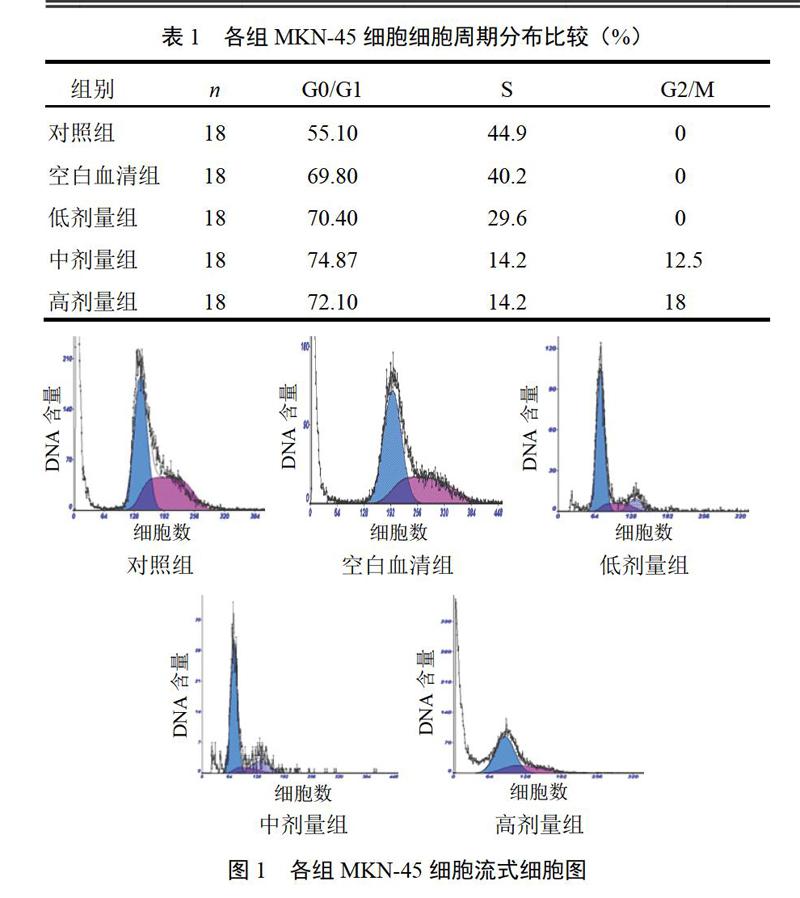
4.1 参芪抑瘤方药物血清对MKN-45细胞周期的影响
10%浓度药物血清处理后MKN-45细胞较对照组细胞G0/G1期比例升高,S期低于对照组,见表1、图1。表明药物血清可有效抑制细胞进入增殖周期,降低细胞S期,阻滞细胞于G0~G1期。
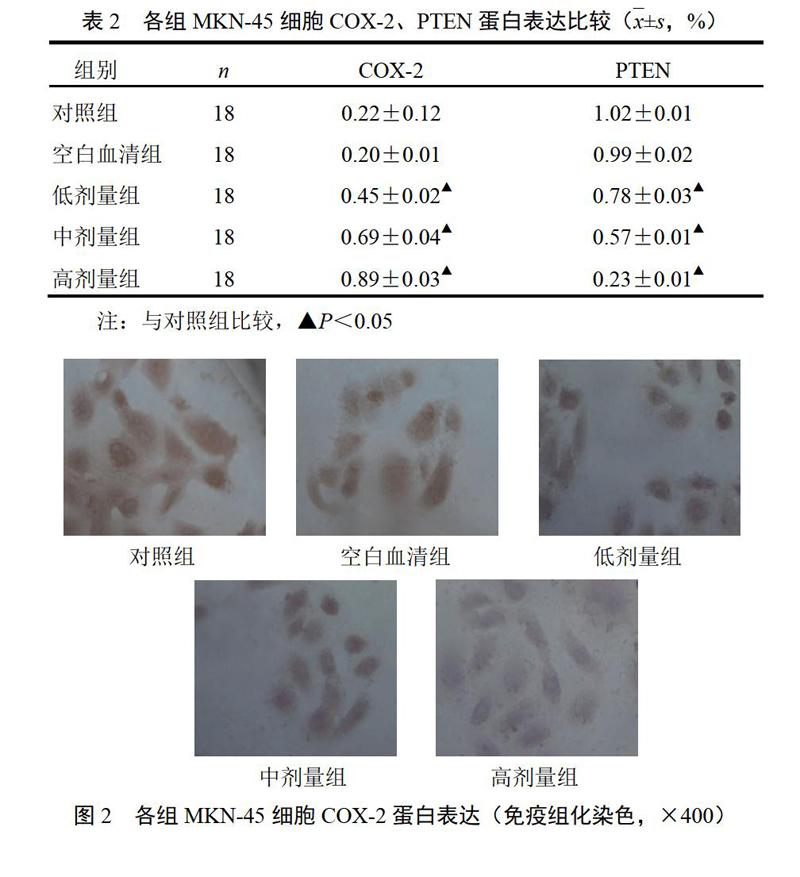
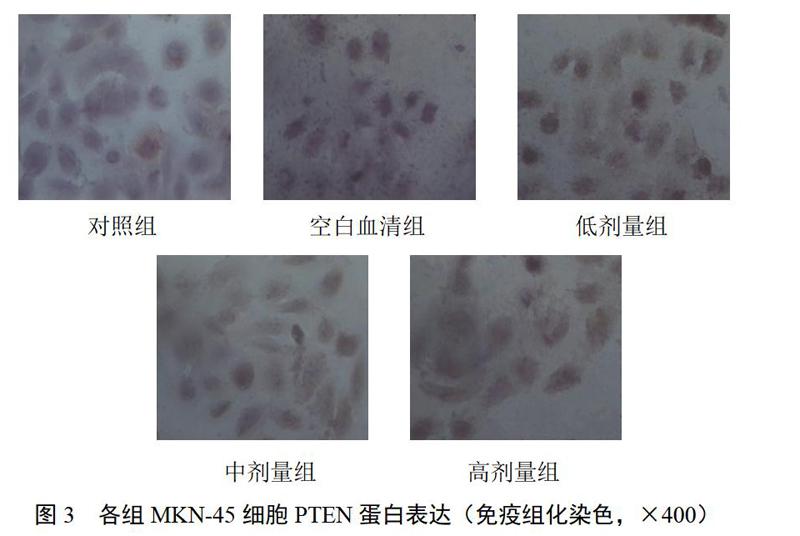
4.2 参芪抑瘤方药物血清对MKN-45细胞COX-2、PTEN蛋白表达的影响
对照组细胞COX-2以强阳性和阳性表达为主,而药物血清干预组细胞着色逐渐变浅,COX-2呈弱阳性或阴性表达;对照组细胞着色较浅,PTEN呈弱阳性或阴性表达,药物血清干预组细胞着色逐渐变深,PTEN表达逐渐增强,呈强阳性或阳性表达,差异有统计学意义(P<0.05)。结果见表2、图2和图3。
5 讨论
胃癌的发生、发展是一个多因素、多步骤、多基因参与的复杂病理过程。正常情况下,胃黏膜上皮细胞的增殖和凋亡之间保持动态平衡。这种平衡的维持有赖于癌基因、抑癌基因及一些细胞因子等共同调控。多种因素会影响上述调控体系,共同参与胃癌的发生。
中医认为,胃癌是牵涉整体的全身性疾病的局部表现,多由先天禀赋不足、邪毒侵袭、痰凝血瘀等因素,引起机体阴阳失衡,脏腑经络功能失调,进而导致局部癌变。其主要病机为本虚标实,本虚为素体虚弱或先天禀赋因素,标实不外乎气滞、血瘀、痰凝、毒聚。中医药治疗在个体化、多层次、多靶点控制肿瘤生长、抗转移、减少复发等方面具有独到的优势,是胃癌的重要辅助治疗方法。胃癌早期采用中西医结合治疗,可有效逆转病情的恶化。利用中医药的整体调节作用,胃癌术后放化疗过程中,使患者对放化疗药物的耐受性增强,免疫功能得到提高,抑瘤效果得以强化,痛苦明显缓解,生存期延长,生活质量提高。
COX-2是前列腺素合成关键限速酶环氧合酶的一种亚型,近年来研究发现,COX-2高表达与肿瘤发生发展密切相关,在肿瘤细胞增殖、凋亡过程中起重要作用,其表达可延长癌细胞的生存期,促进肿瘤细胞侵袭转移。在正常胃黏膜COX-2几乎不表达,而在胃癌变时则过表达,对胃癌细胞的异常增殖、细胞凋亡、抑制血管形成及转移复发有重要生物学作用。COX-2过表达可上调黏附因子、基质金属蛋白酶等促进肿瘤细胞发生浸润与转移;上调肿瘤细胞周围血管生成因子,促进肿瘤血管生成。研究表明,其在正常胃黏膜、浅表性胃炎、萎缩性胃炎伴肠化、不典型增生及胃癌组织中的表达呈逐渐递增趋势[9]。
作为抑癌基因的PTEN低表达会激活PPI3K-Ark 信号通路,从而缩短细胞的分裂周期,促进细胞增殖,与肿瘤细胞浸润、转移密切相关[10]。PTEN的表达过低、受到抑制或缺失都会诱导肿瘤细胞的无限增殖,从而促进肿瘤的发生[11-13]。PTEN蛋白的表达与淋巴结转移、侵袭程度密切相关。胃癌组织中PTEN蛋白的检测可了解与判断肿瘤增生、侵袭及转移的能力和程度。
综上,参芪抑瘤方药物血清能明显阻滞胃癌细胞于G0/G1期,减少S期细胞数量,有效抑制细胞进入增殖周期,诱导胃癌细胞周期阻滞。参芪抑瘤方药物血清可能通过抑制COX-2的表达从而抑制血管内皮生长因子的活性,降低细胞间E-钙黏蛋白活性,减弱肿瘤细胞的侵袭能力,也可能通过升高PTEN的表达量,使其去磷酸化作用增强,进而抑制细胞周期,诱导细胞凋亡和分化,抑制肿瘤细胞转移等,从而发挥抗胃癌细胞侵袭转移的作用。
参考文献:
[1] 舍雅莉,闫德祺,刘永琦,等.当归贝母苦参丸对顺铂化疗H22荷瘤小鼠肿瘤及肝脏、肾脏和胸腺组织病理形态的影响[J].中国中医药信息杂志,2014,21(5):56-60.
[2] 闫德祺,刘永琦,李应东,等.当归贝母苦参丸对顺铂化疗H22荷瘤小鼠的抑瘤作用及对血清HIF-1α和LDH的影响[J].中成药,2014,36(7):1351-1355.
[3] 石金凤,李海龙,吴红彦,等.当归贝母苦参丸含药血清对胃癌细胞SGC-7901和侵袭转移能力和周期的影响[J].辽宁中医药大学学报, 2014,16(10):30-33.
[4] 梁云麒,沈克平,胡兵.中医胃癌病机与治法研究[J].中华中医药学刊, 2014,32(3):513-515.
[5] GUO L, BAI S P, ZHAO L, et al. Astragalus polysaccharide injection integrated with vinorelbine and cisplatin for patients with advanced non-small cell lung cancer:effects on quality of life and survival[J]. Med Oncol,2012,29(3):1656.
[6] 吴素珍,李加林,陈水亲,等.硫酸酯化当归多糖抗肿瘤实验研究[J].时珍国医国药,2012,23(2):319-320.
[7] 刘琦,程旭锋,张新峰,等.山慈菇-蜂房药对抑制人乳腺癌MDA-MB-231细胞体外侵袭转移的机理研究[J].中药新药与临床药理,2014,25(4):389-392.
[8] 王晶娟,张贵君,吴明侠,等.全蝎蛋白药效组分对HepG2细胞的体外抑制作用[J].药物分析杂志,2011,31(1):71-74.
[9] TATSUGUCHI A, MATSUI K, SHINJI Y, et al. Cyclooxygenase-2 expression correlates with angiogenesis and apoptosis in gastric cancer tissue[J]. Hum Pathol,2004,35:488.
[10] WANG S I, PARSONS R, ITTMANN M, et al. Homozygous deletion of PTEN tumor suppressor gene in a subset of prostate adenocarcinoma[J]. Clin Cancer Res,1998,4(6):811-815.
[11] TIBAREWAL P, ZILIDIS G, SPINELLI L, et al. PTEN protein phosphatase activity correlates with control of gene expression and invasion, a tumor-suppressing phenotype, but not with AKT activity[J]. Sci Signal,2012,213:18.
[12] ZHENG H, TAKAHASHI H, MURAI Y, et al. Low expression of FHIT and PTEN correlates with malignancy of gastric carcinomas:tissue-array findings[J]. Appl Immunohistochem Mol Morphol,2007, 15(4):432-440.
[13] ZHANG B G, LI J F, YU B Q, et al. MicroRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN[J]. Oncol Rep,2012,27(4):1019-1026.



摘要:目的 探讨不同浓度参芪抑瘤方药物血清对胃癌MKN-45细胞周期阻滞及抗侵袭转移作用的相关机制。方法 60只SPF级Wistar大鼠,随机分为对照组和参芪抑瘤方低、中、高剂量组,每组15只。参芪抑瘤方低、中、高剂量组分别给予0.25、0.50、1.00 g原药材/mL药液灌胃,空白组给予等量饮用水灌胃,每日2次,连续7 d,末次灌胃2 h后取血,分离血清。MKN-45细胞经不同浓度药物血清处理后,流式细胞术检测细胞周期,免疫组化检测COX-2、PTEN蛋白表达。结果 药物血清干预后细胞G0~G1期比例增加,S期比例减少;药物血清可降低MKN-45细胞COX-2蛋白阳性表达率,升高PTEN蛋白阳性表达率(P<0.05)。结论 参芪抑瘤方药物血清阻滞细胞周期及抗侵袭转移作用可能与影响COX-2、PTEN蛋白表达有关。
关键词:参芪抑瘤方;胃癌;MKN-45细胞;细胞周期;COX-2蛋白;PTEN蛋白;大鼠
DOI:10.3969/j.issn.1005-5304.2016.04.017
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)04-0064-04
Effects of Shenqi Yiliu Decoction Medicated Serum on Blocking Cell Cycle and Inhibiting Invasion and Metastasis of Gastric Cancer Cell Lines MKN-45 MA Chun-lin1, WU Hong-yan1,2,3, LI Hai-long1,2, CHEN Jie1, ZHANG Xuan1 (1. Gansu University of Traditional Chinese Medicine, Lanzhou 730000, China; 2. Key Laboratory of Traditional Chinese Medicine Excavation Innovation and Transformation of Gansu Province, Lanzhou 730000, China; 3. Laboratory for TCM New Products Development Engineering of Gansu Province, Lanzhou 730000, China)
Abstract: Objective To investigate the relevant mechanism of different concentrations of Shenqi Yiliu Decoction medicated serum on blocking cell cycle and inhibiting invasion and metastasis of gastric cancer cell lines MKN-45. Methods Sixty SPF Wistar rats were randomized into Shenqi Yiliu Decoction low-, medium-, and high-dose groups and control group, with 15 rats in each group. Low-, medium- and high-dose groups were fed with different concentrations of TCM liquid from which containing crude medicine (0.25, 0.50, 1.00 g/mL) separately for gavage. Rats in the blank group were given the same amount of drinking water for gavage, twice a day, for 7 days. 2 h after the last gavage, rat blood was taken and serum was separated. After MKN-45 cells were dealt with different concentrations of medicinal serum, FCM was used to detect cell cycle and immunohistochemistry technology was used to detect the expressions of COX-2 and PTEM proteins. Results FCM analysis showed that medicated serum could increase G0-G1 phase and shorten S phase of cells; medicated serum could reduce the positive expression rate of COX-2 of the MKN-45 cells and increase positive expression rate of PTEN proteins (P<0.05). Conclusion Shenqi Yiliu Decoction medicated serum can block the cell cycle and inhibit invasion and metastasis of MKN-45 cell lines, which may be related to the intervention in the expression levels of COX-2 and PTEN proteins.
Key words: Shenqi Yiliu Decoction; gastric cancer; MKN-45 cell; cell cycle; COX-2; PTEN; rats
优势,并越来越受到关注。当归贝母苦参丸出自《金匮要略》,原用于治疗妊娠小便困难。现代研究显示,其对肝癌、胃癌细胞等有明显的抑制作用[1-3]。参芪抑瘤方为临床经验方,用于多种肿瘤疾病的治疗,由当归贝母苦参丸加黄芪、全蝎、山慈菇等组成,契合了肿瘤正气不足,痰(湿)浊、癌毒、瘀血内阻的发病机制[4]。方中药材所含有效成分黄芪多糖、当归多糖、贝母碱、苦参碱等对多种癌细胞有明显的抑制作用[5-8]。本实验在前期研究基础上,进一步探索其抗肿瘤的相关作用机制,为抗肿瘤中药研发提供一定的实验依据。
1 实验材料
1.1 动物
60只SPF级Wistar大鼠,雌雄各半,6~8周龄,体质量(200±20)g,甘肃中医药大学科研中心动物实验室,合格证号SYXK(甘)2001-0001。室温20~25 ℃、湿度45%~55%分笼饲养,喂标准饲料(甘肃中医药大学科研中心动物实验室提供),自由饮水。
1.2 药物和细胞
参芪抑瘤方由苦参、黄芪、山慈菇、全蝎、当归、浙贝母等组成,所有饮片购自甘肃中医药大学附属医院中药房,经甘肃中医药大学中药鉴定教研室杨扶德教授鉴定符合《中华人民共和国药典》规定。胃癌MKN-45细胞,中国医学科学院肿瘤医院肿瘤研究所提供。
1.3 主要试剂与仪器
DMEM高糖培养基(Gibco公司),四季青胎牛血清(杭州四季青公司),胰蛋白酶(Gibco公司),二抗(中杉金桥生物技术有限公司),RNAisoTMPlus(D9810A),the PrimeScript RT reagent、kit(DRRO37A),SYBR Premix Ex TaqTM(DRR081A,TakarBio),国产分析纯试剂(北京化学试剂公司)。细胞培养箱(上海申力,HF212),高速冷冻离心机(德国Eppendorf公司,5804R),倒置显微镜(日本OLYMPUS公司,CKX41+DP21),流式细胞仪(美国COULTER EPICS XL)。
2 实验方法
2.1 分组、给药及药物血清制备
将60只SPF级Wistar大鼠随机分为对照组和参芪抑瘤方低、中、高剂量组,每组15只。参芪抑瘤方低、中、高剂量组予0.25、0.50、1.00 g原药材/mL药液灌胃,对照组予等量饮用水灌胃。给药体积均为1.5 mL/100 g,每日2次,连续7 d。末次灌胃2 h后取血,3000 r/min低温离心15 min,分离血清,0.22 μm微孔滤膜过滤,56 ℃、30 min灭活,-80 ℃保存。
2.2 细胞培养
MKN-45细胞经常规传代培养,采用含10%灭火胎牛血清及青链霉素(100 U/mL)的DMEM培养基,于37 ℃、5%CO2饱和湿度恒温培养箱中贴壁生长,每2~3 d换液1次。倒置显微镜下观察细胞情况,当生长状态良好且铺满瓶底时,采用25%胰酶消化、传代,并取处于对数生长期细胞进行实验。
2.3 流式细胞术检测MKN-45细胞周期
取对数生长期的MKN-45细胞接种于6孔板中,增殖为80%时,加入20%药物血清处理48 h,检测前用胰酶消化,1500 r/min离心5 min,弃上清液,PBS洗2次,70%乙醇固定,4 ℃固定过夜。用PBS配制成单细胞悬液,50 μg/mL碘化丙啶染色液室温染色30 min后,流式细胞仪分析细胞周期。
2.4 免疫组化检测MKN-45细胞COX-2、PTEN蛋白表达
将无菌10 mm×10 mm的24片盖玻片置入24孔培养板中,取对数生长期的MKN-45细胞消化后,制成单细胞悬液,以500 μL/孔接种于24孔培养板中。待细胞贴壁后,对照组加50 μL完全培养基,余孔依次加空白血清和高、中、低剂量药物血清各50 μL,每组设3个复孔。细胞爬满盖玻片后,取爬片浸入4%多聚甲醛中过夜。用PBS洗3次,5 min/次,加50 μL 0.1%Triton X-100室温下孵育15 min后,再用PBS洗5 min×3次,加3%H2O2室温下孵育30 min,继续用PBS洗5 min×3次,滴加50 μL 5%BSA封闭液。室温封闭20 min后,甩去多余液体,滴加50 μL稀释过的Rabbit Anti-collagen TypeⅡ(1∶100),置湿盒中4 ℃孵育过夜。并以PBS代替一抗,作为阴性对照,PBS洗3次,2 min/次,加生物素化山羊抗兔IgG,37 ℃孵育20 min,再用PBS洗2 min×3次。然后加SABC,37 ℃继续孵育20 min,PBS洗5 min×4次。DAB显色,自来水冲洗1 min。苏木素复染5 min,0.5%盐酸乙醇分化10 s,氨水返蓝10 s。梯度乙醇脱水干燥,每一梯度5 min,二甲苯透明10 s,甘油封片。倒置相差显微镜观察爬片,每组选6张爬片,每张爬片选择3个高倍视野照相,用Leica Qwin病理图像分析系统对所拍照片进行分析,测定相对灰度值。
3 统计学方法
采用SPSS16.0统计软件进行分析。计量资料以—x±s表示,根据方差齐性检验结果,多组间比较采用方差分析。检验水准α=0.05。
4 结果
4.1 参芪抑瘤方药物血清对MKN-45细胞周期的影响
10%浓度药物血清处理后MKN-45细胞较对照组细胞G0/G1期比例升高,S期低于对照组,见表1、图1。表明药物血清可有效抑制细胞进入增殖周期,降低细胞S期,阻滞细胞于G0~G1期。
4.2 参芪抑瘤方药物血清对MKN-45细胞COX-2、PTEN蛋白表达的影响
对照组细胞COX-2以强阳性和阳性表达为主,而药物血清干预组细胞着色逐渐变浅,COX-2呈弱阳性或阴性表达;对照组细胞着色较浅,PTEN呈弱阳性或阴性表达,药物血清干预组细胞着色逐渐变深,PTEN表达逐渐增强,呈强阳性或阳性表达,差异有统计学意义(P<0.05)。结果见表2、图2和图3。
5 讨论
胃癌的发生、发展是一个多因素、多步骤、多基因参与的复杂病理过程。正常情况下,胃黏膜上皮细胞的增殖和凋亡之间保持动态平衡。这种平衡的维持有赖于癌基因、抑癌基因及一些细胞因子等共同调控。多种因素会影响上述调控体系,共同参与胃癌的发生。
中医认为,胃癌是牵涉整体的全身性疾病的局部表现,多由先天禀赋不足、邪毒侵袭、痰凝血瘀等因素,引起机体阴阳失衡,脏腑经络功能失调,进而导致局部癌变。其主要病机为本虚标实,本虚为素体虚弱或先天禀赋因素,标实不外乎气滞、血瘀、痰凝、毒聚。中医药治疗在个体化、多层次、多靶点控制肿瘤生长、抗转移、减少复发等方面具有独到的优势,是胃癌的重要辅助治疗方法。胃癌早期采用中西医结合治疗,可有效逆转病情的恶化。利用中医药的整体调节作用,胃癌术后放化疗过程中,使患者对放化疗药物的耐受性增强,免疫功能得到提高,抑瘤效果得以强化,痛苦明显缓解,生存期延长,生活质量提高。
COX-2是前列腺素合成关键限速酶环氧合酶的一种亚型,近年来研究发现,COX-2高表达与肿瘤发生发展密切相关,在肿瘤细胞增殖、凋亡过程中起重要作用,其表达可延长癌细胞的生存期,促进肿瘤细胞侵袭转移。在正常胃黏膜COX-2几乎不表达,而在胃癌变时则过表达,对胃癌细胞的异常增殖、细胞凋亡、抑制血管形成及转移复发有重要生物学作用。COX-2过表达可上调黏附因子、基质金属蛋白酶等促进肿瘤细胞发生浸润与转移;上调肿瘤细胞周围血管生成因子,促进肿瘤血管生成。研究表明,其在正常胃黏膜、浅表性胃炎、萎缩性胃炎伴肠化、不典型增生及胃癌组织中的表达呈逐渐递增趋势[9]。
作为抑癌基因的PTEN低表达会激活PPI3K-Ark 信号通路,从而缩短细胞的分裂周期,促进细胞增殖,与肿瘤细胞浸润、转移密切相关[10]。PTEN的表达过低、受到抑制或缺失都会诱导肿瘤细胞的无限增殖,从而促进肿瘤的发生[11-13]。PTEN蛋白的表达与淋巴结转移、侵袭程度密切相关。胃癌组织中PTEN蛋白的检测可了解与判断肿瘤增生、侵袭及转移的能力和程度。
综上,参芪抑瘤方药物血清能明显阻滞胃癌细胞于G0/G1期,减少S期细胞数量,有效抑制细胞进入增殖周期,诱导胃癌细胞周期阻滞。参芪抑瘤方药物血清可能通过抑制COX-2的表达从而抑制血管内皮生长因子的活性,降低细胞间E-钙黏蛋白活性,减弱肿瘤细胞的侵袭能力,也可能通过升高PTEN的表达量,使其去磷酸化作用增强,进而抑制细胞周期,诱导细胞凋亡和分化,抑制肿瘤细胞转移等,从而发挥抗胃癌细胞侵袭转移的作用。
参考文献:
[1] 舍雅莉,闫德祺,刘永琦,等.当归贝母苦参丸对顺铂化疗H22荷瘤小鼠肿瘤及肝脏、肾脏和胸腺组织病理形态的影响[J].中国中医药信息杂志,2014,21(5):56-60.
[2] 闫德祺,刘永琦,李应东,等.当归贝母苦参丸对顺铂化疗H22荷瘤小鼠的抑瘤作用及对血清HIF-1α和LDH的影响[J].中成药,2014,36(7):1351-1355.
[3] 石金凤,李海龙,吴红彦,等.当归贝母苦参丸含药血清对胃癌细胞SGC-7901和侵袭转移能力和周期的影响[J].辽宁中医药大学学报, 2014,16(10):30-33.
[4] 梁云麒,沈克平,胡兵.中医胃癌病机与治法研究[J].中华中医药学刊, 2014,32(3):513-515.
[5] GUO L, BAI S P, ZHAO L, et al. Astragalus polysaccharide injection integrated with vinorelbine and cisplatin for patients with advanced non-small cell lung cancer:effects on quality of life and survival[J]. Med Oncol,2012,29(3):1656.
[6] 吴素珍,李加林,陈水亲,等.硫酸酯化当归多糖抗肿瘤实验研究[J].时珍国医国药,2012,23(2):319-320.
[7] 刘琦,程旭锋,张新峰,等.山慈菇-蜂房药对抑制人乳腺癌MDA-MB-231细胞体外侵袭转移的机理研究[J].中药新药与临床药理,2014,25(4):389-392.
[8] 王晶娟,张贵君,吴明侠,等.全蝎蛋白药效组分对HepG2细胞的体外抑制作用[J].药物分析杂志,2011,31(1):71-74.
[9] TATSUGUCHI A, MATSUI K, SHINJI Y, et al. Cyclooxygenase-2 expression correlates with angiogenesis and apoptosis in gastric cancer tissue[J]. Hum Pathol,2004,35:488.
[10] WANG S I, PARSONS R, ITTMANN M, et al. Homozygous deletion of PTEN tumor suppressor gene in a subset of prostate adenocarcinoma[J]. Clin Cancer Res,1998,4(6):811-815.
[11] TIBAREWAL P, ZILIDIS G, SPINELLI L, et al. PTEN protein phosphatase activity correlates with control of gene expression and invasion, a tumor-suppressing phenotype, but not with AKT activity[J]. Sci Signal,2012,213:18.
[12] ZHENG H, TAKAHASHI H, MURAI Y, et al. Low expression of FHIT and PTEN correlates with malignancy of gastric carcinomas:tissue-array findings[J]. Appl Immunohistochem Mol Morphol,2007, 15(4):432-440.
[13] ZHANG B G, LI J F, YU B Q, et al. MicroRNA-21 promotes tumor proliferation and invasion in gastric cancer by targeting PTEN[J]. Oncol Rep,2012,27(4):1019-1026.

