星点设计—效应面法优化亚麻木酚素缓释片处方
刘效栓 李季文 吴晓琴 舒劲 焦正花 钱梦茹 毕映燕


摘要:目的 采用星点设计-效应面法优化亚麻木酚素缓释片处方。方法 以羟丙基甲基纤维素(HPMC)、乙基纤维素(EC)和淀粉的用量为考察因素,分别以亚麻木酚素在2、6、12 h的累积释放度为评价指标,采用星点设计-效应面优化法进行处方优选试验,并进行优化处方的验证分析。结果 最终确定缓释片的最佳处方为HPMC用量为43%,EC用量为26%,淀粉用量为17%,优化处方的考察指标预测值与观察值非常接近。结论 通过星点设计-效应面优化法建立的模型预测性良好,可用于亚麻木酚素缓释片处方的优化。
关键词:亚麻木酚素;缓释片;星点设计-效应面法
DOI:10.3969/j.issn.1005-5304.2016.04.023
中图分类号:R283.5 文献标识码:A 文章编号:1005-5304(2016)04-0087-04
Optimization of Prescription of Flaxseed Lignans Sustained-release Tablets by Central Composite Design-response Surface Methodology LIU Xiao-shuan, LI Ji-wen, WU Xiao-qin, SHU Jin, JIAO Zheng-hua, QIAN Meng-ru, BI Ying-yan (TCM Hospital of Gansu Province, Lanzhou 730050, China)
Abstract: Objective To optimize the prescription of flaxseed lignans sustained release tables by central composite design-response surface methodology. Methods With HPMC, EC and starch dosage as factors, and flaxseed lignans in 2, 6 and 12 h of cumulative release as evaluation indexes, central composite design-response surface optimization method was used to conduct prescription optimization experiments, and optimized prescription analysis was carried out. Results The optimal prescription of flaxseed lignans sustained release tables was as following: HPMC dosage was 43%; EC was 26%; starch content was 17%. Optimized index forecast values were very close to the observed values. In vitro release test of three selected optimal formulations indicated that there existed high approximation between the observed and estimated values. Conclusion It shows that the established model is suitable for flaxseed lignans sustained release tables, which can be used in the optimization of the prescription of flaxseed lignans sustained release tables.
Key words: flaxseed lignans; sustained-release tablets; central composite design-response surface methodology
亚麻木酚素是与人体雌激素十分相似的植物雌激素,具有抗氧化、延缓衰老[1]、抗肿瘤[2]、预防骨质疏松[3]、降低血清胆固醇[4]等功效,尤其在减轻妇女绝经期症状、预防乳腺癌、前列腺癌等方面有良好疗效[5],在预防糖尿病方面发挥着重要的作用[6]。本研究以丙基甲基纤维素(HPMC)、乙基纤维素(EC)为混合骨架材料,采用星点设计-效应面法优化缓释片的处方,研制亚麻木酚素缓释片,旨在提高患者的依从性和药物的生物利用度。
1 仪器与试药
高效液相色谱仪(waters1525泵,waters717进样器,waters2487双通道紫外检测器);KQ-250超声波清洗器,昆山市超声仪器有限公司;RZQ-8D自动溶
基金项目:甘肃省科技支撑计划(1104FKCA121)
出取样收集系统,天津市天大天发科技有限公司;TDP型单冲压片机,上海天祥制药机械公司;CJY-300D型片剂脆碎度测定仪,上海黄海药检仪器有限公司;智能片剂硬度仪YD-35,天津市天大天发科技有限公司。
亚麻木酚素(含量61%),甘肃省中医院制剂室自制;HPMC K14M、K15M、K100M,山东聊城阿华制药有限公司;EC,天津市科密欧试剂有限公司;淀粉,山东聊城阿华制药有限公司;微粉硅胶,山东聊城阿华制药有限公司;其他试剂均为分析纯;水为蒸馏水。
2 方法与结果
2.1 亚麻木酚素含量测定
2.1.1 色谱条件 Waters Symmetry ShieLd-C18(5 μm,4.6 mm×250 mm)色谱柱,流动相为甲醇-水(35∶65),流速为1.0 mL/min,紫外检测器,检测波长为282 nm,柱温为室温,进样量为10 μL。在该色谱条件下测定亚麻木酚素含量,样品中被测成分能够达到基线分离,相邻色谱峰的分离度>1.5。理论塔板数均高于3000。
2.1.2 对照品溶液的制备 取亚麻木酚素对照品适量,精密称定,加甲醇制成每1 mL含0.225 mg的溶液,即得。
2.1.3 供试品溶液的制备 取亚麻木酚素缓释片10片,研细,过4号筛,精密称定0.2 g,置100 mL量瓶中,加入适量甲醇,超声处理15 min,放凉,稀释至刻度,过滤,取续滤液1 mL,置10 mL量瓶中,稀释至刻度,振荡,摇匀,用0.45 μm微孔滤膜过滤,取续滤液,备用。
2.1.4 标准曲线的绘制 精密吸取亚麻木酚素对照品储备液适量,分别用甲醇稀释后得每1 mL含亚麻木酚素0.018、0.045、0.090、0.135、0.180、0.225 mg的对照品溶液,进样10 μL,每个浓度进样3次,以峰面积为纵坐标,对照品浓度为横坐标,绘制标准曲线,回归方程Y=5×106X+21 041,r=0.999 5。结果亚麻木酚素在0.018~0.225 mg/mL范围内与其色谱峰面积呈良好的线性关系。
2.1.5 精密度试验 精密吸取一定浓度的亚麻木酚素对照品溶液10 ?L,分别于日内不同时间连续进样6次,连续6 d内进样6次,记录峰面积,分别计算亚麻木酚素的日内、日间精密度,结果RSD分别为0.94%、1.41%,表明亚麻木酚素的日内、日间精密度良好。
2.1.6 重复性试验 取同一批亚麻木酚素缓释片粉末6份,按“2.1.3”项下方法制备供试品溶液,各取10 ?L进样测定,结果RSD=1.63%,表明本方法重复性较好。
2.1.7 稳定性试验 精密吸取同一供试品溶液10 ?L,分别在0、4、8、12、18、24 h注入色谱仪中,测定亚麻木酚素峰面积,结果RSD=1.99%,表明供试品溶液在24 h内稳定。
2.1.8 专属性试验 精密吸取对照品溶液、供试品溶液及阴性对照溶液各10 ?L,按“2.1.1”项下色谱条件进行测定,样品中辅料成分对测定无干扰,色谱图见图1。
2.2 优选缓释片最佳处方
2.2.1 缓释片的制备 亚麻木酚素缓释片的制备原辅料均过100目筛。精密称取处方量的亚麻木酚素(100 mg/片)及HPMC、EC、淀粉,混合均匀,加
入70%乙醇液为黏合剂制软材;20目筛挤压制湿颗粒,鼓风恒温干燥箱中50 ℃干燥2 h,按质量分数1%的量加入微粉硅胶,混匀,压片(6~8 kg),即得,每片400 mg。
2.2.2 释放度考察 按2010年版《中华人民共和国药典》附录释放度测定法第1法[7]有关规定,转速为100 r/min,温度为(37±0.5)℃,释放介质为新鲜蒸馏水900 mL。随机取试验样品6片,分别置于各溶出杯中,立即计时,于2、6、12 h取溶液5 mL,同时补充5 mL同温度的释放介质,溶液水浴蒸干,甲醇定容至10 mL,经0.45 μm微孔滤膜过滤,即为供试品。供试品于280 nm处测定含量,计算亚麻木酚素的累积释放度。
2.2.3 试验设计与结果 预试验表明,HPMC量、EC量和淀粉量是影响片剂释放的主要因素。根据初步考察结果,采用HPMC用量(A)、EC用量(B)及淀粉用量(C)作为考察因素,其范围为:A 20%~50%,B 10%~30%,C 5%~20%。根据星点设计的原理,各因素设置5个水平,可用代码值±a、±1、0来表示。对于三因素的星点设计a=1.732,因素及水平表见表1,具体方案安排见表2。
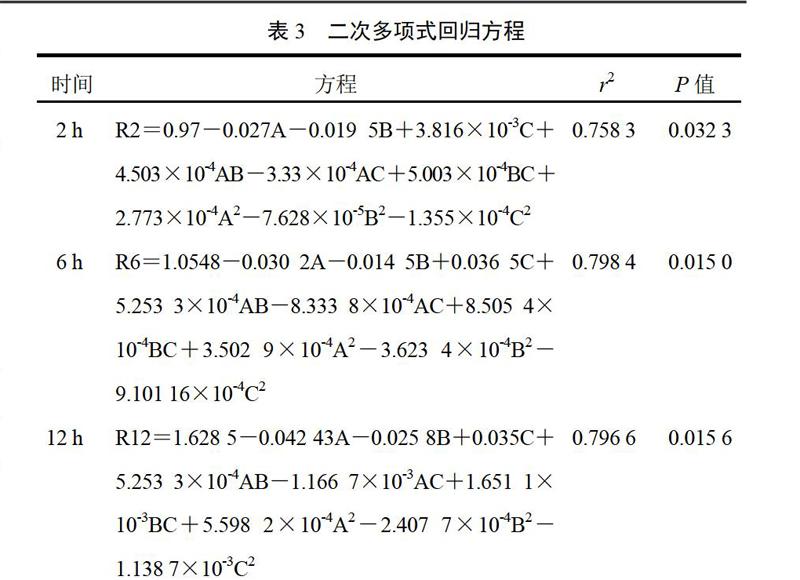
2.2.4 回归方程 用Oringin7.0统计软件,以缓释片在2、6、12 h的累积释放度为评价指标,分别对各处方进行多元线性回归和二次多项式方程拟合[8-9]。根据最优拟合方程,用Oringin7.0软件分别绘制评价指标与各因素的三维效应面与二维等高线图。将各释放时间点二维等高线最佳释放区域重叠,能得到决定所研制缓释片释放度因素的优化区域,即为最佳处方区域。分别在亚麻木酚素缓释片的最佳处方区域内选定一个处方,按“2.2.1”项下方法制备缓释片,按“2.2.2”项下方法测定各时间点的释放度。以所测的2、6、12 h的释放度对根据二次多项式模型分析计算出的预测值进行相关性分析。二次多项式回归方程见表3。拟合结果发现,就置信度(P)和拟合优度(r)而言,二次多项式模型明显优于多元线性模型。
表3 二次多项式回归方程
时间 方程 r2 P值
2 h R2=0.97-0.027A-0.019 5B+3.816×10-3C+4.503×10-4AB-3.33×10-4AC+5.003×10-4BC+2.773×10-4A2-7.628×10-5B2-1.355×10-4C2 0.758 3 0.032 3
6 h R6=1.0548-0.030 2A-0.014 5B+0.036 5C+5.253 3×10-4AB-8.333 8×10-4AC+8.505 4×10-4BC+3.502 9×10-4A2-3.623 4×10-4B2-9.101 16×10-4C2 0.798 4 0.015 0
12 h R12=1.628 5-0.042 43A-0.025 8B+0.035C+5.253 3×10-4AB-1.166 7×10-3AC+1.651 1×10-3BC+5.598 2×10-4A2-2.407 7×10-4B2-1.138 7×10-3C2 0.796 6 0.015 6
2.2.5 效应面优化、预测与验证 根据上述所确立的二次多项式模型,分别绘制缓释片2、6、12 h累积释放度的效应面和等高线图,见图2~图4。
本研究预期目标为研制12 h给药一次的亚麻木酚素缓释片,并且尽可能减少突释和保证释药完全。将缓释片各时间段的最佳释放区域确定为:2 h为10%~30%,6 h为50%~70%,12 h为80%~100%。在此基础上,结合释放度图形,由二次多项式模型得到的优化区域,最终确定缓释片的最佳处方为:HPMC用量为43%,EC用量为26%,淀粉的用量为17%。
在预测最优处方的基础上,进行3批样品放大试验,分别测定2、6、12 h的释放度,计算累积释放率,测定结果见表4。可知,由二次多项式模型对2、6、12 h累积释放度分别做出的预测值和实验值都非常接近,表明所建立的模型稳定。
3 讨论
在缓释辅料选取中,首先通过预试验以0~24 h缓释片的累积释放度为评价指标,通过单因素考察了不同黏度HPMC(K4M、K15M、K100M)对缓释片释放度的影响,从结果来看,HPMC K100M释放效果最好。以HPMC为主要骨架材料,加入疏水性辅料EC可调节药物的溶出,二者组成的混合型缓释骨架系统对亚麻木酚素表现出良好的缓慢释放效果,未见亲水凝胶骨架片常出现的药物释放开始时段较严重的突释现象。
在试验优选出的最佳处方范围内,选取的3个处方的评价指标(2、6、12 h累积释放度)预测值与实验值偏差较小,且符合预期的试验目标,说明所建立的模型具有较好的预测性,可用于亚麻木酚素缓释片处方的优化。
参考文献:
[1] 房娜.亚麻木酚素抗氧化产品开发[D].济南:山东师范大学,2013.
[2] McCANN SE, MUTI P, VITO D, et al. Dietary lignan intakes and risk of pre- and post menopausal breast cancer[J]. Int J Cancer, 2004,111:440-443.
[3] 那晓琳,赵新宇,李丽娜,等.亚麻木酚素对去卵巢大鼠血脂水平的影响[J].营养学报,2012,34(2):159-163.
[4] 张进丽,亚麻木酚素(SDG)治疗中老年女性骨质疏松症的临床研究[J].中国现代医学杂志,2013,23(31):65-66.
[5] 张文斌,许时婴.亚麻木酚素的微波辅助提取工艺研究[J].天然产物研究与开发,2006,18(2):286-290.
[6] 沈晓东,李多伟,赵蓉,等.亚麻木酚素的研究进展[J].中成药,2009, 31(4):598-600.
[7] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:附录87.
[8] 王明森,王洪光.盐酸普萘洛尔缓释片的研究[J].西北药学杂志, 2009,24(6):469-471.
[9] 周云飞,王柏.星点设计-效应面法优化盐酸氨溴索缓释片处方[J].中国药科大学学报,2007,38(1):39-42.
(收稿日期:2015-06-23)
(修回日期:2015-07-09;编辑:陈静)



摘要:目的 采用星点设计-效应面法优化亚麻木酚素缓释片处方。方法 以羟丙基甲基纤维素(HPMC)、乙基纤维素(EC)和淀粉的用量为考察因素,分别以亚麻木酚素在2、6、12 h的累积释放度为评价指标,采用星点设计-效应面优化法进行处方优选试验,并进行优化处方的验证分析。结果 最终确定缓释片的最佳处方为HPMC用量为43%,EC用量为26%,淀粉用量为17%,优化处方的考察指标预测值与观察值非常接近。结论 通过星点设计-效应面优化法建立的模型预测性良好,可用于亚麻木酚素缓释片处方的优化。
关键词:亚麻木酚素;缓释片;星点设计-效应面法
DOI:10.3969/j.issn.1005-5304.2016.04.023
中图分类号:R283.5 文献标识码:A 文章编号:1005-5304(2016)04-0087-04
Optimization of Prescription of Flaxseed Lignans Sustained-release Tablets by Central Composite Design-response Surface Methodology LIU Xiao-shuan, LI Ji-wen, WU Xiao-qin, SHU Jin, JIAO Zheng-hua, QIAN Meng-ru, BI Ying-yan (TCM Hospital of Gansu Province, Lanzhou 730050, China)
Abstract: Objective To optimize the prescription of flaxseed lignans sustained release tables by central composite design-response surface methodology. Methods With HPMC, EC and starch dosage as factors, and flaxseed lignans in 2, 6 and 12 h of cumulative release as evaluation indexes, central composite design-response surface optimization method was used to conduct prescription optimization experiments, and optimized prescription analysis was carried out. Results The optimal prescription of flaxseed lignans sustained release tables was as following: HPMC dosage was 43%; EC was 26%; starch content was 17%. Optimized index forecast values were very close to the observed values. In vitro release test of three selected optimal formulations indicated that there existed high approximation between the observed and estimated values. Conclusion It shows that the established model is suitable for flaxseed lignans sustained release tables, which can be used in the optimization of the prescription of flaxseed lignans sustained release tables.
Key words: flaxseed lignans; sustained-release tablets; central composite design-response surface methodology
亚麻木酚素是与人体雌激素十分相似的植物雌激素,具有抗氧化、延缓衰老[1]、抗肿瘤[2]、预防骨质疏松[3]、降低血清胆固醇[4]等功效,尤其在减轻妇女绝经期症状、预防乳腺癌、前列腺癌等方面有良好疗效[5],在预防糖尿病方面发挥着重要的作用[6]。本研究以丙基甲基纤维素(HPMC)、乙基纤维素(EC)为混合骨架材料,采用星点设计-效应面法优化缓释片的处方,研制亚麻木酚素缓释片,旨在提高患者的依从性和药物的生物利用度。
1 仪器与试药
高效液相色谱仪(waters1525泵,waters717进样器,waters2487双通道紫外检测器);KQ-250超声波清洗器,昆山市超声仪器有限公司;RZQ-8D自动溶
基金项目:甘肃省科技支撑计划(1104FKCA121)
出取样收集系统,天津市天大天发科技有限公司;TDP型单冲压片机,上海天祥制药机械公司;CJY-300D型片剂脆碎度测定仪,上海黄海药检仪器有限公司;智能片剂硬度仪YD-35,天津市天大天发科技有限公司。
亚麻木酚素(含量61%),甘肃省中医院制剂室自制;HPMC K14M、K15M、K100M,山东聊城阿华制药有限公司;EC,天津市科密欧试剂有限公司;淀粉,山东聊城阿华制药有限公司;微粉硅胶,山东聊城阿华制药有限公司;其他试剂均为分析纯;水为蒸馏水。
2 方法与结果
2.1 亚麻木酚素含量测定
2.1.1 色谱条件 Waters Symmetry ShieLd-C18(5 μm,4.6 mm×250 mm)色谱柱,流动相为甲醇-水(35∶65),流速为1.0 mL/min,紫外检测器,检测波长为282 nm,柱温为室温,进样量为10 μL。在该色谱条件下测定亚麻木酚素含量,样品中被测成分能够达到基线分离,相邻色谱峰的分离度>1.5。理论塔板数均高于3000。
2.1.2 对照品溶液的制备 取亚麻木酚素对照品适量,精密称定,加甲醇制成每1 mL含0.225 mg的溶液,即得。
2.1.3 供试品溶液的制备 取亚麻木酚素缓释片10片,研细,过4号筛,精密称定0.2 g,置100 mL量瓶中,加入适量甲醇,超声处理15 min,放凉,稀释至刻度,过滤,取续滤液1 mL,置10 mL量瓶中,稀释至刻度,振荡,摇匀,用0.45 μm微孔滤膜过滤,取续滤液,备用。
2.1.4 标准曲线的绘制 精密吸取亚麻木酚素对照品储备液适量,分别用甲醇稀释后得每1 mL含亚麻木酚素0.018、0.045、0.090、0.135、0.180、0.225 mg的对照品溶液,进样10 μL,每个浓度进样3次,以峰面积为纵坐标,对照品浓度为横坐标,绘制标准曲线,回归方程Y=5×106X+21 041,r=0.999 5。结果亚麻木酚素在0.018~0.225 mg/mL范围内与其色谱峰面积呈良好的线性关系。
2.1.5 精密度试验 精密吸取一定浓度的亚麻木酚素对照品溶液10 ?L,分别于日内不同时间连续进样6次,连续6 d内进样6次,记录峰面积,分别计算亚麻木酚素的日内、日间精密度,结果RSD分别为0.94%、1.41%,表明亚麻木酚素的日内、日间精密度良好。
2.1.6 重复性试验 取同一批亚麻木酚素缓释片粉末6份,按“2.1.3”项下方法制备供试品溶液,各取10 ?L进样测定,结果RSD=1.63%,表明本方法重复性较好。
2.1.7 稳定性试验 精密吸取同一供试品溶液10 ?L,分别在0、4、8、12、18、24 h注入色谱仪中,测定亚麻木酚素峰面积,结果RSD=1.99%,表明供试品溶液在24 h内稳定。
2.1.8 专属性试验 精密吸取对照品溶液、供试品溶液及阴性对照溶液各10 ?L,按“2.1.1”项下色谱条件进行测定,样品中辅料成分对测定无干扰,色谱图见图1。
2.2 优选缓释片最佳处方
2.2.1 缓释片的制备 亚麻木酚素缓释片的制备原辅料均过100目筛。精密称取处方量的亚麻木酚素(100 mg/片)及HPMC、EC、淀粉,混合均匀,加
入70%乙醇液为黏合剂制软材;20目筛挤压制湿颗粒,鼓风恒温干燥箱中50 ℃干燥2 h,按质量分数1%的量加入微粉硅胶,混匀,压片(6~8 kg),即得,每片400 mg。
2.2.2 释放度考察 按2010年版《中华人民共和国药典》附录释放度测定法第1法[7]有关规定,转速为100 r/min,温度为(37±0.5)℃,释放介质为新鲜蒸馏水900 mL。随机取试验样品6片,分别置于各溶出杯中,立即计时,于2、6、12 h取溶液5 mL,同时补充5 mL同温度的释放介质,溶液水浴蒸干,甲醇定容至10 mL,经0.45 μm微孔滤膜过滤,即为供试品。供试品于280 nm处测定含量,计算亚麻木酚素的累积释放度。
2.2.3 试验设计与结果 预试验表明,HPMC量、EC量和淀粉量是影响片剂释放的主要因素。根据初步考察结果,采用HPMC用量(A)、EC用量(B)及淀粉用量(C)作为考察因素,其范围为:A 20%~50%,B 10%~30%,C 5%~20%。根据星点设计的原理,各因素设置5个水平,可用代码值±a、±1、0来表示。对于三因素的星点设计a=1.732,因素及水平表见表1,具体方案安排见表2。
2.2.4 回归方程 用Oringin7.0统计软件,以缓释片在2、6、12 h的累积释放度为评价指标,分别对各处方进行多元线性回归和二次多项式方程拟合[8-9]。根据最优拟合方程,用Oringin7.0软件分别绘制评价指标与各因素的三维效应面与二维等高线图。将各释放时间点二维等高线最佳释放区域重叠,能得到决定所研制缓释片释放度因素的优化区域,即为最佳处方区域。分别在亚麻木酚素缓释片的最佳处方区域内选定一个处方,按“2.2.1”项下方法制备缓释片,按“2.2.2”项下方法测定各时间点的释放度。以所测的2、6、12 h的释放度对根据二次多项式模型分析计算出的预测值进行相关性分析。二次多项式回归方程见表3。拟合结果发现,就置信度(P)和拟合优度(r)而言,二次多项式模型明显优于多元线性模型。
表3 二次多项式回归方程
时间 方程 r2 P值
2 h R2=0.97-0.027A-0.019 5B+3.816×10-3C+4.503×10-4AB-3.33×10-4AC+5.003×10-4BC+2.773×10-4A2-7.628×10-5B2-1.355×10-4C2 0.758 3 0.032 3
6 h R6=1.0548-0.030 2A-0.014 5B+0.036 5C+5.253 3×10-4AB-8.333 8×10-4AC+8.505 4×10-4BC+3.502 9×10-4A2-3.623 4×10-4B2-9.101 16×10-4C2 0.798 4 0.015 0
12 h R12=1.628 5-0.042 43A-0.025 8B+0.035C+5.253 3×10-4AB-1.166 7×10-3AC+1.651 1×10-3BC+5.598 2×10-4A2-2.407 7×10-4B2-1.138 7×10-3C2 0.796 6 0.015 6
2.2.5 效应面优化、预测与验证 根据上述所确立的二次多项式模型,分别绘制缓释片2、6、12 h累积释放度的效应面和等高线图,见图2~图4。
本研究预期目标为研制12 h给药一次的亚麻木酚素缓释片,并且尽可能减少突释和保证释药完全。将缓释片各时间段的最佳释放区域确定为:2 h为10%~30%,6 h为50%~70%,12 h为80%~100%。在此基础上,结合释放度图形,由二次多项式模型得到的优化区域,最终确定缓释片的最佳处方为:HPMC用量为43%,EC用量为26%,淀粉的用量为17%。
在预测最优处方的基础上,进行3批样品放大试验,分别测定2、6、12 h的释放度,计算累积释放率,测定结果见表4。可知,由二次多项式模型对2、6、12 h累积释放度分别做出的预测值和实验值都非常接近,表明所建立的模型稳定。
3 讨论
在缓释辅料选取中,首先通过预试验以0~24 h缓释片的累积释放度为评价指标,通过单因素考察了不同黏度HPMC(K4M、K15M、K100M)对缓释片释放度的影响,从结果来看,HPMC K100M释放效果最好。以HPMC为主要骨架材料,加入疏水性辅料EC可调节药物的溶出,二者组成的混合型缓释骨架系统对亚麻木酚素表现出良好的缓慢释放效果,未见亲水凝胶骨架片常出现的药物释放开始时段较严重的突释现象。
在试验优选出的最佳处方范围内,选取的3个处方的评价指标(2、6、12 h累积释放度)预测值与实验值偏差较小,且符合预期的试验目标,说明所建立的模型具有较好的预测性,可用于亚麻木酚素缓释片处方的优化。
参考文献:
[1] 房娜.亚麻木酚素抗氧化产品开发[D].济南:山东师范大学,2013.
[2] McCANN SE, MUTI P, VITO D, et al. Dietary lignan intakes and risk of pre- and post menopausal breast cancer[J]. Int J Cancer, 2004,111:440-443.
[3] 那晓琳,赵新宇,李丽娜,等.亚麻木酚素对去卵巢大鼠血脂水平的影响[J].营养学报,2012,34(2):159-163.
[4] 张进丽,亚麻木酚素(SDG)治疗中老年女性骨质疏松症的临床研究[J].中国现代医学杂志,2013,23(31):65-66.
[5] 张文斌,许时婴.亚麻木酚素的微波辅助提取工艺研究[J].天然产物研究与开发,2006,18(2):286-290.
[6] 沈晓东,李多伟,赵蓉,等.亚麻木酚素的研究进展[J].中成药,2009, 31(4):598-600.
[7] 国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:附录87.
[8] 王明森,王洪光.盐酸普萘洛尔缓释片的研究[J].西北药学杂志, 2009,24(6):469-471.
[9] 周云飞,王柏.星点设计-效应面法优化盐酸氨溴索缓释片处方[J].中国药科大学学报,2007,38(1):39-42.
(收稿日期:2015-06-23)
(修回日期:2015-07-09;编辑:陈静)

