Box—Behnken设计—效应面法优化莲心碱羟丙基—β—环糊精包合物制备及表征
周江 吴婷婷 李美云 雷小小 唐婷 桂卉
摘要:目的 优选莲心碱羟丙基-β-环糊精(HP-β-CD)包合物的最佳制备工艺,考察莲心碱HP-β-CD包合物体外溶出性质。方法 采用饱和水溶液法制备包合物,以45 min体外累积溶出度为指标,采用三因素三水平Box-Behnken设计,考察HP-β-CD与莲心碱投料比、搅拌时间、包合温度对制备工艺的影响,对结果进行多元线性和二项式拟合,效应面法筛选出最佳包合工艺,进行预测分析和验证试验,并应用显微电镜扫描法、差示量热扫描法、红外光谱、X射线衍射法对包合物进行结构表征。结果 莲心碱HP-β-CD包合物的最佳制备工艺为:HP-β-CD用量为莲心碱投料量的4.5倍,搅拌时间为3.7 h,包合温度为52 ℃。表征鉴定结果显示莲心碱HP-β-CD包合物已形成。结论 本研究优选的最佳包合工艺稳定可行,能显著提高莲心碱的溶出度,增加其生物利用度。
关键词:莲心碱;羟丙基-β-环糊精;包合物;Box-Behnken设计-效应面法;累积溶出度
DOI:10.3969/j.issn.1005-5304.2016.03.022
中图分类号:R283.5 文献标识码:A 文章编号:1005-5304(2016)03-0080-05
Abstract: Objective To optimize the preparation of liensinine HP-β-CD inclusion compound; To investigate its dissolution performance in vitro. Methods The inclusion compound of liensinine was prepared by using saturated water solution method; the cumulative dissolution (45 min) was used as an indicator and Box-Behnken design was adopted to evaluate the influence of feed ratio, mixing time and inclusion temperature on preparation process. Results were analyzed by multiple linear and binomial fitting; response surface methodology was used to screen the optimal inclusion process; predictive parsing and verification experiment were conducted; SEM, DSC, IR, and XRD were applied for the structural characterization of inclusion compound of liensinine. Results The optimal preparation process was: HP-β-CD was 4.5 times the amount of liensinine feeding amount; mixing time was 3.7 h; inclusion temperature was 52 ℃. HP-β-CD inclusion compound of liensinine formed. Conclusion Optimal inclusion process is stable and feasible, which can significantly improve the dissolution of liensinine and increase its bioavailability.
Key words: liensinine; HP-β-CD; inclusion compound; Box-Behnken design; cumulative dissolution
莲心碱(liensinine)是中药莲子心中含量较高的一种双苄基异喹啉类生物碱,具有降压、抗心律失常、抗氧化、对抗血栓形成等作用[1-3],具有良好的开发应用前景。但莲心碱在水中溶解度差,口服溶出速率较慢,极大地限制其临床应用。通过增加其在体外的溶出速率有望提高莲心碱在体内的生物利用度。包合技术具有增加药物溶解度、降低药物刺激性、减少毒性、提高药物稳定性、提高生物利用度等优点[4-5]。本研究采用相溶解度法考察羟丙基-β-环糊精(HP-β-CD)对莲心碱的增溶作用,以体外45 min累积溶出度为指标,通过Box-Behnken试验设计优化莲心碱HP-β-CD包合物的制备工艺,运用显微电镜扫描法、差示量热扫描法、红外检测法、X射线衍射法对莲心碱HP-β-CD包合物进行物相鉴定。
1 仪器与试药
傅里叶红外扫描仪(FTIR-8000,日本岛津公司);ZRS-8G型溶出仪(天津大学无线电厂);756PC型紫外分光光度仪(上海奥普勒有限公司);DF-101S型集热式恒温加热磁力搅拌器(巩义市予华有限责任有限公司);CP-114型电子分析天平(上海奥豪斯公司);X衍射扫描仪(北京宏昌信科技有限公司:XRD系列);差示量热扫描仪(美国TA公司,Q2000);REM电子扫描仪(FEI公司,Quanta-200)。
莲心碱标准品(上海源叶生物有限公司,HPLC纯度≥98%,批号20121122);莲心碱(自制,含量≥50%);HP-β-CD(上海源叶生物科技有限公司);甲醇(分析纯,成都市科龙化工试剂厂)。
2 方法与结果
2.1 标准曲线的绘制
在200~700 nm进行全波长扫描,结果显示在282 nm处包合物中莲心碱及莲心碱标准品均有最大吸收。配制不同浓度莲心碱标准品,测量其吸光度值,得线性回归方程:Y=0.139X+0.018 3,r=0.999 2。
2.2 精密度试验
精密量取标准品溶液(0.10 mg/mL)1 mL,用甲醇定容至10 mL,取6份标准品溶液各1 mL,按标准曲线方法操作,测量吸光度值分别为0.119、0.117、0.120、0.120、0.120、0.121,计算得RSD=0.65%,结果表明仪器精密度良好。
2.3 稳定性试验
精密量取莲心碱标准品(0.10 mg/mL)1 mL,定容至10 mL,每隔2 h取样,于282 nm处测定紫外吸光度值,分别在0、2、4、6、8、12 h测得吸光度值为1.328、1.340、1.344、1.335、1.343、1.332,平均值为1.337,RSD=0.206%(n=6)。结果表明莲心碱标准品溶液在12 h内较稳定。
2.4 相溶解度法
在HP-β-CD浓度分别为0、0.025、0.05、0.1、0.125、0.2 mol/L的水溶液中(100 mL)添加莲心碱提取物0.5 g(含莲心碱4 mg),于25 ℃磁力搅拌,让其平衡4 h,溶解平衡后取上清液,过0.45 μm微孔滤膜,测量其吸光度值,计算莲心碱的表观溶解度,以HP-β-CD溶液浓度为横坐标、莲心碱的表观溶解度为纵坐标,绘制平衡相溶解度曲线。结果表明,在0~0.2 mol/L范围内,随着HP-β-CD浓度的增加,莲心碱的表观溶解度呈良好的线性增加,其相溶解度方程为Y=0.828 0X+0.225 0,r2=0.999 1。说明莲心碱与HP-β-CD以摩尔比1∶2的比例(质量比约1∶4)进行包合,且HP-β-CD具有提高莲心碱溶解度的作用[6]。
2.5 累积溶出度测定
按照2010年版《中华人民共和国药典》(二部)附录ⅩC溶出度测定方法(桨法)测定溶出度。取样品各1 g,以pH 6.8磷酸盐缓冲液为溶出介质,转速为100 r/min,分别在0、3、8、10、20、30、45 min时取样7 mL(取样后立即补充等量的溶出介质),过0.45 μm微孔滤膜,取滤液作为供试品,在282 nm处测定其吸光度值,按下式计算累积溶出百分率。
q(%)=[Cq×V1+(C1+C2+…+Cq-1)×V2]/M/1000×100%
其中,q(%)为第q个取样点时的累积溶出百分率;Cq为第q个取样点时的药物浓度;V1为溶出介质的总体积,V1=1000 mL;V2为每次取样的体积,V2=7 mL;M为称取的样品含莲心碱的量。
精密称取莲心碱原料药3份,分别为1.01、0.99、1.01 g,按上述方法测得3份原料药样品45 min累积溶出度分别为22.70%、21.34%、22.59%,样品累积溶出度平均值为22.54%。
2.6 Box-Behnken设计-效应面分析法优选包合物制备工艺
2.6.1 试验设计与结果 通过预试验得知,采用饱和水溶液法制备莲心碱包合物对莲心碱的增溶效果较好,影响包合物包合的主要因素为药物与HP-β-CD比例、搅拌时间、包合温度,每个因素设计3个水平(低、中、高分别以-1、0、1进行编码),因素水平见表1。以包合物中莲心碱的累积溶出百分率(Y)为指标,筛选莲心碱包合的最佳工艺,按Box-Behnken试验设计的统计学要求,各组试验安排及结果见表2,模型方差分析见表3。
2.6.2 模型拟合及显著性检验 采用Design-Expert 8.05软件对上述试验数据进行多元回归拟合,得到二次回归方程模型为:Y=-401.896 50+21.450 50A+3.944 88B+16.325 12C-0.461 25AB-0.232 25AC+0.125 62BC-0.854 44A2-1.147 56B2-0.150 70C2,决定系数R2=0.891 1。对该回归模型及其系数进行方差分析,结果显示该模型方程达到极显著水平(P<0.01),且失拟项不显著(P>0.05),表明该回归模型的拟合情况良好,回归方程的代表性较好,能准确预测实际情况。其校正决定系数(R2adj)为0.971 2,表明此模型能解释97.12%效应值变化,因此该模型拟合程度良好,试验误差小,仅有约4%不能由此模型进行解释。
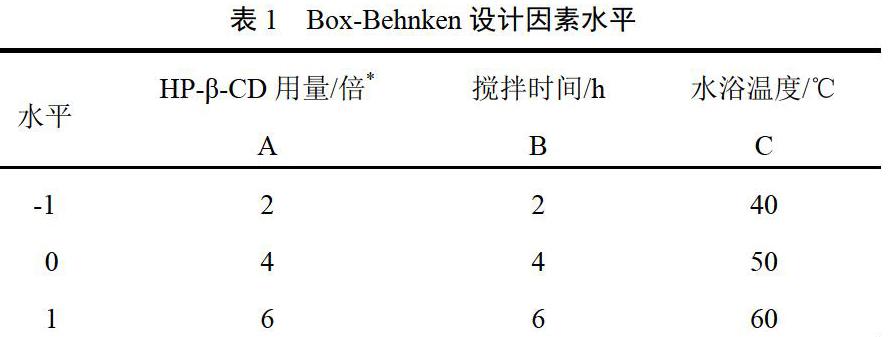
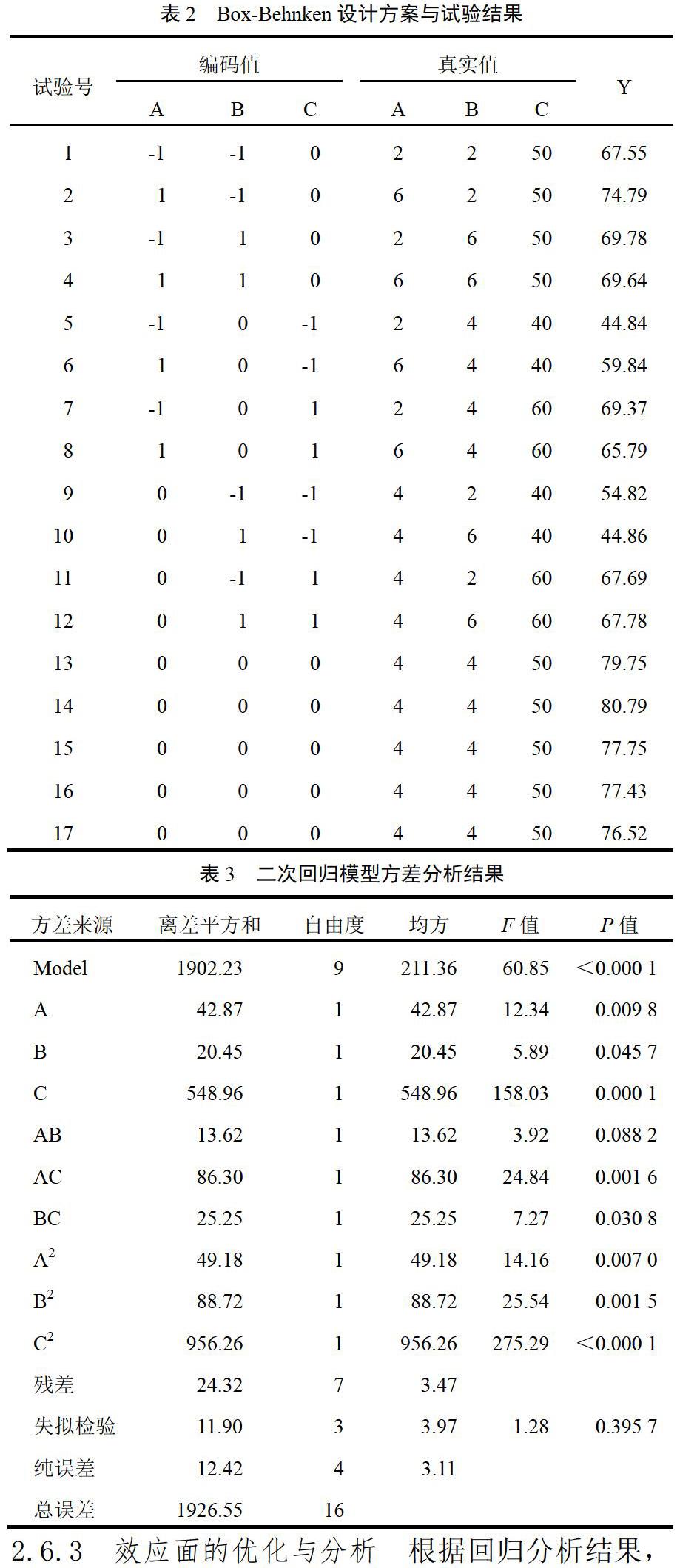
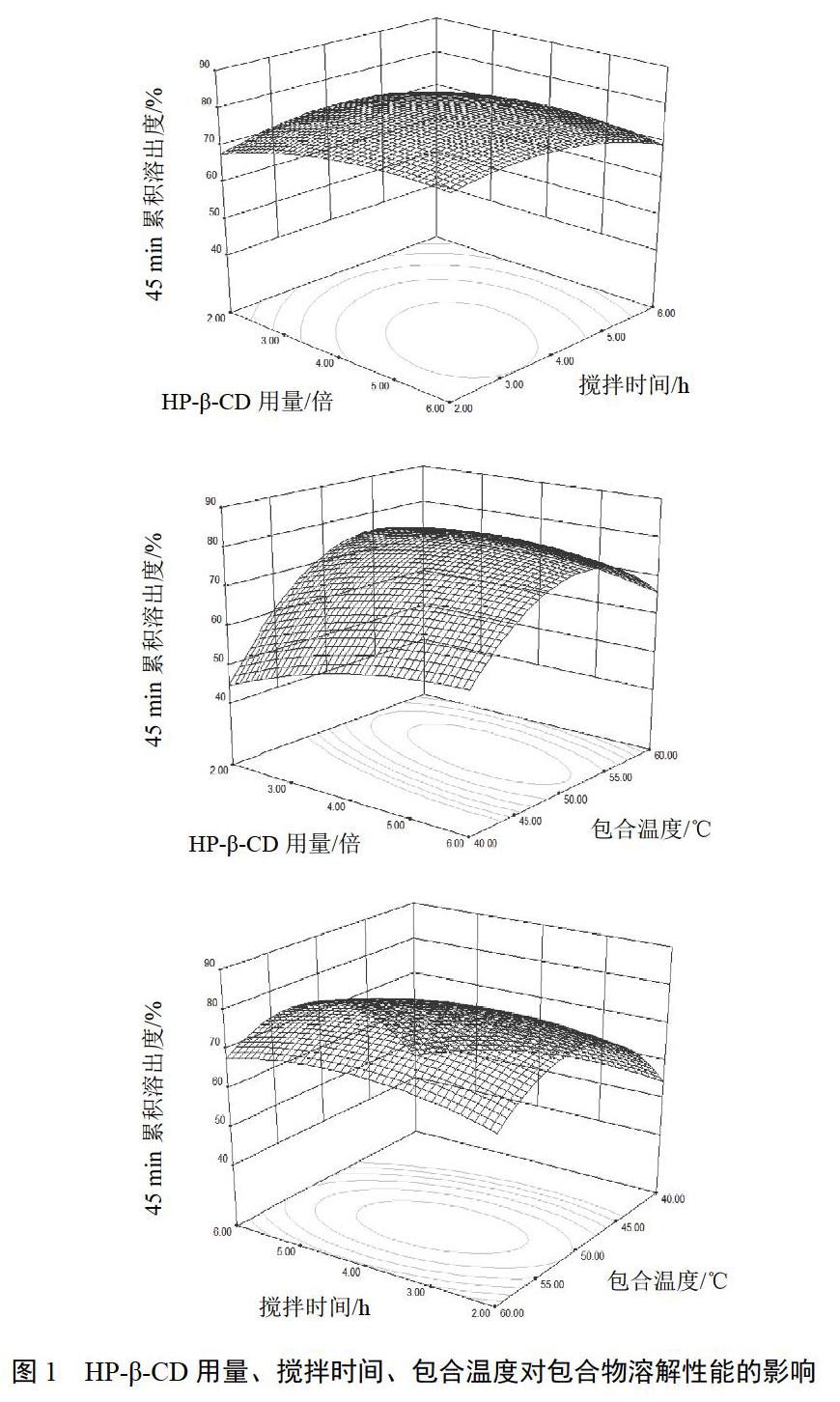
2.6.3 效应面的优化与分析 根据回归分析结果,采用Design-Expert8.05软件做三维图(见图1)。从曲面图和等高线图可以直观看出,HP-β-CD用量和包合温度对包合物的溶出性能有极其显著的影响(P<0.001),而搅拌时间对溶出性能的影响次之。当HP-β-CD用量、搅拌时间及包合温度逐渐增加时,包合物的溶解性能均为先增大后减小。当HP-β-CD用量约为4倍、搅拌时间约4 h、包合温度约50 ℃时,包合物的45 min累积溶出度接近最大值。根据本试验目的,要求包合物累积溶出度越大越好,通过Design-Expert8.05软件可找到最佳包合工艺参数,即HP-β-CD用量为莲心碱投料量的4.45倍,搅拌时间为3.68 h,包合温度为52.26 ℃。
2.6.4 模型的预测与验证 考虑到实际操作方便,将最佳包合工艺修正为:HP-β-CD用量为莲心碱投料量的4.5倍,搅拌时间为3.7 h,包合温度为52 ℃。在此条件下,莲心碱包合物的45 min累积溶出度的理论值为79.77%。按修正后的最佳包合工艺进行验证试验,测得的莲心碱45 min累积溶出度为(78.58±1.21)%。与理论预测值比较接近,说明此模型拟合度高,基于Box-Behnken设计所得的最佳包合工艺参数准确可靠。
2.7 莲心碱羟丙基-β-环糊精包合物表征
2.7.1 莲心碱包合物的制备 以HP-β-CD为包合物的载体,采用饱和水溶液法制备包合物,精密称取HP-β-CD 4.5 g溶于30 mL蒸馏水中,莲心碱1 g以20 mL甲醇溶解,超声10 min,混合,置于磁力搅拌机中搅拌3.7 h,控制水浴温度为52 ℃,加热挥干多余的溶剂及水分,40 ℃真空干燥,过80目筛。
2.7.2 莲心碱与羟丙基-β-环糊精物理混合物的制备 以质量比1∶4.5比例准确称量莲心碱与HP-β-CD,置于研钵中充分混合,得到莲心碱与HP-β-CD的物理混合物。
2.7.3 显微电镜扫描 25 kV加速电压下,用扫描电镜直接观察莲心碱、HP-β-CD、莲心碱与HP-β-CD物理混合物及莲心碱HP-β-CD包合物,结果见图2。可见,莲心碱主要呈现出少量片状晶体,HP-β-CD拥有独特的腔内疏水及腔外亲水的“锥筒”状空腔,而在包合物中未见莲心碱晶体状物质存在,因莲心碱已高度分散在HP-β-CD中,掩盖了莲心碱晶体,表明莲心碱包合物已形成。
2.7.4 红外光谱特征 取适量莲心碱、HP-β-CD、莲心碱与HP-β-CD物理混合物、莲心碱HP-β-CD包合物,用红外灯干燥后,与KBr混合,置于玛瑙研钵中研磨成粉末,在相同条件下检测其红外吸收光谱,扫描范围为400~4000 cm-1,红外光谱图见图3。莲心碱的羟基峰位在3400 cm-1,羰甲基峰位在2359 cm-1左右。在2359 cm-1附近HP-β-CD没有吸收,莲心碱与HP-β-CD物理混合物中表现出了该特征峰,而包合物在此波数附近无吸收。在3400 cm-1附近的-OH吸收峰比较宽,表明HP-β-CD与莲心碱形成了氢键,物质特征峰发生了明显的变化,故包合物形成[7-8]。
2.7.5 差示扫描量热分析 气氛为N2,10 ℃/min速度升温,将莲心碱、HP-β-CD、莲心碱与HP-β-CD物理混合物、莲心碱HP-β-CD包合物封闭在铝制坩埚中,调节温度在30~300 ℃范围内进行差示量热扫描,差示扫描升温曲线见图4。由图可知,莲心碱在115 ℃出现1个较大的吸热峰。莲心碱与HP-β-CD物理混合物在115 ℃及80 ℃出现了2个吸热峰,分别为莲心碱与HP-β-CD的熔点峰,而莲心碱HP-β-CD包合物在115 ℃无吸热峰,只存在80 ℃的HP-β-CD特征峰,表明固体分散体中不存在莲心碱的结晶,莲心碱是以非定型状态均匀分散在HP-β-CD中,即形成了包合物[9-10]。
2.7.6 X线衍射分析 取适量莲心碱、HP-β-CD、莲心碱与HP-β-CD物理混合物、莲心碱HP-β-CD包合物的粉末,进行X线衍射,压片法制片,采用Cu靶,KA线,扫描范围5°~75°,加速电压为40 kV,扫描速度8°/min。X线衍射结果见图5。由图可知,莲心碱存在较多的特征峰,如在12.5°~52.66°之间有4处较大的吸收。HP-β-CD在此范围内有10.64°、18.98°处2个较大的衍射峰。莲心碱与HP-β-CD的物理混合物的衍射峰型基本上为两者的叠加,保留了莲心碱与HP-β-CD的所有特征峰;而莲心碱固体分散体的衍射图谱与HP-β-CD的衍射图谱基本上一致,特征晶体的衍射峰全部消失,仅保留了HP-β-CD的2个特征峰,表明莲心碱以无定型状态均匀分散在载体中,形成了包合物[11-12]。
3 讨论
本试验曾经采用研磨法及喷雾干燥法制备莲心碱包合物,发现研磨法制备的包合物对莲心碱的增溶作用不明显,且操作时间长,从实际生产来看,不适合大量生产;喷雾干燥法制备莲心碱包合物,收率较低,且操作工序复杂。饱和水溶液法制备包合物对莲心碱的增溶效果较明显,且工序简单,故采用饱和水溶液法制备莲心碱包合物。
本试验采用相溶解度法测定莲心碱的表观溶解度,表明莲心碱的表观溶解度与HP-β-CD成良好的线性关系(投料比1∶1~1∶4),此时HP-β-CD能显著提高莲心碱在水中的溶解度,可大大提高莲心碱的生物利用度。在此基础上,采用Box-Behnken设计-效应面法安排试验,并对数据进行二次回归方程模型的拟合及方差分析,得到可靠数据模型优选出莲心碱HP-β-CD包合物的最佳制备工艺,制备的包合物提高了莲心碱的体外溶解度,为莲心碱及莲心碱相关制剂的开发奠定了基础,也为包合技术用于增加难溶性药物的溶解度和生物利用度提供了依据。
本研究采用显微电镜扫描法、差示量热扫描法、红外检测法、X射线衍射法对包合物进行表征鉴定,可以确定莲心碱以非晶体状态存在于包合物中,莲心碱HP-β-CD包合物已形成。由于HP-β-CD具有上窄下宽两端开口环状中空圆筒形截椎体的镂空结构,难溶性莲心碱分子能进入HP-β-CD的空腔结构内,与空洞内部的碳氢键和醚键形成稳定的包合物结构。包合物在结构上仍保留了环糊精原有的空腔结构,又因HP-β-CD结构外部的亲水性,水溶性强,故莲心碱被包合后溶出度提高。
参考文献:
[1] 许磊,姚崇舜,陈济明.莲心碱的研究概况[J].中草药,2000,31(12):955-957.
[2] 余万桂,邓德明,陈庭煊,等.莲心碱对大鼠脑缺血/在灌注后TNF-α表达的影响[J].中药药理与临床,2009,25(1):16-18.
[3] 王辉,刘刚,罗顺德.莲心碱对血小板聚集、凝血功能和血栓形成的影响[J].中国药理学通报,2010,26(6):768-771.
[4] 谷福根,高永良,崔福德.环糊精包合物研究进展[J].中国新药杂志, 2005,14(6):686-692.
[5] WU F, ZHANG W, LI L, et al. Inhibitory effects of honokiol on lipopolysaccharide-induced cellular responses and signaling events in human renal mesangial cells[J]. Eur J Pharmacol,2011, 654(1):117-121.
[6] 饶涛,李东勋,何秀菊,等.α-常春藤皂苷-羟丙基-β-环糊精包合物的制备及鉴定[J].中国实验方剂学杂志,2013,19(18):1-4.
[7] 陈建平,苏健裕,陈玲,等.右旋龙脑-β-环糊精包合物的制备及其结构表征[J].现代药物与临床,2011,26(6):485-489.
[8] 陈建平,赵玲,苏健裕,等.氟苯尼考-羟丙基-β-环糊精包合物的制备及其结构表征[J].应用基础与工程科学学报,2013,21(1):63-70.
[9] 文震,刘波,郑宗坤,等.玫瑰精油β-环糊精包合物的制备与表征[J].食品科学,2009,10(30):29-32.
[10] 徐才兵,贾运涛,田睿,等.和厚朴酚羟丙基-β-环糊精包合物的制备及验证[J].中国药学杂志,2013,16(48):1385-1388.
[11] 苏彩娟,王金水,刘本国,等.芦丁/羟丙基-β-环糊精包合物的表征及其抗氧化能力研究[J].河南工业大学学报:自然科学版,2011,32(1):53-57.
[12] 李海浪,高乾宏,吴国忠,等.叶酸羟丙基-β-环糊精包合物的制备与表征[J].医学研究杂志,2013,42(8):98-101.
(收稿日期:2015-05-06)
(修回日期:2015-07-09;编辑:陈静)



摘要:目的 优选莲心碱羟丙基-β-环糊精(HP-β-CD)包合物的最佳制备工艺,考察莲心碱HP-β-CD包合物体外溶出性质。方法 采用饱和水溶液法制备包合物,以45 min体外累积溶出度为指标,采用三因素三水平Box-Behnken设计,考察HP-β-CD与莲心碱投料比、搅拌时间、包合温度对制备工艺的影响,对结果进行多元线性和二项式拟合,效应面法筛选出最佳包合工艺,进行预测分析和验证试验,并应用显微电镜扫描法、差示量热扫描法、红外光谱、X射线衍射法对包合物进行结构表征。结果 莲心碱HP-β-CD包合物的最佳制备工艺为:HP-β-CD用量为莲心碱投料量的4.5倍,搅拌时间为3.7 h,包合温度为52 ℃。表征鉴定结果显示莲心碱HP-β-CD包合物已形成。结论 本研究优选的最佳包合工艺稳定可行,能显著提高莲心碱的溶出度,增加其生物利用度。
关键词:莲心碱;羟丙基-β-环糊精;包合物;Box-Behnken设计-效应面法;累积溶出度
DOI:10.3969/j.issn.1005-5304.2016.03.022
中图分类号:R283.5 文献标识码:A 文章编号:1005-5304(2016)03-0080-05
Abstract: Objective To optimize the preparation of liensinine HP-β-CD inclusion compound; To investigate its dissolution performance in vitro. Methods The inclusion compound of liensinine was prepared by using saturated water solution method; the cumulative dissolution (45 min) was used as an indicator and Box-Behnken design was adopted to evaluate the influence of feed ratio, mixing time and inclusion temperature on preparation process. Results were analyzed by multiple linear and binomial fitting; response surface methodology was used to screen the optimal inclusion process; predictive parsing and verification experiment were conducted; SEM, DSC, IR, and XRD were applied for the structural characterization of inclusion compound of liensinine. Results The optimal preparation process was: HP-β-CD was 4.5 times the amount of liensinine feeding amount; mixing time was 3.7 h; inclusion temperature was 52 ℃. HP-β-CD inclusion compound of liensinine formed. Conclusion Optimal inclusion process is stable and feasible, which can significantly improve the dissolution of liensinine and increase its bioavailability.
Key words: liensinine; HP-β-CD; inclusion compound; Box-Behnken design; cumulative dissolution
莲心碱(liensinine)是中药莲子心中含量较高的一种双苄基异喹啉类生物碱,具有降压、抗心律失常、抗氧化、对抗血栓形成等作用[1-3],具有良好的开发应用前景。但莲心碱在水中溶解度差,口服溶出速率较慢,极大地限制其临床应用。通过增加其在体外的溶出速率有望提高莲心碱在体内的生物利用度。包合技术具有增加药物溶解度、降低药物刺激性、减少毒性、提高药物稳定性、提高生物利用度等优点[4-5]。本研究采用相溶解度法考察羟丙基-β-环糊精(HP-β-CD)对莲心碱的增溶作用,以体外45 min累积溶出度为指标,通过Box-Behnken试验设计优化莲心碱HP-β-CD包合物的制备工艺,运用显微电镜扫描法、差示量热扫描法、红外检测法、X射线衍射法对莲心碱HP-β-CD包合物进行物相鉴定。
1 仪器与试药
傅里叶红外扫描仪(FTIR-8000,日本岛津公司);ZRS-8G型溶出仪(天津大学无线电厂);756PC型紫外分光光度仪(上海奥普勒有限公司);DF-101S型集热式恒温加热磁力搅拌器(巩义市予华有限责任有限公司);CP-114型电子分析天平(上海奥豪斯公司);X衍射扫描仪(北京宏昌信科技有限公司:XRD系列);差示量热扫描仪(美国TA公司,Q2000);REM电子扫描仪(FEI公司,Quanta-200)。
莲心碱标准品(上海源叶生物有限公司,HPLC纯度≥98%,批号20121122);莲心碱(自制,含量≥50%);HP-β-CD(上海源叶生物科技有限公司);甲醇(分析纯,成都市科龙化工试剂厂)。
2 方法与结果
2.1 标准曲线的绘制
在200~700 nm进行全波长扫描,结果显示在282 nm处包合物中莲心碱及莲心碱标准品均有最大吸收。配制不同浓度莲心碱标准品,测量其吸光度值,得线性回归方程:Y=0.139X+0.018 3,r=0.999 2。
2.2 精密度试验
精密量取标准品溶液(0.10 mg/mL)1 mL,用甲醇定容至10 mL,取6份标准品溶液各1 mL,按标准曲线方法操作,测量吸光度值分别为0.119、0.117、0.120、0.120、0.120、0.121,计算得RSD=0.65%,结果表明仪器精密度良好。
2.3 稳定性试验
精密量取莲心碱标准品(0.10 mg/mL)1 mL,定容至10 mL,每隔2 h取样,于282 nm处测定紫外吸光度值,分别在0、2、4、6、8、12 h测得吸光度值为1.328、1.340、1.344、1.335、1.343、1.332,平均值为1.337,RSD=0.206%(n=6)。结果表明莲心碱标准品溶液在12 h内较稳定。
2.4 相溶解度法
在HP-β-CD浓度分别为0、0.025、0.05、0.1、0.125、0.2 mol/L的水溶液中(100 mL)添加莲心碱提取物0.5 g(含莲心碱4 mg),于25 ℃磁力搅拌,让其平衡4 h,溶解平衡后取上清液,过0.45 μm微孔滤膜,测量其吸光度值,计算莲心碱的表观溶解度,以HP-β-CD溶液浓度为横坐标、莲心碱的表观溶解度为纵坐标,绘制平衡相溶解度曲线。结果表明,在0~0.2 mol/L范围内,随着HP-β-CD浓度的增加,莲心碱的表观溶解度呈良好的线性增加,其相溶解度方程为Y=0.828 0X+0.225 0,r2=0.999 1。说明莲心碱与HP-β-CD以摩尔比1∶2的比例(质量比约1∶4)进行包合,且HP-β-CD具有提高莲心碱溶解度的作用[6]。
2.5 累积溶出度测定
按照2010年版《中华人民共和国药典》(二部)附录ⅩC溶出度测定方法(桨法)测定溶出度。取样品各1 g,以pH 6.8磷酸盐缓冲液为溶出介质,转速为100 r/min,分别在0、3、8、10、20、30、45 min时取样7 mL(取样后立即补充等量的溶出介质),过0.45 μm微孔滤膜,取滤液作为供试品,在282 nm处测定其吸光度值,按下式计算累积溶出百分率。
q(%)=[Cq×V1+(C1+C2+…+Cq-1)×V2]/M/1000×100%
其中,q(%)为第q个取样点时的累积溶出百分率;Cq为第q个取样点时的药物浓度;V1为溶出介质的总体积,V1=1000 mL;V2为每次取样的体积,V2=7 mL;M为称取的样品含莲心碱的量。
精密称取莲心碱原料药3份,分别为1.01、0.99、1.01 g,按上述方法测得3份原料药样品45 min累积溶出度分别为22.70%、21.34%、22.59%,样品累积溶出度平均值为22.54%。
2.6 Box-Behnken设计-效应面分析法优选包合物制备工艺
2.6.1 试验设计与结果 通过预试验得知,采用饱和水溶液法制备莲心碱包合物对莲心碱的增溶效果较好,影响包合物包合的主要因素为药物与HP-β-CD比例、搅拌时间、包合温度,每个因素设计3个水平(低、中、高分别以-1、0、1进行编码),因素水平见表1。以包合物中莲心碱的累积溶出百分率(Y)为指标,筛选莲心碱包合的最佳工艺,按Box-Behnken试验设计的统计学要求,各组试验安排及结果见表2,模型方差分析见表3。
2.6.2 模型拟合及显著性检验 采用Design-Expert 8.05软件对上述试验数据进行多元回归拟合,得到二次回归方程模型为:Y=-401.896 50+21.450 50A+3.944 88B+16.325 12C-0.461 25AB-0.232 25AC+0.125 62BC-0.854 44A2-1.147 56B2-0.150 70C2,决定系数R2=0.891 1。对该回归模型及其系数进行方差分析,结果显示该模型方程达到极显著水平(P<0.01),且失拟项不显著(P>0.05),表明该回归模型的拟合情况良好,回归方程的代表性较好,能准确预测实际情况。其校正决定系数(R2adj)为0.971 2,表明此模型能解释97.12%效应值变化,因此该模型拟合程度良好,试验误差小,仅有约4%不能由此模型进行解释。
2.6.3 效应面的优化与分析 根据回归分析结果,采用Design-Expert8.05软件做三维图(见图1)。从曲面图和等高线图可以直观看出,HP-β-CD用量和包合温度对包合物的溶出性能有极其显著的影响(P<0.001),而搅拌时间对溶出性能的影响次之。当HP-β-CD用量、搅拌时间及包合温度逐渐增加时,包合物的溶解性能均为先增大后减小。当HP-β-CD用量约为4倍、搅拌时间约4 h、包合温度约50 ℃时,包合物的45 min累积溶出度接近最大值。根据本试验目的,要求包合物累积溶出度越大越好,通过Design-Expert8.05软件可找到最佳包合工艺参数,即HP-β-CD用量为莲心碱投料量的4.45倍,搅拌时间为3.68 h,包合温度为52.26 ℃。
2.6.4 模型的预测与验证 考虑到实际操作方便,将最佳包合工艺修正为:HP-β-CD用量为莲心碱投料量的4.5倍,搅拌时间为3.7 h,包合温度为52 ℃。在此条件下,莲心碱包合物的45 min累积溶出度的理论值为79.77%。按修正后的最佳包合工艺进行验证试验,测得的莲心碱45 min累积溶出度为(78.58±1.21)%。与理论预测值比较接近,说明此模型拟合度高,基于Box-Behnken设计所得的最佳包合工艺参数准确可靠。
2.7 莲心碱羟丙基-β-环糊精包合物表征
2.7.1 莲心碱包合物的制备 以HP-β-CD为包合物的载体,采用饱和水溶液法制备包合物,精密称取HP-β-CD 4.5 g溶于30 mL蒸馏水中,莲心碱1 g以20 mL甲醇溶解,超声10 min,混合,置于磁力搅拌机中搅拌3.7 h,控制水浴温度为52 ℃,加热挥干多余的溶剂及水分,40 ℃真空干燥,过80目筛。
2.7.2 莲心碱与羟丙基-β-环糊精物理混合物的制备 以质量比1∶4.5比例准确称量莲心碱与HP-β-CD,置于研钵中充分混合,得到莲心碱与HP-β-CD的物理混合物。
2.7.3 显微电镜扫描 25 kV加速电压下,用扫描电镜直接观察莲心碱、HP-β-CD、莲心碱与HP-β-CD物理混合物及莲心碱HP-β-CD包合物,结果见图2。可见,莲心碱主要呈现出少量片状晶体,HP-β-CD拥有独特的腔内疏水及腔外亲水的“锥筒”状空腔,而在包合物中未见莲心碱晶体状物质存在,因莲心碱已高度分散在HP-β-CD中,掩盖了莲心碱晶体,表明莲心碱包合物已形成。
2.7.4 红外光谱特征 取适量莲心碱、HP-β-CD、莲心碱与HP-β-CD物理混合物、莲心碱HP-β-CD包合物,用红外灯干燥后,与KBr混合,置于玛瑙研钵中研磨成粉末,在相同条件下检测其红外吸收光谱,扫描范围为400~4000 cm-1,红外光谱图见图3。莲心碱的羟基峰位在3400 cm-1,羰甲基峰位在2359 cm-1左右。在2359 cm-1附近HP-β-CD没有吸收,莲心碱与HP-β-CD物理混合物中表现出了该特征峰,而包合物在此波数附近无吸收。在3400 cm-1附近的-OH吸收峰比较宽,表明HP-β-CD与莲心碱形成了氢键,物质特征峰发生了明显的变化,故包合物形成[7-8]。
2.7.5 差示扫描量热分析 气氛为N2,10 ℃/min速度升温,将莲心碱、HP-β-CD、莲心碱与HP-β-CD物理混合物、莲心碱HP-β-CD包合物封闭在铝制坩埚中,调节温度在30~300 ℃范围内进行差示量热扫描,差示扫描升温曲线见图4。由图可知,莲心碱在115 ℃出现1个较大的吸热峰。莲心碱与HP-β-CD物理混合物在115 ℃及80 ℃出现了2个吸热峰,分别为莲心碱与HP-β-CD的熔点峰,而莲心碱HP-β-CD包合物在115 ℃无吸热峰,只存在80 ℃的HP-β-CD特征峰,表明固体分散体中不存在莲心碱的结晶,莲心碱是以非定型状态均匀分散在HP-β-CD中,即形成了包合物[9-10]。
2.7.6 X线衍射分析 取适量莲心碱、HP-β-CD、莲心碱与HP-β-CD物理混合物、莲心碱HP-β-CD包合物的粉末,进行X线衍射,压片法制片,采用Cu靶,KA线,扫描范围5°~75°,加速电压为40 kV,扫描速度8°/min。X线衍射结果见图5。由图可知,莲心碱存在较多的特征峰,如在12.5°~52.66°之间有4处较大的吸收。HP-β-CD在此范围内有10.64°、18.98°处2个较大的衍射峰。莲心碱与HP-β-CD的物理混合物的衍射峰型基本上为两者的叠加,保留了莲心碱与HP-β-CD的所有特征峰;而莲心碱固体分散体的衍射图谱与HP-β-CD的衍射图谱基本上一致,特征晶体的衍射峰全部消失,仅保留了HP-β-CD的2个特征峰,表明莲心碱以无定型状态均匀分散在载体中,形成了包合物[11-12]。
3 讨论
本试验曾经采用研磨法及喷雾干燥法制备莲心碱包合物,发现研磨法制备的包合物对莲心碱的增溶作用不明显,且操作时间长,从实际生产来看,不适合大量生产;喷雾干燥法制备莲心碱包合物,收率较低,且操作工序复杂。饱和水溶液法制备包合物对莲心碱的增溶效果较明显,且工序简单,故采用饱和水溶液法制备莲心碱包合物。
本试验采用相溶解度法测定莲心碱的表观溶解度,表明莲心碱的表观溶解度与HP-β-CD成良好的线性关系(投料比1∶1~1∶4),此时HP-β-CD能显著提高莲心碱在水中的溶解度,可大大提高莲心碱的生物利用度。在此基础上,采用Box-Behnken设计-效应面法安排试验,并对数据进行二次回归方程模型的拟合及方差分析,得到可靠数据模型优选出莲心碱HP-β-CD包合物的最佳制备工艺,制备的包合物提高了莲心碱的体外溶解度,为莲心碱及莲心碱相关制剂的开发奠定了基础,也为包合技术用于增加难溶性药物的溶解度和生物利用度提供了依据。
本研究采用显微电镜扫描法、差示量热扫描法、红外检测法、X射线衍射法对包合物进行表征鉴定,可以确定莲心碱以非晶体状态存在于包合物中,莲心碱HP-β-CD包合物已形成。由于HP-β-CD具有上窄下宽两端开口环状中空圆筒形截椎体的镂空结构,难溶性莲心碱分子能进入HP-β-CD的空腔结构内,与空洞内部的碳氢键和醚键形成稳定的包合物结构。包合物在结构上仍保留了环糊精原有的空腔结构,又因HP-β-CD结构外部的亲水性,水溶性强,故莲心碱被包合后溶出度提高。
参考文献:
[1] 许磊,姚崇舜,陈济明.莲心碱的研究概况[J].中草药,2000,31(12):955-957.
[2] 余万桂,邓德明,陈庭煊,等.莲心碱对大鼠脑缺血/在灌注后TNF-α表达的影响[J].中药药理与临床,2009,25(1):16-18.
[3] 王辉,刘刚,罗顺德.莲心碱对血小板聚集、凝血功能和血栓形成的影响[J].中国药理学通报,2010,26(6):768-771.
[4] 谷福根,高永良,崔福德.环糊精包合物研究进展[J].中国新药杂志, 2005,14(6):686-692.
[5] WU F, ZHANG W, LI L, et al. Inhibitory effects of honokiol on lipopolysaccharide-induced cellular responses and signaling events in human renal mesangial cells[J]. Eur J Pharmacol,2011, 654(1):117-121.
[6] 饶涛,李东勋,何秀菊,等.α-常春藤皂苷-羟丙基-β-环糊精包合物的制备及鉴定[J].中国实验方剂学杂志,2013,19(18):1-4.
[7] 陈建平,苏健裕,陈玲,等.右旋龙脑-β-环糊精包合物的制备及其结构表征[J].现代药物与临床,2011,26(6):485-489.
[8] 陈建平,赵玲,苏健裕,等.氟苯尼考-羟丙基-β-环糊精包合物的制备及其结构表征[J].应用基础与工程科学学报,2013,21(1):63-70.
[9] 文震,刘波,郑宗坤,等.玫瑰精油β-环糊精包合物的制备与表征[J].食品科学,2009,10(30):29-32.
[10] 徐才兵,贾运涛,田睿,等.和厚朴酚羟丙基-β-环糊精包合物的制备及验证[J].中国药学杂志,2013,16(48):1385-1388.
[11] 苏彩娟,王金水,刘本国,等.芦丁/羟丙基-β-环糊精包合物的表征及其抗氧化能力研究[J].河南工业大学学报:自然科学版,2011,32(1):53-57.
[12] 李海浪,高乾宏,吴国忠,等.叶酸羟丙基-β-环糊精包合物的制备与表征[J].医学研究杂志,2013,42(8):98-101.
(收稿日期:2015-05-06)
(修回日期:2015-07-09;编辑:陈静)

