二维阵列色谱分离系统及其在血浆蛋白质组中的应用
黄志等
摘 要 本研究发展了在线二维阵列式液相色谱系统,对血浆蛋白质进行分离分析。在线二维阵列式液相色谱系统进行血浆样品的蛋白质水平分离,整个分离过程仅需4 h,并能进行高丰度蛋白质的快速定位。相比于高丰度蛋白质馏分的直接鉴定,经蛋白质均衡器材料富集后,鉴定得到的低丰度蛋白质数量提高了10倍,低丰度蛋白质的损失大幅度减少。本研究将二维阵列色谱分离系统对血浆样品进行完整的分离分析,共鉴定到了1474种蛋白质,蛋白质浓度动态范围达到了7个数量级。高丰度蛋白质馏分中共鉴定到252种蛋白质,其中有61种为高丰度蛋白质。结果表明,在线二维阵列式液相色谱系统实现了血浆样品中高丰度蛋白质的快速去除和高丰度蛋白质馏分中低丰度蛋白质的富集,显著提高了血浆蛋白质的鉴定能力,在其它复杂样品的分离分析中具有一定的应用前景。
关键词 多维色谱; 阵列色谱; 高丰度蛋白质; 蛋白质均衡器; 血浆
1 引 言
在人类基因组计划完成后,生命科学研究领域进入了功能基因组时代[1]。血浆是临床医学中最为常用的检测样本,因而成为蛋白质组学研究的热点对象。但在血浆样品中,蛋白质的浓度分布超过10个数量级,20种高丰度蛋白质的含量占总蛋白质的99%以上[2,3]。由于低丰度蛋白质在质谱鉴定中易受高丰度蛋白质掩盖效应的影响,因此必须对血浆样品中的高丰度蛋白质进行去除,以提高低丰度蛋白质的鉴定能力[4,5]。
相较于免疫亲和柱去除高丰度蛋白质[6~9],基于多维液相色谱去除高丰度蛋白质是一种通用型的样品预处理技术,一次运行可以去除数十种未知的高丰度蛋白质[10,11]。采用基于该技术原理的强阳离子交换色谱-反相高效液相色谱(SCX-RPLC)二维分离系统,成功对鼠肝样品进行了蛋白质水平的高效分离,一次性去除了58种高丰度蛋白质,鉴定得到的中低丰度蛋白质数提升了3倍[10]。本课题组最新构建的在线阵列式二维常规柱液相色谱系统,已成功应用于在蛋白质水平上进行血浆样品完整蛋白质的分离,大幅缩短了样品的全二维分离时间,对血浆样品中高丰度蛋白质的去除以及血浆样品的深入研究具有较高的应用潜力[12]。
无论采用何种高丰度蛋白质去除方法,在去除的高丰度蛋白质馏分中都会夹带一部分与高丰度蛋白质有相互作用的低丰度蛋白质。因此,从高丰度蛋白质馏分中富集低丰度蛋白质仍是一个难题[13]。蛋白质均衡器技术[14]具有与各种蛋白质相互作用的能力和机会均等的特点,从而可降低馏分中高低丰度蛋白质的范围,实现低丰度蛋白质的富集。血浆样品经过蛋白质均衡器材料Ampholine@PM处理后, 鉴定得到的蛋白质数目提高了1倍[15]。
本研究采用在线二维阵列式液相色谱系统对血浆样品进行蛋白质水平的分离,大幅缩短降低二维分离时间,实现高通量快速分离。针对低丰度蛋白质在质谱鉴定中易被高丰度蛋白质掩盖的问题,血浆样品在在线二维阵列式色谱分离时,对高丰度蛋白质进行了快速定位并将高丰度蛋白质馏分和低丰度蛋白质馏分分别进行后续处理。为了进一步提高低丰度蛋白质的鉴定效果,采用均衡器材料进行高丰度蛋白质馏分中低丰度蛋白质的富集,为发现血浆蛋白质组中新的疾病诊断标志物和药物靶标蛋白质提供更为简便和有潜力的技术方法。
2 实验部分
2.1 仪器与试剂
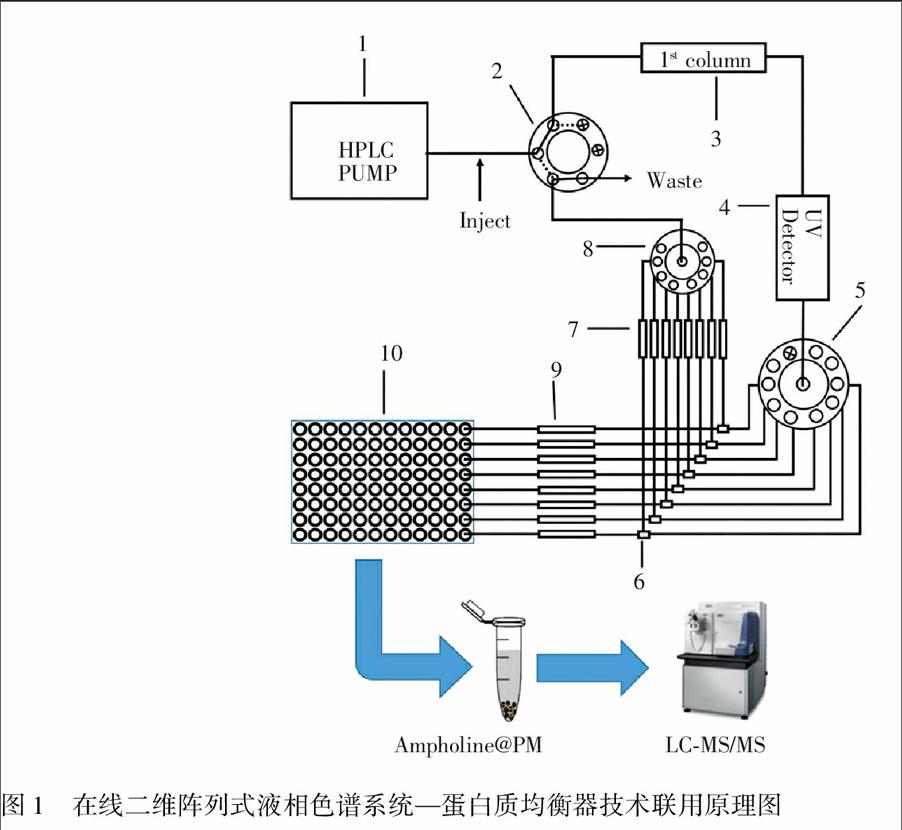
二维阵列液相色谱系统(图1)在岛津2010A色谱系统(日本岛津科技公司)基础上进行构建。六通切换阀、十通电动顺序切换阀、三通、八通分流器均购于美国Valco Instruments公司。第一维SAX柱ProPacTM SAX-10 柱(250 mm × 4.0 mm,10 μm)与保护柱(10 mm × 4.0 mm, 10 μm)均购自美国Thermo公司; 第二维阵列分离柱XtimateTM C8柱(250 mm × 2.1 mm,5 μm, 30 nm,)与保护柱(10 mm × 2.1 mm, 5 μm, 30 nm)均购于上海月旭材料科技有限公司。馏分收集采用Probot LC Packing馏分收集装置(美国Dionex公司),BCA染色测定仪为Epoch超微量微孔板酶标仪(美国BioTek公司)。
三氟乙酸(TFA)、三羟甲基氨基甲烷(Tris)、二硫苏糖醇(DTT)、碘代乙酸钠(IAA)、经TPCK处理过的胰蛋白酶(Trypsin)购于美国Sigma公司; 乙腈(ACN, 德国Merck公司); BCA蛋白质浓度测定试剂盒(上海碧云天生物技术有限公司); 其它试剂为国产分析纯试剂。实验用高纯水经Millipore纯水系统(美国Millipore公司)制备。
人血浆取自上海华山医院检验科的正常人血浆。血浆经2000 g、 4℃离心15 min,取上清液,分装,于-80℃保存待用。血浆通过BCA浓度测定法所得浓度为61.2 mg/mL。
2.2 血浆的阵列式二维色谱分离
2.2.1 血浆样品SAX分离 流动相A:10 mmol/L Tris-HCl, pH 8.0; 流动相B:10 mmol/L Tris-HCl, 0.5 mol/L NaCl, pH 8.0。血浆用A相稀释6倍后进样100 μL。流速为0.5 mL/min,紫外检测波长为215 nm。第一维SAX分离梯度为:0 min, 0% B; 5 min, 0% B; 15 min, 10% B; 45 min, 26% B; 70 min, 40% B; 90 min, 67% B; 90.1 min, 100% B; 100 min, 100% B; 100.1 min, 0 %B; 150 min, 0% B。SAX分离得到的馏分通过十通阀转移到第二维反相预柱上,阀切换程序为:0~19 min,反相柱1(Col. 1); 19~35 min,反相柱5(Col. 5); 35~68 min,反相柱2(Col. 2); 68~73 min,反相柱6(Col. 6); 73~78 min,反相柱7(Col. 7); 78~83 min,反相柱8(Col. 8); 83~100 min,反相柱3(Col. 3); 100~130 min,反相柱4(Col. 4)。
2.2.2 SAX馏分RP分离 流动相A:5% ACN,95% H2O,0.1% TFA; 流动相B:95% ACN,5% H2O,0.1% TFA。流速为1.6.mL/min。第二维RP分离梯度为:0 min, 0% B; 5 min, 0% B; 15 min, 25% B; 25 min, 33% B; 60 min, 40% B; 80 min, 54% B; 85 min, 67% B; 85.1 min, 100% B; 95 min, 100% B; 95.1 min, 0% B; 110 min, 0% B。馏分收集于96孔板上,间隔为1 min。
2.3 馏分的BCA蛋白质定量分析
按照BCA定量试剂盒说明配制BCA染色液,向第二维馏分中加入100 μL BCA染色液/孔,37℃下反应30 min后用酶标仪进行定量检测。
2.4 均衡器材料处理高丰度蛋白质馏分
根据BCA染色液显色结果,选取3个高丰度蛋白质区域分别合并后进行ampholine@PM材料实验。ampholine@PM材料处理馏分的方法在文献\[14\]基础上进行优化。3 mg ampholine@PM材料加入到溶液中,室温振荡2 h。离心除去上清液,用1 mL 10 mmol/L PBS清洗材料3次,每次振荡5 min,离心5 min。先加入1 mL 2 mol/L NaCl,再加入1 mL 100 mmol/L Gly-HCl(pH=3.0),最后加入1 mL 0.1% TFA/80 %乙腈溶液,每次振荡20 min,离心5 min,重复3次,收集合并上清液,即为洗脱液。
2.5 馏分酶解鉴定
第二维剩余馏分根据染色结果合并为20个馏分,与均衡器材料所得洗脱液分别冻干后用25 mmol/L NH4HCO3溶解,加入1 mg/mL DTT,60℃下反应90 min,冷却至室温后加入IAA使其浓度为 20 mmol/L,在室温下避光反应30 min,最后加入1 μg/μL Trypsin,37℃过夜酶解。
Nano-LC-MS/MS分析的色谱分离为微纳Acquity UPLC系统(美国Waters 公司),质谱仪为LTQ Orbitrap XL质谱仪(德国Thermo Scientific公司)。流动相A:0.1% 甲酸(H2O); B:0.1% 甲酸(ACN)。样品首在Acclaim PepMap C18柱(75 μm × 15 cm,Thermo Scientific公司)上进行梯度分离。线性梯度: 0~90 min,5%~45% B,流速为300 nL/min。喷雾电压为1.9 kV。质谱采用数据依赖型采样模式,选取最强的10个峰进行MS/MS分析。每次扫描的MS范围为385~2000 Da,Orbitrap的质量分辨率为100000。肽段碎裂碰撞能量为35%,动态排阻范围为90 s。Xcalibur (version 2.0.7)软件进行质谱图的采集。
2.6 数据库检索
肽段的数据库搜索用Mascot Daemon软件(Version 2.3.0,英国Matrix Science公司)对UniProtKB/Swiss-Prot数据库(Taxonomy: Homo sapiens; Released 2014.04.10, with 20264 entries)进行搜索。选取包含反向序列的Decoy数据库以降低假阳性的鉴定结果。肽段电荷数为+2,+3,+4。酶解方式为Full trypsin (KR) cleavage,漏切位点为至多两个。氨基酸的固定修饰为半胱氨酸的脲甲基化(Carbamidomethylation)可变修饰为甲硫氨酸的氧化(Oxidation)。碎片离子的偏差设为0.8 Da,母离子偏差设为10 ppm。错误发现率(FDR)低于1%。蛋白质鉴定结果为红色加粗方采信, 以提高鉴定的可靠性。对于肽段鉴定,可信度大于95%可认为成功鉴定; 对于蛋白质鉴定,可信度大于95%以及得分超过20可认为成功鉴定。
3 结果与讨论
3.1 在线二维阵列式液相色谱系统
如图1所示, 在本研究中,针对血浆蛋白质组组成复杂的特点,在线二维阵列式常规柱液相色谱系统采用了蛋白质负载量更大的ProPacTM SAX-10常规色谱柱作为第一维分离柱,以提高血浆样品的上样量,从而增加了单次分析中低丰度蛋白质的含量,使其更容易被鉴定发现。为了能将第二维分离得到的蛋白质进行后续更深入的研究,第二维分离柱采用8根2.1 mm内径的XtimateTM C8反相常规柱,不仅可以提高第二维的分离效率,实现了高通量快速分离,同时也可以与后续的馏分收集相匹配,更有利于第二维分离得到的馏分进行后续更深入的研究。经过二维色谱分离后,高丰度蛋白质被分离到有限的组分中,其它馏分中高丰度蛋白质的浓度相对大大降低,从而降低了高丰度蛋白质对低丰度蛋白质产生的质谱抑制效应,提高了低丰度蛋白质得到鉴定的可能性。
相对于scFv@M13@MM材料[16], Ampholine@PM均衡器材料具有较大的蛋白质负载量,保存使用也更为简便。而相比于免疫亲和柱, Ampholine@PM均衡器材料不仅可以去除最高的9种高丰度蛋白质,同时也可以从高丰度蛋白质馏分中富集得到低丰度蛋白质。因而,将二维阵列式液相色谱系统分离得到的高丰度蛋白质馏分,用Ampholine@PM均衡器材料进行处理,以富集馏分中的低丰度蛋白质,从而进一步增加低丰度蛋白质被鉴定得到的可能性。
3.2 二维阵列式液相色谱系统重现性
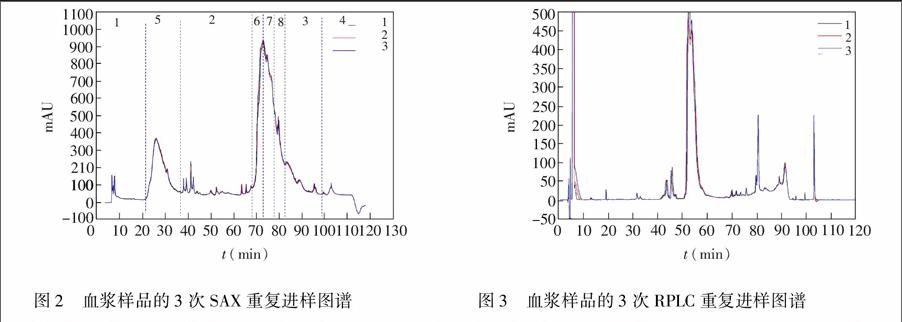
二维阵列式液相色谱系统良好的重现性是进行分离分析的首要基础。对第一维SAX和第二维RP分别选用血浆样品进行3次重复实验,并对所得谱图的保留时间和峰面积进行分析。从SAX色谱图(图2)中选取7个色谱峰进行重现性考察,计算得到的色谱峰保留时间RSD=0.59%,峰面积RSD=6.4%。从RP色谱图(图3)选取7个色谱峰进行重现性考察,计算得到的色谱峰保留时间RSD=0.14%,色谱峰面积RSD=1.7%。这些结果表明,第一维和第二维色谱分离具有优良的重现性,为后续实际血浆样品的分离鉴定奠定了良好的基础。
3.3 在线二维阵列色谱分离去除血浆样品中的高丰度蛋白质
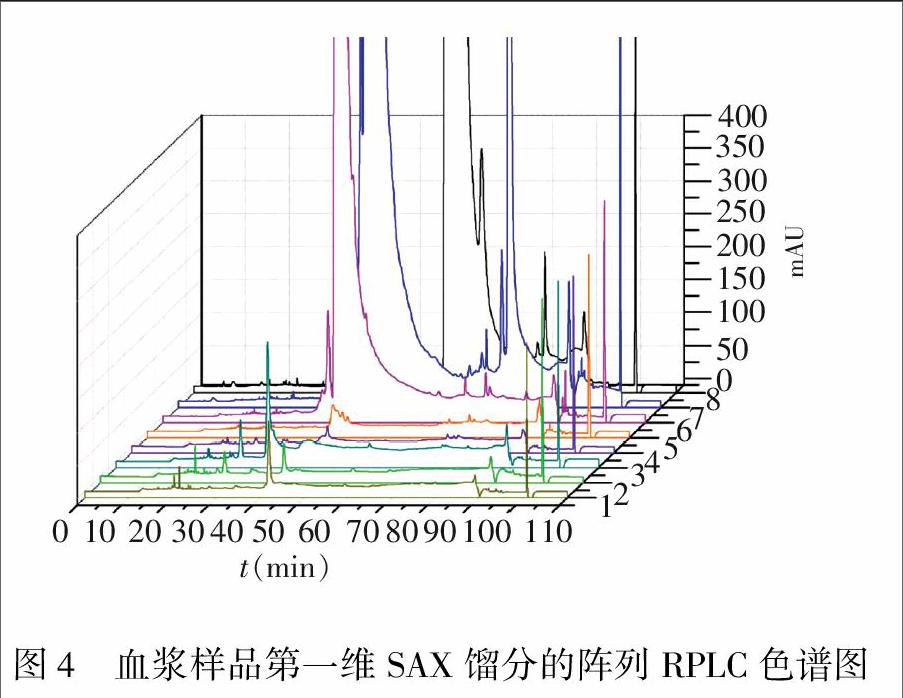
用二维阵列色谱对血浆样品进行了二维分离,图2为血浆样品的第一维分离色谱图。为了降低高丰度蛋白质在第二维分离过程中对低丰度蛋白质的干扰,对第一维馏分切割程序进行了优化,以保证高丰度蛋白质和其它蛋白质尽可能转移到不同的预柱上。图4为血浆样品第一维馏分的阵列RPLC色谱图。相对于单一度的分离,血浆蛋白质经过二维分离后可以得到更多的色谱峰,具有更高的分辨率。与此同时,阵列式色谱分离亦可以显著降低第二维分离所需的时间,大大提高系统的通量。高丰度蛋白质在第二维反相色谱分离中具有较为集中的出峰位置,因而可以运用二维阵列色谱进行血浆样品中高丰度蛋白质的去除。
3.4 均衡器材料对高丰度蛋白质馏分中低丰度蛋白质的富集
血浆样品经过阵列式二维色谱分离,一共收集得到880个馏分点。选取了图5中3个强度存在明显差异的高丰度蛋白质区域(分别记为区域A、B、C)进行Ampholine@PM均衡器材料实验。采用LC-MS分别对3个高丰度蛋白质区域进行了对比鉴定,结果列于表1。区域A未经过Ampholine@PM均衡器材料处理共鉴定到5个低丰度蛋白质,而经过Ampholine@PM材料处理后鉴定得到的低丰度蛋白质数量为59个,为未经处理的11.8倍。区域B未经过Ampholine@PM均衡器材料处理共鉴定得到5个低丰度蛋白质,而经过Ampholine@PM材料处理后鉴定得到的低丰度蛋白质数量为34个,为未经处理的6.8倍。区域C未经过Ampholine@PM均衡器材料处理共鉴定得到3个低丰度蛋白质,而经过Ampholine@PM材料处理后鉴定得到的低丰度蛋白质数量为50个,为未经处理的16.7倍。经过Ampholine@PM均衡器材料处理后,3个高丰度蛋白质区域一共鉴定到148个非冗余蛋白质,其中48个为高丰度蛋白质,100个为低丰度蛋白质。与未经处理的结果对比,采用Ampholine@PM均衡器材料处理后,所富集得到的低丰度蛋白质数量提高了10倍,大幅度减少了高丰度蛋白质馏分中低丰度蛋白质的损失。
3.5 血浆样品的高丰度蛋白质去除及低丰度蛋白质富集
离线二维液相色谱在蛋白质水平进行高丰度蛋白质的大规模高效分离和去除,整个过程离线处理操作多,通量小,所需时间超过了179 h,大大降低了其在复杂样品中应用的可能性[10]。血浆样品经过在线阵列式二维色谱分离,整个过程仅需要4 h,大幅缩短了复杂样品的分离时间,实现了血浆样品的高通量快速分离,并实现了高丰度蛋白质的快速定位。分离得到的55种高丰度蛋白质馏分,经过均衡器材料处理后,一共鉴定出252种非冗余蛋白质,其中61种为高丰度蛋白质,191种为低丰度蛋白质,进一步提高了血浆蛋白质组中低丰度蛋白质的鉴定效果。其它中低丰度蛋白质馏分一共鉴定得到了1376种蛋白质,其中有25种高丰度蛋白质在高丰度蛋白质馏分中亦有存在。Ueda等[17]曾对血浆样品进行了RP-RP分离,经过24 h二维色谱分离以及12天的LC-MS分析,一共鉴定得到了1126种蛋白质。与之相比,血浆样品经过二维色谱分离及ampholine@PM均衡器材料处理后,一共鉴定得到了1474种蛋白质,蛋白质浓度动态范围达到了7种数量级,蛋白质丰度最低的蛋白质为prothrombin (1.2 ng/mL) [18]。由此可见,二维阵列式色谱进行血浆样品的分离分析,不仅可以大幅缩短分离鉴定的时间,同时也能得到更好的蛋白质鉴定效果,展现了其在复杂样品分析中巨大的应用前景。
4 结 论
综上所述,在线二维阵列式液相色谱系统可以对血浆样品进行蛋白质水平的分离,整个分离时间由179 h大幅缩短为4 h,并实现了高丰度蛋白质的快速定位。相比于高丰度蛋白质馏分直接鉴定,经蛋白质均衡器材料处理后,富集得到的低丰度蛋白质数量提高了10倍,从而大幅度减少了低丰度蛋白质的损失。将这种方法对血浆样品进行完整的分析,共鉴定到1474种蛋白质,蛋白质浓度动态范围达到了7种数量级。结果表明,血浆样品的二维阵列色谱分离可以实现高丰度蛋白质的快速定位和去除。高丰度蛋白质馏分运用蛋白质均衡器材料处理,可以实现低丰度蛋白质的富集。二维阵列式液相色谱系统展现了较高的分离通量和较强的低丰度蛋白质富集能力,从而显著提高了血浆蛋白质组的鉴定能力,可以应用于其它复杂样品的分离分析中。
References
1 Hieter P, Boguski M. Science, 1997, 278(5338): 601-602
2 Issaq H J, Xiao Z, Veenstra T D. Chem. Rev., 2007, 107(8): 3601-3620
3 Liu T, Qian W, Gritsenko M A, Xiao W, Moldawer L L, Kaushal A, Monroe M E, Varnum M A, Moore R J, Purvine S O, Maier R V, Davis R W, Tompkins R G, Camp II D G, Smith R D. Mol. Cell. Proteomics, 2006, 5(10): 1899-1913
4 Anderson N L, Anderson N G. Mol. Cell. Proteomics, 2002, 1(11): 845-867
5 ZHANG Wei. Chinese J. Anal. Chem., 2014, 42(12): 1859-1868
张 伟. 分析化学, 2014, 42(12): 1859-1868
6 Gundry R L, White M Y, Nogee J, Tchernyshyov I, van Eyk J E. Proteomics, 2009, 9(7): 2021-2028
7 Stempfer R, Kubicek M, Lang I M, Christa N, Gerner C. Electrophoresis, 2008, 29(21): 4316-4323
8 Ichibangase T, Moriya K, Koike K, Imai K. Biomed. Chromatogr., 2009, 23(5): 480-487
9 Kullolli M,Warren J, Arampatzidou M, Pitteri S J. J. Chromatogr. B, 2013, 939: 10-16
10 Gao M, Deng C, Yu W, Zhang Y, Yang P, Zhang X. Proteomics, 2008, 8(5): 939-947
11 Zhu S, Zhang X, Gao M, Hong G, Yan G, Zhang X. Proteomics, 2012, 12(23-24): 3451-3463
12 HUANG Zhi, HONG Guang-Feng, GAO Ming-Xia, ZHANG Xiang-Min. Chinese J. Chromatogr., 2014, 32(4): 343-348
黄 志, 洪广峰, 高明霞, 张祥民. 色谱, 2014, 32(4): 343-348
13 Boschetti E, Righetti P G. J. Proteomics, 2008, 71(3): 255-64
14 Righetti P G, Boschetti E, Lomas L, Citterio A. Proteomics, 2006, 6(14): 3980-3992
15 Deng N, Zhu G, Chen Y, Wu Q, Liang Z, Sui Z, Zhang L, Yang K, Zhang Y. Anal. Chim. Acta, 2014, 826: 43-50
16 Zhu G, Zhao P, Deng N, Tao D, Sun L, Liang Z, Zhang L, Zhang Y. Anal. Chem., 2012, 84(18): 7633-7637
17 Ueda K, Tatsuguchi A, Saichi N, Toyama A,Tamura K, Furihata M, Takata R, Akamatsu S, Igarashi M, Nakayama M, Sato T, Ogawa O, Fujioka T, Shuin T, Nakamura Y, Nakagawa H. J. Proteome. Res., 2013, 12(10): 4497-4506
18 Chow A, Her Z, Ong E K, Chen J M, Dimatatac F, Kwek D J, Barkham T, Yang H, Rénia L, Leo Y S, Ng L F. J. Infect. Dis., 2011, 203(2): 149-157



摘 要 本研究发展了在线二维阵列式液相色谱系统,对血浆蛋白质进行分离分析。在线二维阵列式液相色谱系统进行血浆样品的蛋白质水平分离,整个分离过程仅需4 h,并能进行高丰度蛋白质的快速定位。相比于高丰度蛋白质馏分的直接鉴定,经蛋白质均衡器材料富集后,鉴定得到的低丰度蛋白质数量提高了10倍,低丰度蛋白质的损失大幅度减少。本研究将二维阵列色谱分离系统对血浆样品进行完整的分离分析,共鉴定到了1474种蛋白质,蛋白质浓度动态范围达到了7个数量级。高丰度蛋白质馏分中共鉴定到252种蛋白质,其中有61种为高丰度蛋白质。结果表明,在线二维阵列式液相色谱系统实现了血浆样品中高丰度蛋白质的快速去除和高丰度蛋白质馏分中低丰度蛋白质的富集,显著提高了血浆蛋白质的鉴定能力,在其它复杂样品的分离分析中具有一定的应用前景。
关键词 多维色谱; 阵列色谱; 高丰度蛋白质; 蛋白质均衡器; 血浆
1 引 言
在人类基因组计划完成后,生命科学研究领域进入了功能基因组时代[1]。血浆是临床医学中最为常用的检测样本,因而成为蛋白质组学研究的热点对象。但在血浆样品中,蛋白质的浓度分布超过10个数量级,20种高丰度蛋白质的含量占总蛋白质的99%以上[2,3]。由于低丰度蛋白质在质谱鉴定中易受高丰度蛋白质掩盖效应的影响,因此必须对血浆样品中的高丰度蛋白质进行去除,以提高低丰度蛋白质的鉴定能力[4,5]。
相较于免疫亲和柱去除高丰度蛋白质[6~9],基于多维液相色谱去除高丰度蛋白质是一种通用型的样品预处理技术,一次运行可以去除数十种未知的高丰度蛋白质[10,11]。采用基于该技术原理的强阳离子交换色谱-反相高效液相色谱(SCX-RPLC)二维分离系统,成功对鼠肝样品进行了蛋白质水平的高效分离,一次性去除了58种高丰度蛋白质,鉴定得到的中低丰度蛋白质数提升了3倍[10]。本课题组最新构建的在线阵列式二维常规柱液相色谱系统,已成功应用于在蛋白质水平上进行血浆样品完整蛋白质的分离,大幅缩短了样品的全二维分离时间,对血浆样品中高丰度蛋白质的去除以及血浆样品的深入研究具有较高的应用潜力[12]。
无论采用何种高丰度蛋白质去除方法,在去除的高丰度蛋白质馏分中都会夹带一部分与高丰度蛋白质有相互作用的低丰度蛋白质。因此,从高丰度蛋白质馏分中富集低丰度蛋白质仍是一个难题[13]。蛋白质均衡器技术[14]具有与各种蛋白质相互作用的能力和机会均等的特点,从而可降低馏分中高低丰度蛋白质的范围,实现低丰度蛋白质的富集。血浆样品经过蛋白质均衡器材料Ampholine@PM处理后, 鉴定得到的蛋白质数目提高了1倍[15]。
本研究采用在线二维阵列式液相色谱系统对血浆样品进行蛋白质水平的分离,大幅缩短降低二维分离时间,实现高通量快速分离。针对低丰度蛋白质在质谱鉴定中易被高丰度蛋白质掩盖的问题,血浆样品在在线二维阵列式色谱分离时,对高丰度蛋白质进行了快速定位并将高丰度蛋白质馏分和低丰度蛋白质馏分分别进行后续处理。为了进一步提高低丰度蛋白质的鉴定效果,采用均衡器材料进行高丰度蛋白质馏分中低丰度蛋白质的富集,为发现血浆蛋白质组中新的疾病诊断标志物和药物靶标蛋白质提供更为简便和有潜力的技术方法。
2 实验部分
2.1 仪器与试剂
二维阵列液相色谱系统(图1)在岛津2010A色谱系统(日本岛津科技公司)基础上进行构建。六通切换阀、十通电动顺序切换阀、三通、八通分流器均购于美国Valco Instruments公司。第一维SAX柱ProPacTM SAX-10 柱(250 mm × 4.0 mm,10 μm)与保护柱(10 mm × 4.0 mm, 10 μm)均购自美国Thermo公司; 第二维阵列分离柱XtimateTM C8柱(250 mm × 2.1 mm,5 μm, 30 nm,)与保护柱(10 mm × 2.1 mm, 5 μm, 30 nm)均购于上海月旭材料科技有限公司。馏分收集采用Probot LC Packing馏分收集装置(美国Dionex公司),BCA染色测定仪为Epoch超微量微孔板酶标仪(美国BioTek公司)。
三氟乙酸(TFA)、三羟甲基氨基甲烷(Tris)、二硫苏糖醇(DTT)、碘代乙酸钠(IAA)、经TPCK处理过的胰蛋白酶(Trypsin)购于美国Sigma公司; 乙腈(ACN, 德国Merck公司); BCA蛋白质浓度测定试剂盒(上海碧云天生物技术有限公司); 其它试剂为国产分析纯试剂。实验用高纯水经Millipore纯水系统(美国Millipore公司)制备。
人血浆取自上海华山医院检验科的正常人血浆。血浆经2000 g、 4℃离心15 min,取上清液,分装,于-80℃保存待用。血浆通过BCA浓度测定法所得浓度为61.2 mg/mL。
2.2 血浆的阵列式二维色谱分离
2.2.1 血浆样品SAX分离 流动相A:10 mmol/L Tris-HCl, pH 8.0; 流动相B:10 mmol/L Tris-HCl, 0.5 mol/L NaCl, pH 8.0。血浆用A相稀释6倍后进样100 μL。流速为0.5 mL/min,紫外检测波长为215 nm。第一维SAX分离梯度为:0 min, 0% B; 5 min, 0% B; 15 min, 10% B; 45 min, 26% B; 70 min, 40% B; 90 min, 67% B; 90.1 min, 100% B; 100 min, 100% B; 100.1 min, 0 %B; 150 min, 0% B。SAX分离得到的馏分通过十通阀转移到第二维反相预柱上,阀切换程序为:0~19 min,反相柱1(Col. 1); 19~35 min,反相柱5(Col. 5); 35~68 min,反相柱2(Col. 2); 68~73 min,反相柱6(Col. 6); 73~78 min,反相柱7(Col. 7); 78~83 min,反相柱8(Col. 8); 83~100 min,反相柱3(Col. 3); 100~130 min,反相柱4(Col. 4)。
2.2.2 SAX馏分RP分离 流动相A:5% ACN,95% H2O,0.1% TFA; 流动相B:95% ACN,5% H2O,0.1% TFA。流速为1.6.mL/min。第二维RP分离梯度为:0 min, 0% B; 5 min, 0% B; 15 min, 25% B; 25 min, 33% B; 60 min, 40% B; 80 min, 54% B; 85 min, 67% B; 85.1 min, 100% B; 95 min, 100% B; 95.1 min, 0% B; 110 min, 0% B。馏分收集于96孔板上,间隔为1 min。
2.3 馏分的BCA蛋白质定量分析
按照BCA定量试剂盒说明配制BCA染色液,向第二维馏分中加入100 μL BCA染色液/孔,37℃下反应30 min后用酶标仪进行定量检测。
2.4 均衡器材料处理高丰度蛋白质馏分
根据BCA染色液显色结果,选取3个高丰度蛋白质区域分别合并后进行ampholine@PM材料实验。ampholine@PM材料处理馏分的方法在文献\[14\]基础上进行优化。3 mg ampholine@PM材料加入到溶液中,室温振荡2 h。离心除去上清液,用1 mL 10 mmol/L PBS清洗材料3次,每次振荡5 min,离心5 min。先加入1 mL 2 mol/L NaCl,再加入1 mL 100 mmol/L Gly-HCl(pH=3.0),最后加入1 mL 0.1% TFA/80 %乙腈溶液,每次振荡20 min,离心5 min,重复3次,收集合并上清液,即为洗脱液。
2.5 馏分酶解鉴定
第二维剩余馏分根据染色结果合并为20个馏分,与均衡器材料所得洗脱液分别冻干后用25 mmol/L NH4HCO3溶解,加入1 mg/mL DTT,60℃下反应90 min,冷却至室温后加入IAA使其浓度为 20 mmol/L,在室温下避光反应30 min,最后加入1 μg/μL Trypsin,37℃过夜酶解。
Nano-LC-MS/MS分析的色谱分离为微纳Acquity UPLC系统(美国Waters 公司),质谱仪为LTQ Orbitrap XL质谱仪(德国Thermo Scientific公司)。流动相A:0.1% 甲酸(H2O); B:0.1% 甲酸(ACN)。样品首在Acclaim PepMap C18柱(75 μm × 15 cm,Thermo Scientific公司)上进行梯度分离。线性梯度: 0~90 min,5%~45% B,流速为300 nL/min。喷雾电压为1.9 kV。质谱采用数据依赖型采样模式,选取最强的10个峰进行MS/MS分析。每次扫描的MS范围为385~2000 Da,Orbitrap的质量分辨率为100000。肽段碎裂碰撞能量为35%,动态排阻范围为90 s。Xcalibur (version 2.0.7)软件进行质谱图的采集。
2.6 数据库检索
肽段的数据库搜索用Mascot Daemon软件(Version 2.3.0,英国Matrix Science公司)对UniProtKB/Swiss-Prot数据库(Taxonomy: Homo sapiens; Released 2014.04.10, with 20264 entries)进行搜索。选取包含反向序列的Decoy数据库以降低假阳性的鉴定结果。肽段电荷数为+2,+3,+4。酶解方式为Full trypsin (KR) cleavage,漏切位点为至多两个。氨基酸的固定修饰为半胱氨酸的脲甲基化(Carbamidomethylation)可变修饰为甲硫氨酸的氧化(Oxidation)。碎片离子的偏差设为0.8 Da,母离子偏差设为10 ppm。错误发现率(FDR)低于1%。蛋白质鉴定结果为红色加粗方采信, 以提高鉴定的可靠性。对于肽段鉴定,可信度大于95%可认为成功鉴定; 对于蛋白质鉴定,可信度大于95%以及得分超过20可认为成功鉴定。
3 结果与讨论
3.1 在线二维阵列式液相色谱系统
如图1所示, 在本研究中,针对血浆蛋白质组组成复杂的特点,在线二维阵列式常规柱液相色谱系统采用了蛋白质负载量更大的ProPacTM SAX-10常规色谱柱作为第一维分离柱,以提高血浆样品的上样量,从而增加了单次分析中低丰度蛋白质的含量,使其更容易被鉴定发现。为了能将第二维分离得到的蛋白质进行后续更深入的研究,第二维分离柱采用8根2.1 mm内径的XtimateTM C8反相常规柱,不仅可以提高第二维的分离效率,实现了高通量快速分离,同时也可以与后续的馏分收集相匹配,更有利于第二维分离得到的馏分进行后续更深入的研究。经过二维色谱分离后,高丰度蛋白质被分离到有限的组分中,其它馏分中高丰度蛋白质的浓度相对大大降低,从而降低了高丰度蛋白质对低丰度蛋白质产生的质谱抑制效应,提高了低丰度蛋白质得到鉴定的可能性。
相对于scFv@M13@MM材料[16], Ampholine@PM均衡器材料具有较大的蛋白质负载量,保存使用也更为简便。而相比于免疫亲和柱, Ampholine@PM均衡器材料不仅可以去除最高的9种高丰度蛋白质,同时也可以从高丰度蛋白质馏分中富集得到低丰度蛋白质。因而,将二维阵列式液相色谱系统分离得到的高丰度蛋白质馏分,用Ampholine@PM均衡器材料进行处理,以富集馏分中的低丰度蛋白质,从而进一步增加低丰度蛋白质被鉴定得到的可能性。
3.2 二维阵列式液相色谱系统重现性
二维阵列式液相色谱系统良好的重现性是进行分离分析的首要基础。对第一维SAX和第二维RP分别选用血浆样品进行3次重复实验,并对所得谱图的保留时间和峰面积进行分析。从SAX色谱图(图2)中选取7个色谱峰进行重现性考察,计算得到的色谱峰保留时间RSD=0.59%,峰面积RSD=6.4%。从RP色谱图(图3)选取7个色谱峰进行重现性考察,计算得到的色谱峰保留时间RSD=0.14%,色谱峰面积RSD=1.7%。这些结果表明,第一维和第二维色谱分离具有优良的重现性,为后续实际血浆样品的分离鉴定奠定了良好的基础。
3.3 在线二维阵列色谱分离去除血浆样品中的高丰度蛋白质
用二维阵列色谱对血浆样品进行了二维分离,图2为血浆样品的第一维分离色谱图。为了降低高丰度蛋白质在第二维分离过程中对低丰度蛋白质的干扰,对第一维馏分切割程序进行了优化,以保证高丰度蛋白质和其它蛋白质尽可能转移到不同的预柱上。图4为血浆样品第一维馏分的阵列RPLC色谱图。相对于单一度的分离,血浆蛋白质经过二维分离后可以得到更多的色谱峰,具有更高的分辨率。与此同时,阵列式色谱分离亦可以显著降低第二维分离所需的时间,大大提高系统的通量。高丰度蛋白质在第二维反相色谱分离中具有较为集中的出峰位置,因而可以运用二维阵列色谱进行血浆样品中高丰度蛋白质的去除。
3.4 均衡器材料对高丰度蛋白质馏分中低丰度蛋白质的富集
血浆样品经过阵列式二维色谱分离,一共收集得到880个馏分点。选取了图5中3个强度存在明显差异的高丰度蛋白质区域(分别记为区域A、B、C)进行Ampholine@PM均衡器材料实验。采用LC-MS分别对3个高丰度蛋白质区域进行了对比鉴定,结果列于表1。区域A未经过Ampholine@PM均衡器材料处理共鉴定到5个低丰度蛋白质,而经过Ampholine@PM材料处理后鉴定得到的低丰度蛋白质数量为59个,为未经处理的11.8倍。区域B未经过Ampholine@PM均衡器材料处理共鉴定得到5个低丰度蛋白质,而经过Ampholine@PM材料处理后鉴定得到的低丰度蛋白质数量为34个,为未经处理的6.8倍。区域C未经过Ampholine@PM均衡器材料处理共鉴定得到3个低丰度蛋白质,而经过Ampholine@PM材料处理后鉴定得到的低丰度蛋白质数量为50个,为未经处理的16.7倍。经过Ampholine@PM均衡器材料处理后,3个高丰度蛋白质区域一共鉴定到148个非冗余蛋白质,其中48个为高丰度蛋白质,100个为低丰度蛋白质。与未经处理的结果对比,采用Ampholine@PM均衡器材料处理后,所富集得到的低丰度蛋白质数量提高了10倍,大幅度减少了高丰度蛋白质馏分中低丰度蛋白质的损失。
3.5 血浆样品的高丰度蛋白质去除及低丰度蛋白质富集
离线二维液相色谱在蛋白质水平进行高丰度蛋白质的大规模高效分离和去除,整个过程离线处理操作多,通量小,所需时间超过了179 h,大大降低了其在复杂样品中应用的可能性[10]。血浆样品经过在线阵列式二维色谱分离,整个过程仅需要4 h,大幅缩短了复杂样品的分离时间,实现了血浆样品的高通量快速分离,并实现了高丰度蛋白质的快速定位。分离得到的55种高丰度蛋白质馏分,经过均衡器材料处理后,一共鉴定出252种非冗余蛋白质,其中61种为高丰度蛋白质,191种为低丰度蛋白质,进一步提高了血浆蛋白质组中低丰度蛋白质的鉴定效果。其它中低丰度蛋白质馏分一共鉴定得到了1376种蛋白质,其中有25种高丰度蛋白质在高丰度蛋白质馏分中亦有存在。Ueda等[17]曾对血浆样品进行了RP-RP分离,经过24 h二维色谱分离以及12天的LC-MS分析,一共鉴定得到了1126种蛋白质。与之相比,血浆样品经过二维色谱分离及ampholine@PM均衡器材料处理后,一共鉴定得到了1474种蛋白质,蛋白质浓度动态范围达到了7种数量级,蛋白质丰度最低的蛋白质为prothrombin (1.2 ng/mL) [18]。由此可见,二维阵列式色谱进行血浆样品的分离分析,不仅可以大幅缩短分离鉴定的时间,同时也能得到更好的蛋白质鉴定效果,展现了其在复杂样品分析中巨大的应用前景。
4 结 论
综上所述,在线二维阵列式液相色谱系统可以对血浆样品进行蛋白质水平的分离,整个分离时间由179 h大幅缩短为4 h,并实现了高丰度蛋白质的快速定位。相比于高丰度蛋白质馏分直接鉴定,经蛋白质均衡器材料处理后,富集得到的低丰度蛋白质数量提高了10倍,从而大幅度减少了低丰度蛋白质的损失。将这种方法对血浆样品进行完整的分析,共鉴定到1474种蛋白质,蛋白质浓度动态范围达到了7种数量级。结果表明,血浆样品的二维阵列色谱分离可以实现高丰度蛋白质的快速定位和去除。高丰度蛋白质馏分运用蛋白质均衡器材料处理,可以实现低丰度蛋白质的富集。二维阵列式液相色谱系统展现了较高的分离通量和较强的低丰度蛋白质富集能力,从而显著提高了血浆蛋白质组的鉴定能力,可以应用于其它复杂样品的分离分析中。
References
1 Hieter P, Boguski M. Science, 1997, 278(5338): 601-602
2 Issaq H J, Xiao Z, Veenstra T D. Chem. Rev., 2007, 107(8): 3601-3620
3 Liu T, Qian W, Gritsenko M A, Xiao W, Moldawer L L, Kaushal A, Monroe M E, Varnum M A, Moore R J, Purvine S O, Maier R V, Davis R W, Tompkins R G, Camp II D G, Smith R D. Mol. Cell. Proteomics, 2006, 5(10): 1899-1913
4 Anderson N L, Anderson N G. Mol. Cell. Proteomics, 2002, 1(11): 845-867
5 ZHANG Wei. Chinese J. Anal. Chem., 2014, 42(12): 1859-1868
张 伟. 分析化学, 2014, 42(12): 1859-1868
6 Gundry R L, White M Y, Nogee J, Tchernyshyov I, van Eyk J E. Proteomics, 2009, 9(7): 2021-2028
7 Stempfer R, Kubicek M, Lang I M, Christa N, Gerner C. Electrophoresis, 2008, 29(21): 4316-4323
8 Ichibangase T, Moriya K, Koike K, Imai K. Biomed. Chromatogr., 2009, 23(5): 480-487
9 Kullolli M,Warren J, Arampatzidou M, Pitteri S J. J. Chromatogr. B, 2013, 939: 10-16
10 Gao M, Deng C, Yu W, Zhang Y, Yang P, Zhang X. Proteomics, 2008, 8(5): 939-947
11 Zhu S, Zhang X, Gao M, Hong G, Yan G, Zhang X. Proteomics, 2012, 12(23-24): 3451-3463
12 HUANG Zhi, HONG Guang-Feng, GAO Ming-Xia, ZHANG Xiang-Min. Chinese J. Chromatogr., 2014, 32(4): 343-348
黄 志, 洪广峰, 高明霞, 张祥民. 色谱, 2014, 32(4): 343-348
13 Boschetti E, Righetti P G. J. Proteomics, 2008, 71(3): 255-64
14 Righetti P G, Boschetti E, Lomas L, Citterio A. Proteomics, 2006, 6(14): 3980-3992
15 Deng N, Zhu G, Chen Y, Wu Q, Liang Z, Sui Z, Zhang L, Yang K, Zhang Y. Anal. Chim. Acta, 2014, 826: 43-50
16 Zhu G, Zhao P, Deng N, Tao D, Sun L, Liang Z, Zhang L, Zhang Y. Anal. Chem., 2012, 84(18): 7633-7637
17 Ueda K, Tatsuguchi A, Saichi N, Toyama A,Tamura K, Furihata M, Takata R, Akamatsu S, Igarashi M, Nakayama M, Sato T, Ogawa O, Fujioka T, Shuin T, Nakamura Y, Nakagawa H. J. Proteome. Res., 2013, 12(10): 4497-4506
18 Chow A, Her Z, Ong E K, Chen J M, Dimatatac F, Kwek D J, Barkham T, Yang H, Rénia L, Leo Y S, Ng L F. J. Infect. Dis., 2011, 203(2): 149-157

