基于巯基—烯烃点击化学的聚丙烯酰胺型亲水作用色谱固定相的制备
杨铎等

摘 要 采用巯基-烯烃点击反应制备了一种新型聚丙烯酰胺键合烯基修饰硅胶的亲水色谱固定相。丙烯酰胺与二硫代苯甲酸苄酯通过可逆加成-断裂链转移(RAFT)反应合成聚合物。在甲苯中,3-异氰酸酯丙基三甲氧基硅烷、丙烯胺和吡啶反应后,再与硅胶反应制备烯基修饰硅胶(EUS)。在甲醇中,以2,2-偶氮二异丁基脒盐酸盐为引发剂,被硼氢化钠还原的聚丙烯酰胺与EUS于55℃反应48 h,键合上巯基活化的聚合物。利用元素分析和红外光谱的方法对固定相TE-UPAM(Thiol-ene urea polyacy (amide))进行表征,含碳量与EUS相比有所增加,在1636和1570 cm-1处存在多重酰胺键红外特征峰。考察了流动相中水含量、盐浓度和pH值的变化对极性化合物保留时间的影响。结果表明,保留时间随水含量的增加而减小; 中性和碱性化合物保留时间随盐浓度的增大而延长,在pH 3.3~4.8范围内,碱性化合物的保留时间随pH的降低而缩短,均与酸性化合物相反。固定相TE-UPAM在亲水模式下与传统硅胶固定相比较,更好地分离了7种核苷和碱基,再通过对寡糖的分离,表明此固定相分离极性化合物的巨大潜力。
关键词 可逆加成-断裂链转移; 聚丙烯酰胺; 巯基-烯烃点击化学; 亲水作用色谱
1 引 言
亲水作用色谱(Hydrophilic interaction liquid chromatography, HILIC)作为一种分离极性化合物的液相色谱模式,最早由Alpert于1990年提出[1],主要特征是使用类似于正相色谱的极性固定相和水/有机溶剂(通常是乙腈)的流动相。HILIC固定相的键合相为亲水性的极性基团。随着HILIC的快速发展,其固定相也日益丰富。其中,一类为小分子键合相,如二醇基、氰基、氨基、酰胺、半胱氨酸、麦芽糖等[2~5]; 另一类为聚合物键合相,如聚琥珀酰亚胺型PolyHydroxyethyl A,PolyCAT A和PolySulfoethyl A等[6],聚磷酸胆碱型KS-polyMPC[7]和聚甜菜碱型[8]。目前,制备聚合物键合相主要有“从表面接枝(Grafting from)”和“接枝到(Grafting to)”两种方法。“从表面接枝”方法[9]是将反应活性种以化学键的形式接枝到基体表面,然后在表面引发单体接枝聚合。该方法中分子体积小,易扩散至基体表面发生链增长反应,键合密度高,但得到聚合物的分子量分布较宽,均匀性差。“接枝到”方法[10]是将预合成的聚合物通过具有反应活性的末基或侧基与功能化表面的化学反应接枝到基体表面。该方法可较容易地控制聚合物的分子量及其分布,键合相有较好的规整度,但由于分子体积较大,存在空间位阻效应,使键合效率较低,键合量受限。因此,需要高效反应来解决该问题。
2001年,Sharpless首次提出点击化学(Click chemistry)[11]的概念。Thiol-ene点击反应[11~13]与传统的叠氮-炔基点击反应[11,14]相比,具有无金属催化、反应效率高、操作简单、条件温和等优点。近年来,Thiol-ene在高分子化学、生物学和有机化学中的应用越来越广泛[15]。
本研究采用Thiol-ene点击化学方法,将亲水性的聚丙烯酰胺“接枝到”烯基修饰的硅胶表面,制备了一种HILIC固定相,在亲水色谱模式下进行评价和应用研究。通过可逆加成-断裂链转移(Reversible addition-fragmentation chain transfer, RAFT)反应[11]合成聚丙烯酰胺。RAFT是Rizzardo于1998年提出的一种可控活性自由基聚合方法,可以有效控制聚合物分子量及其分布。本研究中,RAFT试剂引入的硫代酯被硼氢化钠还原成巯基[15],与硅胶表面的烯基发生Thiol-ene反应,实现聚丙烯酰胺的表面键合,使RAFT与Thiol-ene很好地结合。通过元素分析和红外光谱的方法表征,采用一系列极性化合物评价色谱性能,并选用碱基、核苷和寡糖探究TE-UPAM的应用潜力。
2 实验部分
2.1 仪器与试剂
材料表征所用仪器包括Nicolet 20 DXB红外光谱仪(Madison, WI, USA),Vario EL III 元素分析仪(Elementar, Germany),Bruker DSX 300 核磁共振仪(300 MHz, 7.0 T, Karlsruhe, Germany)和Malvern Zetasizer Nano-ZS90电位测定仪(Malvern, UK)。
色谱评价所用仪器为Waters 2695高效液相色谱仪,包括四元泵、自动进样器、柱温箱、2996型光电二极管阵列检测器和2424蒸发光散射检测器,Empower色谱工作站(美国Waters公司); KQ5200DE超声仪(江苏昆山有限公司)。
实验所用试剂包括乙腈和甲醇(色谱纯,美国JTBaker公司); 甲酸和甲酸铵(分析纯,百灵威科技有限公司); 实验用水来自Milli-Q纯水净化系统(Billerica, MA, USA); 无水四氢呋喃、苯基溴化镁、二硫化碳、溴苄、丙烯酰胺、2,2-偶氮二异丁腈(Azodiisobulyronitrile, AIBN)、2,2-偶氮二异丁基脒盐酸盐(2,2′-azobis[20methylpropionamidine]dihydro chloride, AIBA)均为分析纯(上海阿拉丁试剂有限公司); 硅胶(5 μm,300 ,富士硅化学公司); 无水硫酸钠、氯化钠、硼氢化钠(分析纯,天津市科密欧化学试剂有限公司); 丙炔胺(分析纯,美国Acros公司); 3-异氰酸酯丙基三甲氧基硅烷(分析纯,上海萨恩化学技术有限公司); 正己烷、1,4-二氧六环、甲苯、吡啶、盐酸、乙醚以及核苷、寡糖等样品均为分析纯(Sigma-Aldrich公司)。
2.2 实验方法
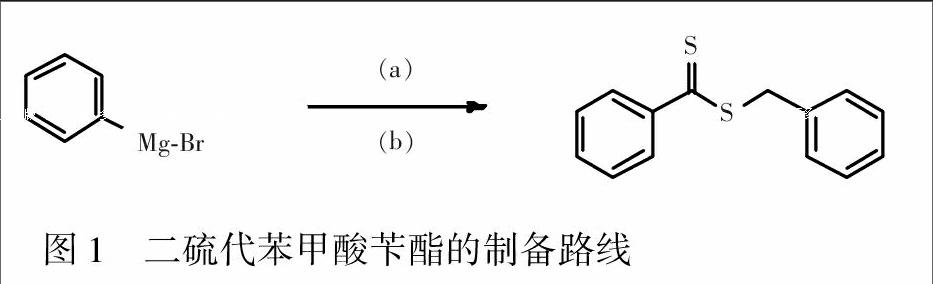
2.2.1 二硫代苯甲酸苄酯的合成 在无水无氧条件下,向200 mL无水四氢呋喃中加入163.6 mL苯基溴化镁,升温至40℃,滴加32.8 mL二硫化碳,搅拌5 min,滴加32.8 mL溴苄,升温至50℃,搅拌24 h,合成路线见图1[17]。收集产物(RAFT试剂)31.6 g,产率79%,1H NMR数据为δ 4.60(2H,s)归属于苄基上氢,δ 7.20~7.50(8H,m)为苯环邻间位氢,δ 8.02(2H,m)为苯环对位氢。
2.2.2 表面烯基修饰硅胶的合成 将3 mL 3-异氰酸酯丙基三甲氧基硅烷、2 mL丙烯胺和1 mL吡啶加入40 mL甲苯中,搅拌,氮气氛围下升温至80℃,反应12 h。加入10.4 g硅胶,升温至110℃,反应12 h即得烯基修饰硅胶(图2),命名为EUS(E-烯基,U-脲基,S-硅胶)。
2.2.3 聚丙烯酰胺的合成 丙烯酰胺单体64 g,二硫代苯甲酸苄酯4.32 g和AIBN 1.44 g加入到180 mL 1,4-二氧六环/甲醇(4∶1, V/V)中,氮气下搅拌,升温至65℃,36 h后得聚丙烯酰胺4.44 g[18]。1H NMR数据为δ 7.15~7.30(4H,m)归属于为苯环间邻位氢,7.42(H,m)为苯环对位氢,7.60~7.90为酰胺活泼氢。通过凝胶渗透色谱法(Gel-permeation chromatography, GPC)测定结果为数均分子量(Mn)为2200 g/mol, 重均分子量(Mw)为2500 g/mol,多分散性系数(Mw/Mn)为1.24。
2.2.4 固定相TE-UPAM的合成 3 g聚丙烯酰胺溶于20 mL水,氮气下搅拌,加入0.35 g NaBH4 ,升温至65℃,反应12 h[16]。调至pH 7,加入10 g EUS,0.3 g AIBA,30 mL甲醇和10 mL水,降至55℃,反应48 h,得固定相TE-UPAM(TE-thiol-ene,U-脲基,PAM-聚丙烯酰胺),见图3。
2.3 色谱柱的填装及色谱条件
色谱柱(150 mm × 4.6 mm); 装柱压力:25 MPa,匀浆液和顶替液:甲醇。
色谱条件:流动相为乙腈/水/缓冲盐的体系,缓冲盐为100 mmol/L或200 mmol/L甲酸铵,pH分别为6.2, 4.8和3.3,柱温:30℃,流速:1.0 mL/min,检测波长:270 nm。死时间使用甲醇测定,为1.70 min。
3 结果与讨论
3.1 固定相TE-UPAM的合成与表征
对EUS和TE-UPAM进行元素分析,含碳量分别为3.722%和4.378%,表明聚丙烯酰胺成功键合。按照文献\[19\]提供的方法计算,烯基键合量为1.58 μmol/m2,聚丙烯酰胺键合量为0.15 μmol/m2。
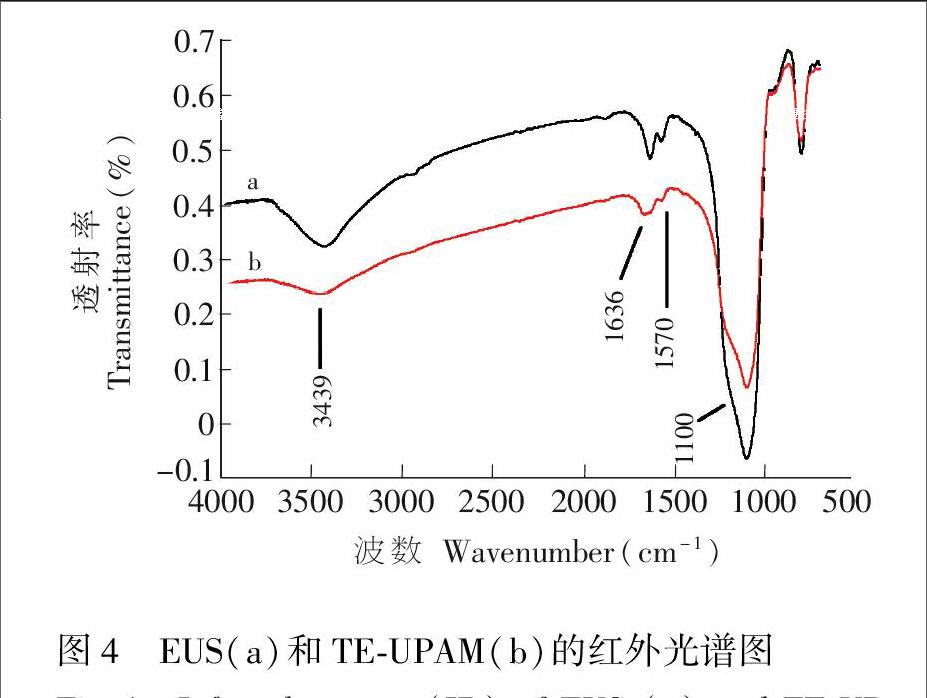
采用傅立叶变换红外光谱对EUS和TE-UPAM进行表征(图4),1100和3439 cm-1分别为SiμOμSi[20]和OμH的伸缩振动峰。在1636和1570 cm-1处存在多重酰胺键的红外特征峰,说明聚丙烯酰胺成功键合。
3.2 固定相TE-UPAM的基本色谱性能评价
3.2.1 流动相中水含量对保留行为的影响 在HILIC模式下,考察流动相中不同水含量对化合物保留行为的影响。选取尿嘧啶、尿苷、胞嘧啶、胞苷、乳清酸进行评价。图5表明,保留时间随水含量增加而缩短,这种变化趋势符合HILIC模式下色谱保留行为特征[1],故可作为HILIC固定相。
3.2.2 缓冲溶液对保留行为的影响 在HILIC模式下缓冲盐对溶质的保留行为具有显著影响,因此,一般都要使用一定浓度的缓冲溶液作为添加剂[1,21]。流动相中乙腈含量为90%,选取酸性的乳清酸和水杨酸、中性的尿苷以及碱性的普萘洛尔和胞嘧啶,考察了不同浓度的甲酸铵(5、10和15 mmol/L)对化合物保留行为的影响(图6)。尿苷保留时间随甲酸铵浓度增大而延长,这符合Alpert提出的HILIC分配机理[19],即盐浓度增大导致固定相表面“富水层”增厚,使溶质的分配增加,延长保留时间[21,22]; 碱性化合物的保留时间随甲酸铵浓度增大而增加,符合HILIC分配机理,但也与电荷排斥的保留行为类似,即碱性化合物与固定相互相排斥; 乳清酸和水杨酸的保留时间随甲酸铵浓度增大而减小,不符合HILIC分配机理,但与离子交换色谱的保留行为[22,23]类似,即酸性化合物与固定相互相吸引,因此推测固定相表面可能存在正电荷。
考察不同pH值的甲酸铵对溶质保留时间的影响。乙腈含量为90%,甲酸铵的pH分别为6.2, 4.8和3.3,浓度10 mmol/L,结果见图7。pH值对中性的尿苷保留时间影响很小,说明核苷的保留以HILIC分配作用为主[22]。pH 4.8~6.2,酸性和碱性化合物的保留时间不变,但pH 3.3~4.8,酸性化合物的保留时间随pH降低而延长,碱性化合物则相反 [24]。
通过Ζeta电位测定表面电荷情况(表1),结果表明,表面存在少量正电荷,并随pH值降低而减少,与上述推测相符。正电荷可能来自残留的吡啶[25],也可能来自少量脲基或酰胺水解生成的氨基。总之,电荷是微弱的,可以使用缓冲盐抑制。
3.3 固定相TE-UPAM在HILIC模式下的应用
选取核苷和碱基对TE-UPAM进行应用评价。核苷和碱基具有很强的亲水性,在反相色谱柱上很难保留。但与硅胶固定相比,在TE-UPAM上保留更强,分离效果更好,见图8。
进一步选用寡糖(β-1,4-低聚半乳糖[26])进行应用评价,由图9可见,分离效果很好。
4 结 论
利用Thiol-ene点击化学方法,将强亲水性的聚丙烯酰胺“接枝到”EUS表面上,制备了一种HILIC固定相TE-UPAM。聚丙烯酰胺是通过RAFT聚合和硼氢化钠还原成末端巯基活化的聚合物。EUS增加了连接臂,降低了空间位阻,提高了键合效率。元素分析和红外光谱分析表明, 聚丙烯酰胺成功键合。采用极性化合物评价,说明此固定相具有典型的HILIC保留特性; 进一步利用核苷、碱基和寡糖的应用评价表明,固定相TE-UPAM在极性化合物分离中具有较好的应用潜力。
References
1 Alpert A J. J. Chromatogr., 1990, 499: 177-196
2 SHEN Ai-Jin, GUO Zhi-Mou, LIANG Xin-Miao. Progress in Chemistry, 2014, 26(1): 10-18
沈爱金, 郭志谋, 梁鑫淼. 化学进展, 2014, 26(1): 10-18
3 Shen A J, Guo Z M, Yu L, Cao L, Liang X M. Chem. Commun., 2011, 47(15): 4550-4552
4 WANG Fu-Qiang, CHANG Su-Ping, DAI Xiao-Jun, GONG Bo-Lin. Chinese J. Anal. Chem., 2012, 40(3): 415-420
王富强, 常素萍, 戴小军, 龚波林. 分析化学, 2012, 40(3): 415-420
5 Guo Z M, Lei A W, Liang X M, Xu Q. Chem. Commun., 2006, (43): 4512-4514
6 Zhu B Y, Mant C T, Hodges R S. J. Chromatogr., 1991, 548(1-2): 13-24
7 Jiang W, Fischer G, Girmay Y, Irgum K. J. Chromatogr. A, 2006, 1127(1-2): 82-91
8 Jiang W, Irgum K. Anal. Chem., 2001, 73(9): 1993-2003
9 Prucker O, Ruhe J. Macromolecules, 1998, 31(3): 602-613
10 Yoshikawa S, Tsubokawa N. Polym. J., 1996, 28(4): 317-322
11 Kolb H C, Finn M G, Sharpless K B. Angew. Chem. Inter. Ed., 2001, 40(11): 2004-2021
12 van Dijk M, Rijkers D T S, Liskamp R M J, van Nostrum C F, Hennink W E. Bioconjugate Chem., 2009, 20(11): 2001-2016
13 Hoyle C E, Bowman C N. Angew. Chem. Inter. Ed., 2010, 49(9): 1540-1573
14 Rostovtsev V V, Green L G, Fokin V V, Sharpless K B. Angew. Chem. Inter. Ed., 2002, 41(14): 2596-2599
15 Povie G, Tran A T, Bonnaffe D, Habegger J, Hu Z Y, Le Narvor C, Renaud P. Angew. Chem. Inter. Ed., 2014, 53(15): 3894-3898
16 Lowe A B, Sumerlin B S, Donovan M S, McCormick C L. J. Am. Chem. Soc., 2002, 124(39): 11562-11563
17 ZHOU Xiao-Jing, YUAN Fu-Gen. Journal of Suzhou University of Science and Technology Natural Science, 2009, 2(26): 60-63
周晓静, 袁福根. 苏州科技学院学报, 2009, 2(26): 60-63
18 Zhang M X, Qing G Y, Xiong C L, Cui R, Pang D W, Sun T L. Adv. Mater., 2013, 25(5): 749-754
19 Kibbey C E, Meyerhoff M E. Anal. Chem., 1993, 65(17): 2189-2196
20 Yu P, Kirkpatrick R J, Poe B, McMillan P F, Cong X D. J. Am. Ceram. Soc., 1999, 82(3): 742-748
21 Hemstrom P, Irgum K. J. Sep. Sci., 2006, 29(12): 1784-1821
22 Guo Y, Gaiki S. J. Chromatogr. A, 2005, 1074(1-2): 71-80
23 Olsen B A. J. Chromatogr. A, 2001, 913(1-2): 113-122
24 Alpert A J. Anal. Chem., 2008, 80(1): 62-76
25 YAO Zi-Peng, CAI Zhi-Ming. Chemistry, 1996, 6: 53-54
姚子鹏, 蔡志明. 化学通报, 1996, 6: 53-54
26 Fu Q, Liang T, Zhang X L, Du Y G, Guo Z M, Liang X M. Carbohydr. Res., 2010, 345(18): 2690-2697



摘 要 采用巯基-烯烃点击反应制备了一种新型聚丙烯酰胺键合烯基修饰硅胶的亲水色谱固定相。丙烯酰胺与二硫代苯甲酸苄酯通过可逆加成-断裂链转移(RAFT)反应合成聚合物。在甲苯中,3-异氰酸酯丙基三甲氧基硅烷、丙烯胺和吡啶反应后,再与硅胶反应制备烯基修饰硅胶(EUS)。在甲醇中,以2,2-偶氮二异丁基脒盐酸盐为引发剂,被硼氢化钠还原的聚丙烯酰胺与EUS于55℃反应48 h,键合上巯基活化的聚合物。利用元素分析和红外光谱的方法对固定相TE-UPAM(Thiol-ene urea polyacy (amide))进行表征,含碳量与EUS相比有所增加,在1636和1570 cm-1处存在多重酰胺键红外特征峰。考察了流动相中水含量、盐浓度和pH值的变化对极性化合物保留时间的影响。结果表明,保留时间随水含量的增加而减小; 中性和碱性化合物保留时间随盐浓度的增大而延长,在pH 3.3~4.8范围内,碱性化合物的保留时间随pH的降低而缩短,均与酸性化合物相反。固定相TE-UPAM在亲水模式下与传统硅胶固定相比较,更好地分离了7种核苷和碱基,再通过对寡糖的分离,表明此固定相分离极性化合物的巨大潜力。
关键词 可逆加成-断裂链转移; 聚丙烯酰胺; 巯基-烯烃点击化学; 亲水作用色谱
1 引 言
亲水作用色谱(Hydrophilic interaction liquid chromatography, HILIC)作为一种分离极性化合物的液相色谱模式,最早由Alpert于1990年提出[1],主要特征是使用类似于正相色谱的极性固定相和水/有机溶剂(通常是乙腈)的流动相。HILIC固定相的键合相为亲水性的极性基团。随着HILIC的快速发展,其固定相也日益丰富。其中,一类为小分子键合相,如二醇基、氰基、氨基、酰胺、半胱氨酸、麦芽糖等[2~5]; 另一类为聚合物键合相,如聚琥珀酰亚胺型PolyHydroxyethyl A,PolyCAT A和PolySulfoethyl A等[6],聚磷酸胆碱型KS-polyMPC[7]和聚甜菜碱型[8]。目前,制备聚合物键合相主要有“从表面接枝(Grafting from)”和“接枝到(Grafting to)”两种方法。“从表面接枝”方法[9]是将反应活性种以化学键的形式接枝到基体表面,然后在表面引发单体接枝聚合。该方法中分子体积小,易扩散至基体表面发生链增长反应,键合密度高,但得到聚合物的分子量分布较宽,均匀性差。“接枝到”方法[10]是将预合成的聚合物通过具有反应活性的末基或侧基与功能化表面的化学反应接枝到基体表面。该方法可较容易地控制聚合物的分子量及其分布,键合相有较好的规整度,但由于分子体积较大,存在空间位阻效应,使键合效率较低,键合量受限。因此,需要高效反应来解决该问题。
2001年,Sharpless首次提出点击化学(Click chemistry)[11]的概念。Thiol-ene点击反应[11~13]与传统的叠氮-炔基点击反应[11,14]相比,具有无金属催化、反应效率高、操作简单、条件温和等优点。近年来,Thiol-ene在高分子化学、生物学和有机化学中的应用越来越广泛[15]。
本研究采用Thiol-ene点击化学方法,将亲水性的聚丙烯酰胺“接枝到”烯基修饰的硅胶表面,制备了一种HILIC固定相,在亲水色谱模式下进行评价和应用研究。通过可逆加成-断裂链转移(Reversible addition-fragmentation chain transfer, RAFT)反应[11]合成聚丙烯酰胺。RAFT是Rizzardo于1998年提出的一种可控活性自由基聚合方法,可以有效控制聚合物分子量及其分布。本研究中,RAFT试剂引入的硫代酯被硼氢化钠还原成巯基[15],与硅胶表面的烯基发生Thiol-ene反应,实现聚丙烯酰胺的表面键合,使RAFT与Thiol-ene很好地结合。通过元素分析和红外光谱的方法表征,采用一系列极性化合物评价色谱性能,并选用碱基、核苷和寡糖探究TE-UPAM的应用潜力。
2 实验部分
2.1 仪器与试剂
材料表征所用仪器包括Nicolet 20 DXB红外光谱仪(Madison, WI, USA),Vario EL III 元素分析仪(Elementar, Germany),Bruker DSX 300 核磁共振仪(300 MHz, 7.0 T, Karlsruhe, Germany)和Malvern Zetasizer Nano-ZS90电位测定仪(Malvern, UK)。
色谱评价所用仪器为Waters 2695高效液相色谱仪,包括四元泵、自动进样器、柱温箱、2996型光电二极管阵列检测器和2424蒸发光散射检测器,Empower色谱工作站(美国Waters公司); KQ5200DE超声仪(江苏昆山有限公司)。
实验所用试剂包括乙腈和甲醇(色谱纯,美国JTBaker公司); 甲酸和甲酸铵(分析纯,百灵威科技有限公司); 实验用水来自Milli-Q纯水净化系统(Billerica, MA, USA); 无水四氢呋喃、苯基溴化镁、二硫化碳、溴苄、丙烯酰胺、2,2-偶氮二异丁腈(Azodiisobulyronitrile, AIBN)、2,2-偶氮二异丁基脒盐酸盐(2,2′-azobis[20methylpropionamidine]dihydro chloride, AIBA)均为分析纯(上海阿拉丁试剂有限公司); 硅胶(5 μm,300 ,富士硅化学公司); 无水硫酸钠、氯化钠、硼氢化钠(分析纯,天津市科密欧化学试剂有限公司); 丙炔胺(分析纯,美国Acros公司); 3-异氰酸酯丙基三甲氧基硅烷(分析纯,上海萨恩化学技术有限公司); 正己烷、1,4-二氧六环、甲苯、吡啶、盐酸、乙醚以及核苷、寡糖等样品均为分析纯(Sigma-Aldrich公司)。
2.2 实验方法
2.2.1 二硫代苯甲酸苄酯的合成 在无水无氧条件下,向200 mL无水四氢呋喃中加入163.6 mL苯基溴化镁,升温至40℃,滴加32.8 mL二硫化碳,搅拌5 min,滴加32.8 mL溴苄,升温至50℃,搅拌24 h,合成路线见图1[17]。收集产物(RAFT试剂)31.6 g,产率79%,1H NMR数据为δ 4.60(2H,s)归属于苄基上氢,δ 7.20~7.50(8H,m)为苯环邻间位氢,δ 8.02(2H,m)为苯环对位氢。
2.2.2 表面烯基修饰硅胶的合成 将3 mL 3-异氰酸酯丙基三甲氧基硅烷、2 mL丙烯胺和1 mL吡啶加入40 mL甲苯中,搅拌,氮气氛围下升温至80℃,反应12 h。加入10.4 g硅胶,升温至110℃,反应12 h即得烯基修饰硅胶(图2),命名为EUS(E-烯基,U-脲基,S-硅胶)。
2.2.3 聚丙烯酰胺的合成 丙烯酰胺单体64 g,二硫代苯甲酸苄酯4.32 g和AIBN 1.44 g加入到180 mL 1,4-二氧六环/甲醇(4∶1, V/V)中,氮气下搅拌,升温至65℃,36 h后得聚丙烯酰胺4.44 g[18]。1H NMR数据为δ 7.15~7.30(4H,m)归属于为苯环间邻位氢,7.42(H,m)为苯环对位氢,7.60~7.90为酰胺活泼氢。通过凝胶渗透色谱法(Gel-permeation chromatography, GPC)测定结果为数均分子量(Mn)为2200 g/mol, 重均分子量(Mw)为2500 g/mol,多分散性系数(Mw/Mn)为1.24。
2.2.4 固定相TE-UPAM的合成 3 g聚丙烯酰胺溶于20 mL水,氮气下搅拌,加入0.35 g NaBH4 ,升温至65℃,反应12 h[16]。调至pH 7,加入10 g EUS,0.3 g AIBA,30 mL甲醇和10 mL水,降至55℃,反应48 h,得固定相TE-UPAM(TE-thiol-ene,U-脲基,PAM-聚丙烯酰胺),见图3。
2.3 色谱柱的填装及色谱条件
色谱柱(150 mm × 4.6 mm); 装柱压力:25 MPa,匀浆液和顶替液:甲醇。
色谱条件:流动相为乙腈/水/缓冲盐的体系,缓冲盐为100 mmol/L或200 mmol/L甲酸铵,pH分别为6.2, 4.8和3.3,柱温:30℃,流速:1.0 mL/min,检测波长:270 nm。死时间使用甲醇测定,为1.70 min。
3 结果与讨论
3.1 固定相TE-UPAM的合成与表征
对EUS和TE-UPAM进行元素分析,含碳量分别为3.722%和4.378%,表明聚丙烯酰胺成功键合。按照文献\[19\]提供的方法计算,烯基键合量为1.58 μmol/m2,聚丙烯酰胺键合量为0.15 μmol/m2。
采用傅立叶变换红外光谱对EUS和TE-UPAM进行表征(图4),1100和3439 cm-1分别为SiμOμSi[20]和OμH的伸缩振动峰。在1636和1570 cm-1处存在多重酰胺键的红外特征峰,说明聚丙烯酰胺成功键合。
3.2 固定相TE-UPAM的基本色谱性能评价
3.2.1 流动相中水含量对保留行为的影响 在HILIC模式下,考察流动相中不同水含量对化合物保留行为的影响。选取尿嘧啶、尿苷、胞嘧啶、胞苷、乳清酸进行评价。图5表明,保留时间随水含量增加而缩短,这种变化趋势符合HILIC模式下色谱保留行为特征[1],故可作为HILIC固定相。
3.2.2 缓冲溶液对保留行为的影响 在HILIC模式下缓冲盐对溶质的保留行为具有显著影响,因此,一般都要使用一定浓度的缓冲溶液作为添加剂[1,21]。流动相中乙腈含量为90%,选取酸性的乳清酸和水杨酸、中性的尿苷以及碱性的普萘洛尔和胞嘧啶,考察了不同浓度的甲酸铵(5、10和15 mmol/L)对化合物保留行为的影响(图6)。尿苷保留时间随甲酸铵浓度增大而延长,这符合Alpert提出的HILIC分配机理[19],即盐浓度增大导致固定相表面“富水层”增厚,使溶质的分配增加,延长保留时间[21,22]; 碱性化合物的保留时间随甲酸铵浓度增大而增加,符合HILIC分配机理,但也与电荷排斥的保留行为类似,即碱性化合物与固定相互相排斥; 乳清酸和水杨酸的保留时间随甲酸铵浓度增大而减小,不符合HILIC分配机理,但与离子交换色谱的保留行为[22,23]类似,即酸性化合物与固定相互相吸引,因此推测固定相表面可能存在正电荷。
考察不同pH值的甲酸铵对溶质保留时间的影响。乙腈含量为90%,甲酸铵的pH分别为6.2, 4.8和3.3,浓度10 mmol/L,结果见图7。pH值对中性的尿苷保留时间影响很小,说明核苷的保留以HILIC分配作用为主[22]。pH 4.8~6.2,酸性和碱性化合物的保留时间不变,但pH 3.3~4.8,酸性化合物的保留时间随pH降低而延长,碱性化合物则相反 [24]。
通过Ζeta电位测定表面电荷情况(表1),结果表明,表面存在少量正电荷,并随pH值降低而减少,与上述推测相符。正电荷可能来自残留的吡啶[25],也可能来自少量脲基或酰胺水解生成的氨基。总之,电荷是微弱的,可以使用缓冲盐抑制。
3.3 固定相TE-UPAM在HILIC模式下的应用
选取核苷和碱基对TE-UPAM进行应用评价。核苷和碱基具有很强的亲水性,在反相色谱柱上很难保留。但与硅胶固定相比,在TE-UPAM上保留更强,分离效果更好,见图8。
进一步选用寡糖(β-1,4-低聚半乳糖[26])进行应用评价,由图9可见,分离效果很好。
4 结 论
利用Thiol-ene点击化学方法,将强亲水性的聚丙烯酰胺“接枝到”EUS表面上,制备了一种HILIC固定相TE-UPAM。聚丙烯酰胺是通过RAFT聚合和硼氢化钠还原成末端巯基活化的聚合物。EUS增加了连接臂,降低了空间位阻,提高了键合效率。元素分析和红外光谱分析表明, 聚丙烯酰胺成功键合。采用极性化合物评价,说明此固定相具有典型的HILIC保留特性; 进一步利用核苷、碱基和寡糖的应用评价表明,固定相TE-UPAM在极性化合物分离中具有较好的应用潜力。
References
1 Alpert A J. J. Chromatogr., 1990, 499: 177-196
2 SHEN Ai-Jin, GUO Zhi-Mou, LIANG Xin-Miao. Progress in Chemistry, 2014, 26(1): 10-18
沈爱金, 郭志谋, 梁鑫淼. 化学进展, 2014, 26(1): 10-18
3 Shen A J, Guo Z M, Yu L, Cao L, Liang X M. Chem. Commun., 2011, 47(15): 4550-4552
4 WANG Fu-Qiang, CHANG Su-Ping, DAI Xiao-Jun, GONG Bo-Lin. Chinese J. Anal. Chem., 2012, 40(3): 415-420
王富强, 常素萍, 戴小军, 龚波林. 分析化学, 2012, 40(3): 415-420
5 Guo Z M, Lei A W, Liang X M, Xu Q. Chem. Commun., 2006, (43): 4512-4514
6 Zhu B Y, Mant C T, Hodges R S. J. Chromatogr., 1991, 548(1-2): 13-24
7 Jiang W, Fischer G, Girmay Y, Irgum K. J. Chromatogr. A, 2006, 1127(1-2): 82-91
8 Jiang W, Irgum K. Anal. Chem., 2001, 73(9): 1993-2003
9 Prucker O, Ruhe J. Macromolecules, 1998, 31(3): 602-613
10 Yoshikawa S, Tsubokawa N. Polym. J., 1996, 28(4): 317-322
11 Kolb H C, Finn M G, Sharpless K B. Angew. Chem. Inter. Ed., 2001, 40(11): 2004-2021
12 van Dijk M, Rijkers D T S, Liskamp R M J, van Nostrum C F, Hennink W E. Bioconjugate Chem., 2009, 20(11): 2001-2016
13 Hoyle C E, Bowman C N. Angew. Chem. Inter. Ed., 2010, 49(9): 1540-1573
14 Rostovtsev V V, Green L G, Fokin V V, Sharpless K B. Angew. Chem. Inter. Ed., 2002, 41(14): 2596-2599
15 Povie G, Tran A T, Bonnaffe D, Habegger J, Hu Z Y, Le Narvor C, Renaud P. Angew. Chem. Inter. Ed., 2014, 53(15): 3894-3898
16 Lowe A B, Sumerlin B S, Donovan M S, McCormick C L. J. Am. Chem. Soc., 2002, 124(39): 11562-11563
17 ZHOU Xiao-Jing, YUAN Fu-Gen. Journal of Suzhou University of Science and Technology Natural Science, 2009, 2(26): 60-63
周晓静, 袁福根. 苏州科技学院学报, 2009, 2(26): 60-63
18 Zhang M X, Qing G Y, Xiong C L, Cui R, Pang D W, Sun T L. Adv. Mater., 2013, 25(5): 749-754
19 Kibbey C E, Meyerhoff M E. Anal. Chem., 1993, 65(17): 2189-2196
20 Yu P, Kirkpatrick R J, Poe B, McMillan P F, Cong X D. J. Am. Ceram. Soc., 1999, 82(3): 742-748
21 Hemstrom P, Irgum K. J. Sep. Sci., 2006, 29(12): 1784-1821
22 Guo Y, Gaiki S. J. Chromatogr. A, 2005, 1074(1-2): 71-80
23 Olsen B A. J. Chromatogr. A, 2001, 913(1-2): 113-122
24 Alpert A J. Anal. Chem., 2008, 80(1): 62-76
25 YAO Zi-Peng, CAI Zhi-Ming. Chemistry, 1996, 6: 53-54
姚子鹏, 蔡志明. 化学通报, 1996, 6: 53-54
26 Fu Q, Liang T, Zhang X L, Du Y G, Guo Z M, Liang X M. Carbohydr. Res., 2010, 345(18): 2690-2697

