有机溶剂辅助封闭式电喷雾离子源的设计及其在痕量蛋白质组样品分析中的应用
朱旭东等
摘 要 将康达效应应用于电喷雾离子源,设计了气氛可调康达效应电喷雾离子源(Coanda effect electrospray ionization source, CEESI)。考察了不同饱和蒸气压、不同极性的有机溶剂对标准肽段在质谱上信号响应的影响。结果表明,辅助气中添加乙醇后,标准肽段质谱信号提高约1000倍,而且对于1 ng BSA酶解产物,蛋白序列覆盖率提高约10%。在最佳条件下,采用nano-HPLC-CEESI-LTQ XL MS系统,实现了6, 10, 20和50 ng HeLa细胞全提蛋白质酶解产物的定性分析,与常用的开放式nano-ESI相比,肽段和蛋白质的可鉴定数目分别提高20%~360%和20%~200%。本研究表明,采用CEESI源有利于痕量蛋白质组样品的高灵敏度分析。
关键词 康达效应; 电喷雾离子源; 蛋白质组; 痕量分析
1 引 言
高效液相色谱-电喷雾离子化质谱(HPLC-ESI MS)技术已被广泛应用于蛋白质组样品分析[1,2]。由于蛋白质组样品具有组成复杂、蛋白含量动态范围宽、物理化学性质各异等特点,因此对分析方法的灵敏度提出了越来越高的要求。提高ESI过程的离子化效率、降低离子间相互抑制作用已成为一种有效途径[3]。众所周知,当HPLC的流速降低至纳升级时,电喷雾可产生更小的雾滴,离子化效率得到明显改善[4],同时离子抑制和基质效应也会被显著抑制[5,6]。因此,纳喷离子源已被广泛应用于蛋白质组学样品分析[1,2]。
在改善检测灵敏度的前提下,提高ESI源的喷雾稳定性也至关重要。目前,最常用的开放式纳喷离子源容易受到外界环境的影响,会出现喷雾不稳定的情况[7]。然而,封闭式电喷雾离子源[8]在喷针和质谱采样锥之间的空腔形成低压,可获得稳定喷雾; 同时通过增加辅助气,如空气或氮气,可改善离子传输效率。根据文献报道[9~12],辅助气中添加气化的有机溶剂可以显著改变肽段电荷分布,并提高肽段离子化效率。Li等[9]在辅助气中添加醇类或羧酸类蒸汽,可将肽段的MS信号增强3~4倍,鉴定的大肠杆菌蛋白质数目增加14%。Asperger等[12]发现,辅助气中添加乙腈可提高糖肽电荷数,使其在电子转移解离(Electrontransfer dissociation,ETD)中获得更高的碎裂效率。此外,有机溶剂添加的辅助气还可以降低基质干扰。de Muth等[13]发现,有机溶剂添加的辅助气,尤其是乙腈,可以有效降低金属离子干扰。上述研究表明,气氛辅助封闭式纳喷离子源在获得稳定喷雾、高效离子化的同时,还可以提高质谱响应,因此有望用于痕量蛋白质组样品的高灵敏度分析。
康达效应亦称附壁作用,即流体(水流或气流)有离开本来的流动方向,改为随着凸出物体流动的倾向。结合康达效应,本研究设计了新型CEESI源,评价了不同辅助气气氛对标准肽段的质谱信号强度的影响; 在最佳辅助气类型和分压条件下,实现了痕量HeLa细胞蛋白质组的定性分析。同时与开放式nano-ESI源进行了比较,结果表明,采用新型CEESI可将肽段和蛋白质鉴定数目分别提高20%~360%和20%~200%。
2 实验部分
2.1 仪器与试剂
毛细管高效液相色谱-电喷雾-线性离子阱质谱仪(美国Thermo Fisher公司); 康达效应电喷雾离子源(浙江好创生物技术有限公司); Milli-Q超纯水系统(美国Millipore公司)。
磷酸化标准肽段(序列:STSSDQPSpYSLE,上海强耀生物科技有限公司); 甲酸(FA)、二硫苏糖醇(Dithiothreitol,DTT)、碘代乙酰胺(Iodoacetamide,IAA)、牛血清白蛋白(BSA)、尿素、NH4HCO3(美国Sigma公司); 乙腈(ACN,德国Merck公司); 乙醇、甲醇、乙酸、二甲基亚砜(DMSO)、异丙醇、丙酮、乙二醇、乙二胺、乙酸乙酯和环己烷等(天津科密欧公司); 蛋白酶抑制剂(瑞士Roche公司); C18反相填料(10 孔径,5 μm粒径, 天津博纳艾杰尔科技有限公司); 石英毛细管(美国Polymicro Technologies公司)。实验用水为超纯水(18.2 MΩ cm)
2.2 样品制备
2.2.1 HeLa细胞培养及蛋白质提取 在37℃、5% CO2条件下,用含有10%胎牛血清的DMEM培养基培养HeLa细胞。当细胞的融合度达到90%时,收集并用冷的PBS洗涤3次。将HeLa细胞沉淀分散于裂解液(1%蛋白酶抑制剂的8 mol/L尿素溶液),在冰浴中超声破碎240 s(超声10 s,间歇10 s),在4℃, 20000 r/min高速离心10 min, 去除细胞碎片,收集上清液。最后用基于BCA法的试剂盒(上海碧云天生物技术有限公司)测定蛋白质浓度。
2.2.2 BSA及HeLa蛋白质样品处理 蛋白质酶解:取1 mg蛋白质(HeLa细胞提取蛋白或BSA)溶于100 μL 8 mol/L尿素中,加入8 μL 100 mmol/L DTT,56℃反应2 h; 冷却至室温,加入8 μL 200 mmol/L IAA,避光反应40 min; 用50 mmol/L NH4HCO3将溶液稀释10倍后,加入胰蛋白酶(酶与底物的质量比为1∶25); 37℃酶解24 h,加入甲酸终止反应。
除盐:使用HPLC的流动相A(98% H2O + 2% ACN + 0.1% FA)将酶解液上样至C18反相色谱柱(10 mm×4.6 mm),冲洗5 min后,用80% 的流动相B(98% ACN+2% H2O + 0.1% FA)进行洗脱。收集洗脱液,冷冻干燥后,保存于-80℃待用。
2.3 质谱及电喷雾离子源分析条件
2.3.1 考察不同溶剂、辅助气对标准肽段质谱响应信号的影响 负离子模式下,使用进样针直接进样(1 μg/mL)。改变标准肽段溶剂、辅助气中有机添加剂的种类及比例,每种条件均直接采集1 min,对比不同条件下标准肽段离子峰强度。
2.3.2 BSA及HeLa蛋白酶解产物的分离和鉴定 采用nano-HPLC-ESI-MS/MS分离分析酶解产物,色谱柱: C18反相色谱柱(50 μm×15 cm),末端为拉制喷针,可直接插入封闭式电喷雾离子源,如图1所示。液相色谱分离采用梯度洗脱方式,BSA酶解产物:0~5 min,2%~6% B; 5~35 min,6%~35% B; HeLa细胞蛋白质酶解产物:0~75 min,5%~25% B; 75~90 min,25%~80% B。流速均为120 nL/min。
分别考察空气和乙醇两种气氛下的质谱鉴定信号。质谱扫描范围为m/z 300~1800,正离子模式采集,归一化碰撞能量为35%。质谱采集产生的原始文件通过pXtract[14]转换为.mgf文件后,使用Mascot(2.4.0版本,英国MatrixScience)搜索引擎对Swiss-Prot数据库中序列进行检索。参数设置为:母离子质量容差2 Da; 碎片离子质量容差1 Da; 蛋白水解酶:Trypsin; 最多允许2个漏切位点; 固定修饰: carbamidomethyl (C); 可变修饰:oxidation (M)和acetyl (protein N-term)。
3 结果与讨论
3.1 离子源设计
结合康达效应,设计了CEESI源(图1)。特殊设计的离子传输管的内表面具有康达效应功能,气流会沿着管壁旋转向质谱方向流动,旋转的气流将带电液滴在离子传输管的中心流向质谱仪,降低了液滴与管壁的碰撞几率,从而提高离子传输效率。
辅助气流进入低压空腔后,绕轴线旋转,形成以发射针为轴的三维轴对称回转体。此结构可以简化为二维流动进行模拟(图2)。在回转体内可形成气流稳定均匀的区域,即流场驻点。
将色谱柱末端的喷针直接插入电喷雾离子源内的驻点位置,在电场驱动下,即可形成特别稳定泰勒锥,进而获得稳定喷雾。此外,由于质谱内的高真空,喷针与质谱采样锥之间的空腔处于低压,流动的辅助气可带走泰勒锥形成的雾滴,清洁喷针表面,有效防止结碳,有助于延长喷针使用寿命。雾滴在密闭腔内不断蒸发,当达到瑞利极限时,即发生库仑爆炸。分析物基于荷电残余模型、离子蒸发模型及链弹射模型等机理[15]实现离子化。进入腔体的辅助气,即被有机溶剂饱和的空气,可有效避免空气中污染物的进入,降低干扰离子的信号。在辅助气和雾滴的作用下,分析物离子化效率显著提高,有助于实现肽段的高灵敏度检测。
3.2 辅助气气氛对标准肽段质谱检测信号的影响
辅助气作为CEESI源的重要组成部分,可以促进喷雾稳定性、改善离子传输效率,而且辅助气中添加气化的有机溶剂可以显著改变肽段电荷分布,提高肽段离子化效率[9,10]。因而首先考察了不同辅助气对肽段的质谱信号强度及电荷分布的影响(图3)。
在负离子模式下,酸可明显抑制负离子生成。蒸气压较低的有机试剂(如DMSO、乙二醇)由于进入离子化室较少,对信号强度基本无影响。而饱和蒸气压较大的乙腈、乙醇、甲醇、丙酮、乙酸乙酯等极性分子可明显提高多肽离子化效率。此结果与冷却焓理论一致[16,17],即高浓度的极性分子冷凝在雾滴表面的同时,释放一定的能量; 此能量被雾滴表面的分析物分子吸收,最终激发分析物离子化[15]。但在研究的辅助气气氛中,乙醇、丙酮、乙酸乙酯及乙二胺等都能显著提高标准肽段的信号强度; 与空气为辅助气相比,信号强度可以提高1000倍。相比之下,乙醇可更明显提高多价离子响应,有利于多肽质谱鉴定,因此,采用乙醇作为辅助气进行后续实验。
3.3 痕量BSA酶解产物分析
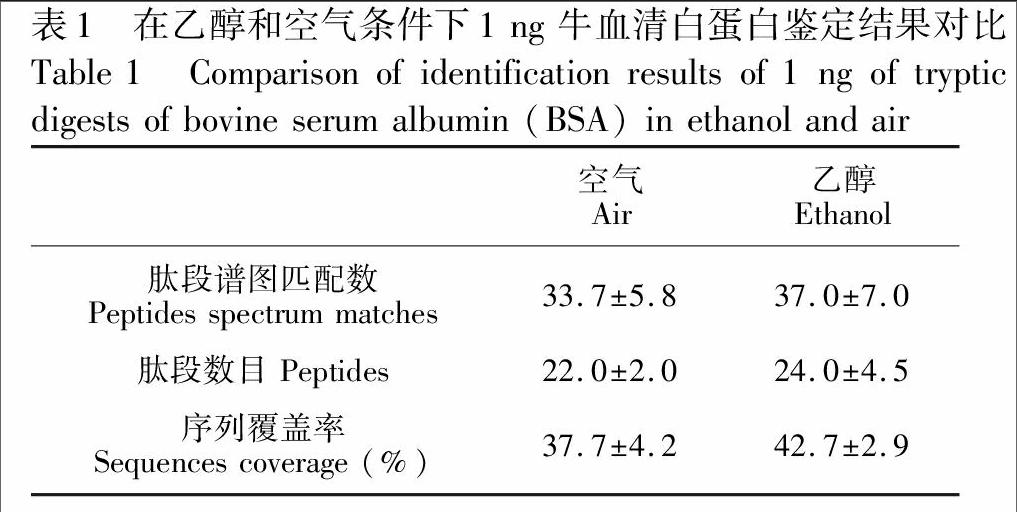
基于nano-RPLC-ESI-MS/MS系统,对1 ng BSA酶解产物进行分离分析。辅助气中添加乙醇后,在CEESI空腔内,乙醇与雾滴在离子传输管内相互作用,肽段谱图匹配(PSM)、肽段数目、序列覆盖率均提高约10%(表1)。比较肽段的峰面积发现,添加乙醇的辅助气提高了大部分肽段的质谱响应,与文献\[16\]结果相似。但是并未观察到标准肽段信号的改善,这可能是因为高浓度乙醇辅助气会抑制流动相挥发。
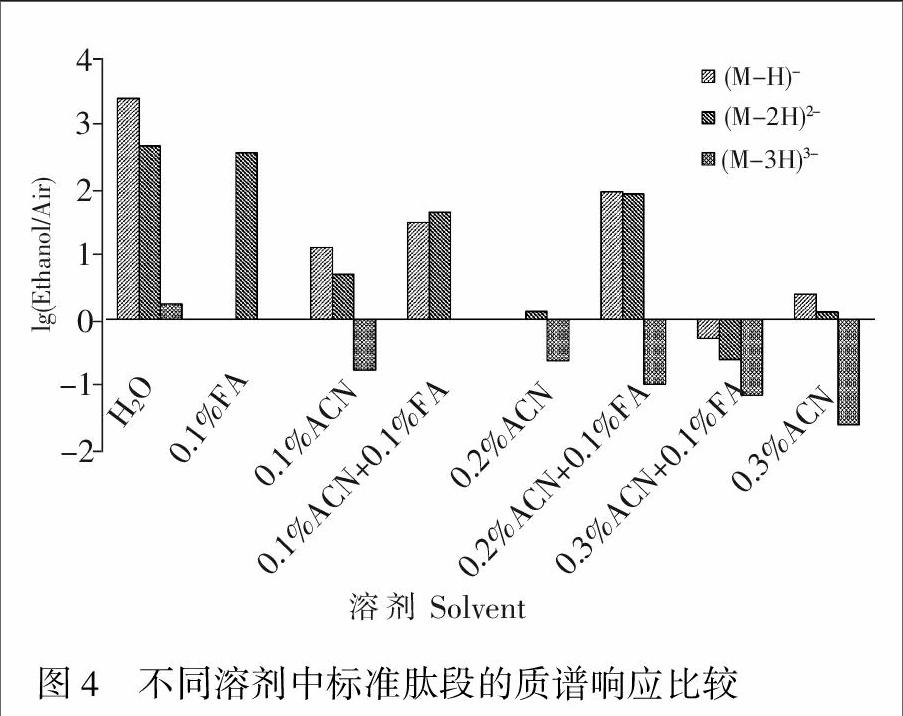
由于高浓度乙醇气氛会抑制雾滴中有机溶剂挥发,不同样品溶剂对标准肽段灵敏度有较大的影响。在相同的乙醇分压下,纯水为溶剂时信号改善效果最显著(图4); 溶剂中仅加入乙腈时,随着溶剂中乙腈加入量增大,信号改善效果变差,甚至降低肽段的质谱响应; 加入0.1% FA,获得更显著的改善效果。然而,随着有机相比例增大,会抑制乙醇对标肽质谱响应的改善效果。以上结果说明,乙醇分压太高会抑制有机溶剂的挥发,不利于样品离子化,因而实际应用时,应选择辅助气中的有机添加剂的最佳分压。
采用LC-ESI-MS/MS分析痕量BSA酶解产物时,多肽的色谱峰主要分布于有机相为10%~35%的条件下,即仅在有机相浓度较低时,出峰的肽段信号得到改善,进一步证实了高浓度乙醇气氛会抑制雾滴溶剂挥发。当乙醇分压下降时,抑制效果减弱,质谱响应显著增强。
3.4 痕量HeLa细胞提取蛋白酶解产物分析
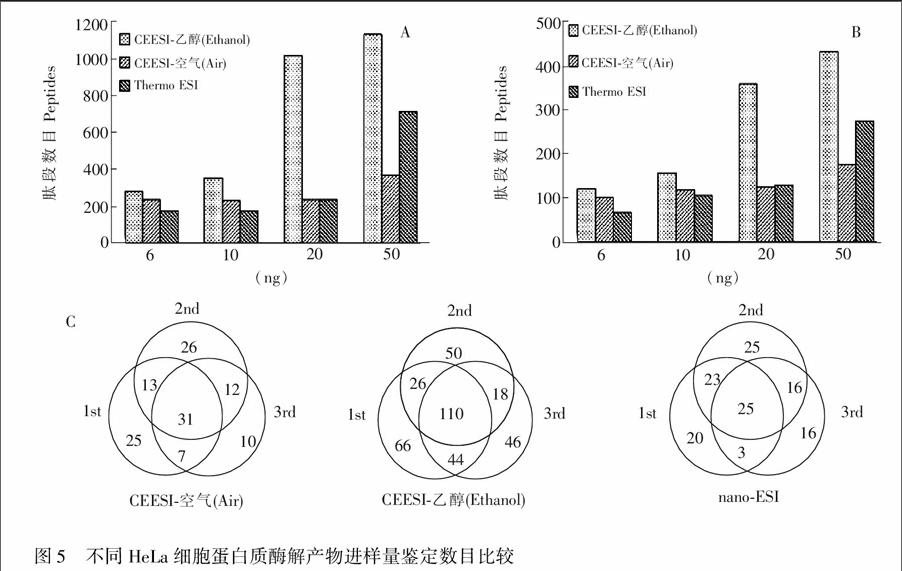
在最佳分压的乙醇气氛中,肽段和蛋白鉴定数目明显增多。当HeLa酶解产物的上样量为6 ng和10 ng时,乙醇气氛下肽段和蛋白鉴定数目较空气气氛约提高了20%; 当上样量为20 ng时,多肽和蛋白鉴定数目分别提高360%和200%(图5)。此结果进一步证实乙醇气氛可以提高分析物离子化效率,促进多肽质谱响应。当进样量增大到50 ng时,乙醇气氛下肽段和蛋白鉴定数目较空气气氛分别提高280%和158%; 相对20 ng进样量的鉴定结果提高较少。因而,气氛辅助CEESI源更适于痕量蛋白质组样品的分析。
与开放式离子源比较, CEESI特殊设计的离子传输管的内表面具有康达效应功能,可改善离子传输效率。同时,结合辅助气添加剂与喷雾的相互作用,促进肽段离子化。在考察的上样量范围内,采用CEESI源可将鉴定的肽段和蛋白数目分别提高58%~320%和50%~180%。
采用空气作为辅助气,当样品量较小(小于20ng)时,CEESI鉴定的肽段和蛋白数目较开放式nano-ESI分别提高30%和12%。但是随着样品量增加,采用开放式nano-ESI可以获得更多的肽段和蛋白鉴定数目。这可能是因为上样量较小时,空气气氛下的封闭式离子源具有更高的离子传输效率,因而可以比开放源鉴定更多的肽段和蛋白数目。当样品量增大时,高效离子化产生更多的离子,但是受离子传输管离子传输效率的限制,进入质量分析器的肽段离子受限,因此开放源具有更显著的优势。
乙醇气氛不仅改善离子传输效率、促进多肽离子化,而且可以改善喷雾稳定性。以上样量20 ng为例(图5C),空气气氛封闭式离子源、乙醇气氛封闭式离子源和开放式离子源三针共同鉴定到的蛋白质比例分别是25.0%, 30.6%和19.5%,证实CEESI源比开放纳喷源具有更好的喷雾稳定性。
4 结 论
针对开放式电喷雾离子源喷雾稳定性差、离子化效率低及喷针寿命短等问题,设计了气氛可调CEESI源。通过考察具有不同饱和蒸气压的有机小分子作为辅助气对电喷雾效果的影响,发现乙醇能够显著提高标准肽段信号强度。在最佳的乙醇分压下,不仅HeLa细胞提取蛋白质酶解产物的肽段和蛋白鉴定数目显著提高,而且喷雾稳定性得到了改善。上述结果初步说明,CEESI源在痕量蛋白质组样品分析方面具有很大的应用潜力。
References
1 WANG Chun-Min, LIU Qiang, LI Jian, XU Bo, MI Kai, CHENG Juan. Chinese J. Anal. Chem., 2014, 42(9): 1326-1331
王春民, 刘 强, 李 建, 徐 波, 米 凯, 程 娟. 分析化学, 2014, 42(9): 1326-1331
2 WANG Gui-Ming, SHI Dong-Dong, PENG Zhang-Xiao, LU Yang-Fang, GU Xue, WANG Yan, YAN Chao. Chinese J. Anal. Chem., 2015, 43(5): 682-688
王桂明, 史栋栋, 彭章晓, 鲁阳芳, 谷 雪, 王 彦, 闫 超. 分析化学, 2015, 43(5): 682-688
3 Luo Q, Rejtar T, Wu S L, Karger B L. J. Chromatogr. A, 2009, 1216(8): 1223-1231
4 Wilm M, Mann M. Anal. Chem., 1996, 68(1): 1-8
5 Okudaira M, Inoue A, Shuto A, Nakanaga K, Kano K, Makide K, Saigusa D, Tomioka Y, Aoki J. J. Lipid Res., 2014, 55(10): 2178-2192
6 El-Faramawy A, Siu K W M, Thomson B A. J. Am. Soc. Mass Spectrom., 2005, 16(10): 1702-1707
7 Nirmala R R, Nilgun C S, Griff H W. 58th ASMS Conference on Mass Spectrometry and Allied Topics, Salt Lake City, UT, 2010
8 Ramanathan R N R, Comezoglu S N, Humphreys W G. Int. J. Mass Spectrom., 2011, 301(3): 127-135
9 Li Z, Li L. Anal. Chem., 2014, 86(1): 331-335
10 Kharlamova A, McLuckey S A. Anal. Chem., 2011, 83(1): 431-437
11 Kharlamova A, Prentice B M, Huang T Y, McLuckey S A. Anal. Chem., 2010, 82(17): 7422-7429
12 Asperger A, Marx K, Albers C, Molin L, Pinato O. J. Proteome Res., 2015, 14(6): 2633-2641
13 de Muth J C, McLuckey S A. Anal. Chem., 2015, 87(2): 1210-1218
14 Wang L H, Li D Q, Fu Y. Rapid Commun. Mass Spectrom., 2007, 21(18): 2985-2991
15 Konermann L, Ahadi E, Rodriguez A D, Vahidi S. Anal. Chem., 2013, 85(1): 2-9
16 Samalikova M, Grandori R. J. Am. Chem. Soc., 2003, 125(44): 13352-13353
17 Iavarone A. T, Williams E R. J. Am. Chem. Soc., 2003, 125(8): 2319-2327



摘 要 将康达效应应用于电喷雾离子源,设计了气氛可调康达效应电喷雾离子源(Coanda effect electrospray ionization source, CEESI)。考察了不同饱和蒸气压、不同极性的有机溶剂对标准肽段在质谱上信号响应的影响。结果表明,辅助气中添加乙醇后,标准肽段质谱信号提高约1000倍,而且对于1 ng BSA酶解产物,蛋白序列覆盖率提高约10%。在最佳条件下,采用nano-HPLC-CEESI-LTQ XL MS系统,实现了6, 10, 20和50 ng HeLa细胞全提蛋白质酶解产物的定性分析,与常用的开放式nano-ESI相比,肽段和蛋白质的可鉴定数目分别提高20%~360%和20%~200%。本研究表明,采用CEESI源有利于痕量蛋白质组样品的高灵敏度分析。
关键词 康达效应; 电喷雾离子源; 蛋白质组; 痕量分析
1 引 言
高效液相色谱-电喷雾离子化质谱(HPLC-ESI MS)技术已被广泛应用于蛋白质组样品分析[1,2]。由于蛋白质组样品具有组成复杂、蛋白含量动态范围宽、物理化学性质各异等特点,因此对分析方法的灵敏度提出了越来越高的要求。提高ESI过程的离子化效率、降低离子间相互抑制作用已成为一种有效途径[3]。众所周知,当HPLC的流速降低至纳升级时,电喷雾可产生更小的雾滴,离子化效率得到明显改善[4],同时离子抑制和基质效应也会被显著抑制[5,6]。因此,纳喷离子源已被广泛应用于蛋白质组学样品分析[1,2]。
在改善检测灵敏度的前提下,提高ESI源的喷雾稳定性也至关重要。目前,最常用的开放式纳喷离子源容易受到外界环境的影响,会出现喷雾不稳定的情况[7]。然而,封闭式电喷雾离子源[8]在喷针和质谱采样锥之间的空腔形成低压,可获得稳定喷雾; 同时通过增加辅助气,如空气或氮气,可改善离子传输效率。根据文献报道[9~12],辅助气中添加气化的有机溶剂可以显著改变肽段电荷分布,并提高肽段离子化效率。Li等[9]在辅助气中添加醇类或羧酸类蒸汽,可将肽段的MS信号增强3~4倍,鉴定的大肠杆菌蛋白质数目增加14%。Asperger等[12]发现,辅助气中添加乙腈可提高糖肽电荷数,使其在电子转移解离(Electrontransfer dissociation,ETD)中获得更高的碎裂效率。此外,有机溶剂添加的辅助气还可以降低基质干扰。de Muth等[13]发现,有机溶剂添加的辅助气,尤其是乙腈,可以有效降低金属离子干扰。上述研究表明,气氛辅助封闭式纳喷离子源在获得稳定喷雾、高效离子化的同时,还可以提高质谱响应,因此有望用于痕量蛋白质组样品的高灵敏度分析。
康达效应亦称附壁作用,即流体(水流或气流)有离开本来的流动方向,改为随着凸出物体流动的倾向。结合康达效应,本研究设计了新型CEESI源,评价了不同辅助气气氛对标准肽段的质谱信号强度的影响; 在最佳辅助气类型和分压条件下,实现了痕量HeLa细胞蛋白质组的定性分析。同时与开放式nano-ESI源进行了比较,结果表明,采用新型CEESI可将肽段和蛋白质鉴定数目分别提高20%~360%和20%~200%。
2 实验部分
2.1 仪器与试剂
毛细管高效液相色谱-电喷雾-线性离子阱质谱仪(美国Thermo Fisher公司); 康达效应电喷雾离子源(浙江好创生物技术有限公司); Milli-Q超纯水系统(美国Millipore公司)。
磷酸化标准肽段(序列:STSSDQPSpYSLE,上海强耀生物科技有限公司); 甲酸(FA)、二硫苏糖醇(Dithiothreitol,DTT)、碘代乙酰胺(Iodoacetamide,IAA)、牛血清白蛋白(BSA)、尿素、NH4HCO3(美国Sigma公司); 乙腈(ACN,德国Merck公司); 乙醇、甲醇、乙酸、二甲基亚砜(DMSO)、异丙醇、丙酮、乙二醇、乙二胺、乙酸乙酯和环己烷等(天津科密欧公司); 蛋白酶抑制剂(瑞士Roche公司); C18反相填料(10 孔径,5 μm粒径, 天津博纳艾杰尔科技有限公司); 石英毛细管(美国Polymicro Technologies公司)。实验用水为超纯水(18.2 MΩ cm)
2.2 样品制备
2.2.1 HeLa细胞培养及蛋白质提取 在37℃、5% CO2条件下,用含有10%胎牛血清的DMEM培养基培养HeLa细胞。当细胞的融合度达到90%时,收集并用冷的PBS洗涤3次。将HeLa细胞沉淀分散于裂解液(1%蛋白酶抑制剂的8 mol/L尿素溶液),在冰浴中超声破碎240 s(超声10 s,间歇10 s),在4℃, 20000 r/min高速离心10 min, 去除细胞碎片,收集上清液。最后用基于BCA法的试剂盒(上海碧云天生物技术有限公司)测定蛋白质浓度。
2.2.2 BSA及HeLa蛋白质样品处理 蛋白质酶解:取1 mg蛋白质(HeLa细胞提取蛋白或BSA)溶于100 μL 8 mol/L尿素中,加入8 μL 100 mmol/L DTT,56℃反应2 h; 冷却至室温,加入8 μL 200 mmol/L IAA,避光反应40 min; 用50 mmol/L NH4HCO3将溶液稀释10倍后,加入胰蛋白酶(酶与底物的质量比为1∶25); 37℃酶解24 h,加入甲酸终止反应。
除盐:使用HPLC的流动相A(98% H2O + 2% ACN + 0.1% FA)将酶解液上样至C18反相色谱柱(10 mm×4.6 mm),冲洗5 min后,用80% 的流动相B(98% ACN+2% H2O + 0.1% FA)进行洗脱。收集洗脱液,冷冻干燥后,保存于-80℃待用。
2.3 质谱及电喷雾离子源分析条件
2.3.1 考察不同溶剂、辅助气对标准肽段质谱响应信号的影响 负离子模式下,使用进样针直接进样(1 μg/mL)。改变标准肽段溶剂、辅助气中有机添加剂的种类及比例,每种条件均直接采集1 min,对比不同条件下标准肽段离子峰强度。
2.3.2 BSA及HeLa蛋白酶解产物的分离和鉴定 采用nano-HPLC-ESI-MS/MS分离分析酶解产物,色谱柱: C18反相色谱柱(50 μm×15 cm),末端为拉制喷针,可直接插入封闭式电喷雾离子源,如图1所示。液相色谱分离采用梯度洗脱方式,BSA酶解产物:0~5 min,2%~6% B; 5~35 min,6%~35% B; HeLa细胞蛋白质酶解产物:0~75 min,5%~25% B; 75~90 min,25%~80% B。流速均为120 nL/min。
分别考察空气和乙醇两种气氛下的质谱鉴定信号。质谱扫描范围为m/z 300~1800,正离子模式采集,归一化碰撞能量为35%。质谱采集产生的原始文件通过pXtract[14]转换为.mgf文件后,使用Mascot(2.4.0版本,英国MatrixScience)搜索引擎对Swiss-Prot数据库中序列进行检索。参数设置为:母离子质量容差2 Da; 碎片离子质量容差1 Da; 蛋白水解酶:Trypsin; 最多允许2个漏切位点; 固定修饰: carbamidomethyl (C); 可变修饰:oxidation (M)和acetyl (protein N-term)。
3 结果与讨论
3.1 离子源设计
结合康达效应,设计了CEESI源(图1)。特殊设计的离子传输管的内表面具有康达效应功能,气流会沿着管壁旋转向质谱方向流动,旋转的气流将带电液滴在离子传输管的中心流向质谱仪,降低了液滴与管壁的碰撞几率,从而提高离子传输效率。
辅助气流进入低压空腔后,绕轴线旋转,形成以发射针为轴的三维轴对称回转体。此结构可以简化为二维流动进行模拟(图2)。在回转体内可形成气流稳定均匀的区域,即流场驻点。
将色谱柱末端的喷针直接插入电喷雾离子源内的驻点位置,在电场驱动下,即可形成特别稳定泰勒锥,进而获得稳定喷雾。此外,由于质谱内的高真空,喷针与质谱采样锥之间的空腔处于低压,流动的辅助气可带走泰勒锥形成的雾滴,清洁喷针表面,有效防止结碳,有助于延长喷针使用寿命。雾滴在密闭腔内不断蒸发,当达到瑞利极限时,即发生库仑爆炸。分析物基于荷电残余模型、离子蒸发模型及链弹射模型等机理[15]实现离子化。进入腔体的辅助气,即被有机溶剂饱和的空气,可有效避免空气中污染物的进入,降低干扰离子的信号。在辅助气和雾滴的作用下,分析物离子化效率显著提高,有助于实现肽段的高灵敏度检测。
3.2 辅助气气氛对标准肽段质谱检测信号的影响
辅助气作为CEESI源的重要组成部分,可以促进喷雾稳定性、改善离子传输效率,而且辅助气中添加气化的有机溶剂可以显著改变肽段电荷分布,提高肽段离子化效率[9,10]。因而首先考察了不同辅助气对肽段的质谱信号强度及电荷分布的影响(图3)。
在负离子模式下,酸可明显抑制负离子生成。蒸气压较低的有机试剂(如DMSO、乙二醇)由于进入离子化室较少,对信号强度基本无影响。而饱和蒸气压较大的乙腈、乙醇、甲醇、丙酮、乙酸乙酯等极性分子可明显提高多肽离子化效率。此结果与冷却焓理论一致[16,17],即高浓度的极性分子冷凝在雾滴表面的同时,释放一定的能量; 此能量被雾滴表面的分析物分子吸收,最终激发分析物离子化[15]。但在研究的辅助气气氛中,乙醇、丙酮、乙酸乙酯及乙二胺等都能显著提高标准肽段的信号强度; 与空气为辅助气相比,信号强度可以提高1000倍。相比之下,乙醇可更明显提高多价离子响应,有利于多肽质谱鉴定,因此,采用乙醇作为辅助气进行后续实验。
3.3 痕量BSA酶解产物分析
基于nano-RPLC-ESI-MS/MS系统,对1 ng BSA酶解产物进行分离分析。辅助气中添加乙醇后,在CEESI空腔内,乙醇与雾滴在离子传输管内相互作用,肽段谱图匹配(PSM)、肽段数目、序列覆盖率均提高约10%(表1)。比较肽段的峰面积发现,添加乙醇的辅助气提高了大部分肽段的质谱响应,与文献\[16\]结果相似。但是并未观察到标准肽段信号的改善,这可能是因为高浓度乙醇辅助气会抑制流动相挥发。
由于高浓度乙醇气氛会抑制雾滴中有机溶剂挥发,不同样品溶剂对标准肽段灵敏度有较大的影响。在相同的乙醇分压下,纯水为溶剂时信号改善效果最显著(图4); 溶剂中仅加入乙腈时,随着溶剂中乙腈加入量增大,信号改善效果变差,甚至降低肽段的质谱响应; 加入0.1% FA,获得更显著的改善效果。然而,随着有机相比例增大,会抑制乙醇对标肽质谱响应的改善效果。以上结果说明,乙醇分压太高会抑制有机溶剂的挥发,不利于样品离子化,因而实际应用时,应选择辅助气中的有机添加剂的最佳分压。
采用LC-ESI-MS/MS分析痕量BSA酶解产物时,多肽的色谱峰主要分布于有机相为10%~35%的条件下,即仅在有机相浓度较低时,出峰的肽段信号得到改善,进一步证实了高浓度乙醇气氛会抑制雾滴溶剂挥发。当乙醇分压下降时,抑制效果减弱,质谱响应显著增强。
3.4 痕量HeLa细胞提取蛋白酶解产物分析
在最佳分压的乙醇气氛中,肽段和蛋白鉴定数目明显增多。当HeLa酶解产物的上样量为6 ng和10 ng时,乙醇气氛下肽段和蛋白鉴定数目较空气气氛约提高了20%; 当上样量为20 ng时,多肽和蛋白鉴定数目分别提高360%和200%(图5)。此结果进一步证实乙醇气氛可以提高分析物离子化效率,促进多肽质谱响应。当进样量增大到50 ng时,乙醇气氛下肽段和蛋白鉴定数目较空气气氛分别提高280%和158%; 相对20 ng进样量的鉴定结果提高较少。因而,气氛辅助CEESI源更适于痕量蛋白质组样品的分析。
与开放式离子源比较, CEESI特殊设计的离子传输管的内表面具有康达效应功能,可改善离子传输效率。同时,结合辅助气添加剂与喷雾的相互作用,促进肽段离子化。在考察的上样量范围内,采用CEESI源可将鉴定的肽段和蛋白数目分别提高58%~320%和50%~180%。
采用空气作为辅助气,当样品量较小(小于20ng)时,CEESI鉴定的肽段和蛋白数目较开放式nano-ESI分别提高30%和12%。但是随着样品量增加,采用开放式nano-ESI可以获得更多的肽段和蛋白鉴定数目。这可能是因为上样量较小时,空气气氛下的封闭式离子源具有更高的离子传输效率,因而可以比开放源鉴定更多的肽段和蛋白数目。当样品量增大时,高效离子化产生更多的离子,但是受离子传输管离子传输效率的限制,进入质量分析器的肽段离子受限,因此开放源具有更显著的优势。
乙醇气氛不仅改善离子传输效率、促进多肽离子化,而且可以改善喷雾稳定性。以上样量20 ng为例(图5C),空气气氛封闭式离子源、乙醇气氛封闭式离子源和开放式离子源三针共同鉴定到的蛋白质比例分别是25.0%, 30.6%和19.5%,证实CEESI源比开放纳喷源具有更好的喷雾稳定性。
4 结 论
针对开放式电喷雾离子源喷雾稳定性差、离子化效率低及喷针寿命短等问题,设计了气氛可调CEESI源。通过考察具有不同饱和蒸气压的有机小分子作为辅助气对电喷雾效果的影响,发现乙醇能够显著提高标准肽段信号强度。在最佳的乙醇分压下,不仅HeLa细胞提取蛋白质酶解产物的肽段和蛋白鉴定数目显著提高,而且喷雾稳定性得到了改善。上述结果初步说明,CEESI源在痕量蛋白质组样品分析方面具有很大的应用潜力。
References
1 WANG Chun-Min, LIU Qiang, LI Jian, XU Bo, MI Kai, CHENG Juan. Chinese J. Anal. Chem., 2014, 42(9): 1326-1331
王春民, 刘 强, 李 建, 徐 波, 米 凯, 程 娟. 分析化学, 2014, 42(9): 1326-1331
2 WANG Gui-Ming, SHI Dong-Dong, PENG Zhang-Xiao, LU Yang-Fang, GU Xue, WANG Yan, YAN Chao. Chinese J. Anal. Chem., 2015, 43(5): 682-688
王桂明, 史栋栋, 彭章晓, 鲁阳芳, 谷 雪, 王 彦, 闫 超. 分析化学, 2015, 43(5): 682-688
3 Luo Q, Rejtar T, Wu S L, Karger B L. J. Chromatogr. A, 2009, 1216(8): 1223-1231
4 Wilm M, Mann M. Anal. Chem., 1996, 68(1): 1-8
5 Okudaira M, Inoue A, Shuto A, Nakanaga K, Kano K, Makide K, Saigusa D, Tomioka Y, Aoki J. J. Lipid Res., 2014, 55(10): 2178-2192
6 El-Faramawy A, Siu K W M, Thomson B A. J. Am. Soc. Mass Spectrom., 2005, 16(10): 1702-1707
7 Nirmala R R, Nilgun C S, Griff H W. 58th ASMS Conference on Mass Spectrometry and Allied Topics, Salt Lake City, UT, 2010
8 Ramanathan R N R, Comezoglu S N, Humphreys W G. Int. J. Mass Spectrom., 2011, 301(3): 127-135
9 Li Z, Li L. Anal. Chem., 2014, 86(1): 331-335
10 Kharlamova A, McLuckey S A. Anal. Chem., 2011, 83(1): 431-437
11 Kharlamova A, Prentice B M, Huang T Y, McLuckey S A. Anal. Chem., 2010, 82(17): 7422-7429
12 Asperger A, Marx K, Albers C, Molin L, Pinato O. J. Proteome Res., 2015, 14(6): 2633-2641
13 de Muth J C, McLuckey S A. Anal. Chem., 2015, 87(2): 1210-1218
14 Wang L H, Li D Q, Fu Y. Rapid Commun. Mass Spectrom., 2007, 21(18): 2985-2991
15 Konermann L, Ahadi E, Rodriguez A D, Vahidi S. Anal. Chem., 2013, 85(1): 2-9
16 Samalikova M, Grandori R. J. Am. Chem. Soc., 2003, 125(44): 13352-13353
17 Iavarone A. T, Williams E R. J. Am. Chem. Soc., 2003, 125(8): 2319-2327

