手性高效液相色谱—同位素稀释串联质谱法测定土壤及蚯蚓中的六溴环十二烷对映体
田芹 佟玲 宋淑玲 王晓春 焦杏春 姜润飞

摘 要 采用高效液相色谱-同位素稀释串联质谱法(LC-ID-MS/MS)建立了土壤和蚯蚓中手性α-,β-,γ-六溴环十二烷(HBCD)的分离分析方法。样品添加d18-HBCDs作为同位素内标后提取,土壤样品采用正己烷-二氯甲烷(1∶1, V/V)作萃取剂,加速溶剂萃取(ASE),硅胶固相萃取小柱净化;蚯蚓样品采用乙酸乙酯涡旋超声提取,浓硫酸磺化后过硅胶小柱净化。α-,β-,γ-HBCD各对映体的线性范围为0.25~50 ng/mL;土壤中检出限为0.00544~0.00766 ng/g,定量限为0.0173~0.0244 ng/g,在0.05和2.5 ng/g添加浓度的回收率为80.0%~95.9%,相对标准偏差RSD为5.7%~11.9%;在蚯蚓中,检出限为0.0103~0.0148 ng/g,定量限为0.0328~0.0471 ng/g,在0.1和5.0 ng/g添加浓度的回收率为78.0%~94.4%,相对标准偏差RSD为6.1%~12.2%。可满足实际样品的测定要求。
关键词 同位素稀释; 高效液相色谱-串联质谱; 六溴环十二烷; 对映体; 土壤; 蚯蚓
1 引 言
六溴环十二烷(C12H18Br6,简称HBCDs)是一种添加型阻燃剂,被广泛应用于聚苯乙烯泡沫、纺织品和电子产品等领域。研究表明,HBCDs为肝酶诱导剂,发育神经毒剂和内分泌干扰物[1]。在许多环境介质中都被检出,包括鱼类[2]、鸟类[3]、灰尘[4]、土壤[5,6]、淤泥[7]、人体[8~10],甚至北极地区[11]。HBCDs 的广泛使用及其毒性已对环境造成严重威胁,被斯德哥尔摩公约列为受审物质。商品化的HBCD 产品主要由α-HBCD (10%~13%)、β-HBCD (1%~12%) 与γ-HBCD (75%~89%)[12]构成。各异构体结构不同,导致其不同的环境行为及毒性风险;同时3种异构体又是外消旋体,各对映体之间在环境和生物体内也表现出不同的立体选择性行为及毒性效应。Du等[13]研究表明,斑马鱼选择性富集(+)-α-HBCD 和(+)-γ-HBCD相应的对映体。Zhang等[14]研究表明,(+)-α-,β-,γ-HBCD比相应(-)-α-,β-,γ-HBCD对HepG2细胞毒性更大。因此,建立手性HBCDs在环境样品中的分离分析方法,对于在对映体水平研究手性HBCDs的环境问题,准确评价其对人类健康和生态环境系统的风险具有重要意义。
目前,对HBCDs 异构体的测定普遍采用液相色谱-质谱技术[15,16],传统的非手性研究方法只能将一对对映体视作同一化合物进行研究,同时在测定过程中,基质化合物等因素对HBCDs的测定存在影响,而同位素稀释法不仅能够消除仪器波动造成的系统差异影响,而且能补偿样品在前处理和检测过程中基质效应。本研究利用手性液相色谱-同位素稀释质谱法,建立了土壤和蚯蚓中α-,β-, γ-HBCD对映体的分离分析方法,不仅可以提供对映体的准确信息,而且可以对实际样品进行准确分析。2 实验部分
2.1 仪器、试剂与样品
Agilent1200高效液相色谱仪(美国Agilent公司);API4000三重四级杆质谱仪及Analyst 1.5 数据采集软件(美国AB应用生物系统公司);ASE200 加速溶剂萃取仪(美国Dionex公司);PRO200匀浆器 (美国PRO公司);KL512/509J型12位恒温水浴氮吹仪(北京康林科技股份有限公司);LABOROTA 4001-efficient(Heidoloph)旋转蒸发仪;硅胶固相萃取小柱 (3 mL, 500 mg, 德国CNW公司);固相萃取装置(Supelco公司)
外消旋体α-, β-, γ-六溴环十二烷(美国AccuStandard公司); d18-六溴环十二烷(加拿大Wellington Laboratories 公司); 13C-α-, β-, γ-六溴环十二烷(美国Cambridge Isotope Laboratories公司);甲醇、乙腈等试剂(色谱纯,Fisher公司)。
土壤样品:分别取自北京、安徽和广东的3份0~10 cm农田表层土壤,自然阴干;蚯蚓:赤字爱胜蚓(Esenia fetida),购自北京大环顺鑫有机肥料厂,每条体重200~300 mg,环带明显的2月龄以上成熟蚯蚓。
2.2 色谱-质谱条件
色谱条件:Nucleodex β-PM手性色谱柱(200 mm×4.0 mm, 5 μm);流动相:乙腈-甲醇-水(含5 mmol乙酸胺),梯度洗脱,优化后的流动相条件见表1。柱温:室温;流速:500 μL/min;进样量10 μL。
质谱条件:采用电喷雾离子化方式,负离子模式检测;多反应监测(MRM) 模式;离子喷射电压(IS):
4500 V;碰撞气压力(CAD):55.16 kPa;气帘气压力(CUR):68.95 kPa;源内气体1压力(GS1):413.70 kPa;气体2压力(GS2):344.75 kPa;雾化温度(TEM):300℃;其它质谱参数见表2。
2.3 标准溶液配制
采用同位素稀释技术进行定量分析, 即用d18-HBCDs同位素内标定量,对定量内标的回收率采用13C-HBCDs进样内标计算。
HBCD及13C-HBCDs、d18-HBCDs标准储备液及工作液的配制: 分别量取α-,β-, γ-HBCD标准溶液, 用甲醇稀释定容,配制成含3种异构体各1 μg/mL的标准储备液,于
18℃条件下保存。使用时, 用甲醇稀释上述标准储备溶液, 配制成不同浓度的标准工作液。同法配制13C-HBCDs、d18-HBCDs标准储备液及工作液。
标准曲线溶液的配制:用甲醇逐级稀释α-, β-, γ-HBCD储备液, 得到单一对映体浓度分别为0.25,0.5, 2.5, 5, 25和50 ng/mL的混合标准工作溶液,其中13C-HBCDs、d18-HBCDs单一对映体浓度均为5 ng/mL,于4 ℃下保存, 现用现配。
2.4 样品前处理
土壤:阴凉处自然晾干,粉碎后过40目筛。准确称取10 g样品,加入5 g硅藻土混匀,放入22 mL ASE萃取池中,加入同位素稀释定量内标d18-HBCDs。以正己烷-二氯甲烷(1∶1, V/V)为提取剂,温度100℃,压力10 MPa,静态提取5 min。萃取液40℃减压旋转蒸至近干,以2 mL正己烷溶解,过硅胶SPE小柱,用15 mL正己烷-乙酸乙酯(8∶2, V/V)洗脱,洗脱液在40℃水浴中氮气吹近干,加入13C-HBCDs进样内标,甲醇定容1 mL,待HPLC-MS/MS检测。
蚯蚓:将蚯蚓样品匀浆1 min,称取5 g置于50 mL离心管中,加入同位素稀释定量内标d18-HBCDs。加25 mL乙酸乙酯涡旋提取3 min,超声提取10 min,4000 r/min离心5 min,上清液过无水Na2SO4后转入100 mL平底烧瓶中,另用25 mL乙酸乙酯按上述步骤重复提取残留物,合并提取液于平底烧瓶中,45℃水浴下减压旋转蒸发近干,用10 mL正己烷溶解,浓H2SO4磺化净化,浓缩约2 mL,过硅胶SPE小柱,步骤同土壤净化。
3 结果与讨论
3.1 手性HBCDs对映体分离条件优化及出峰顺序
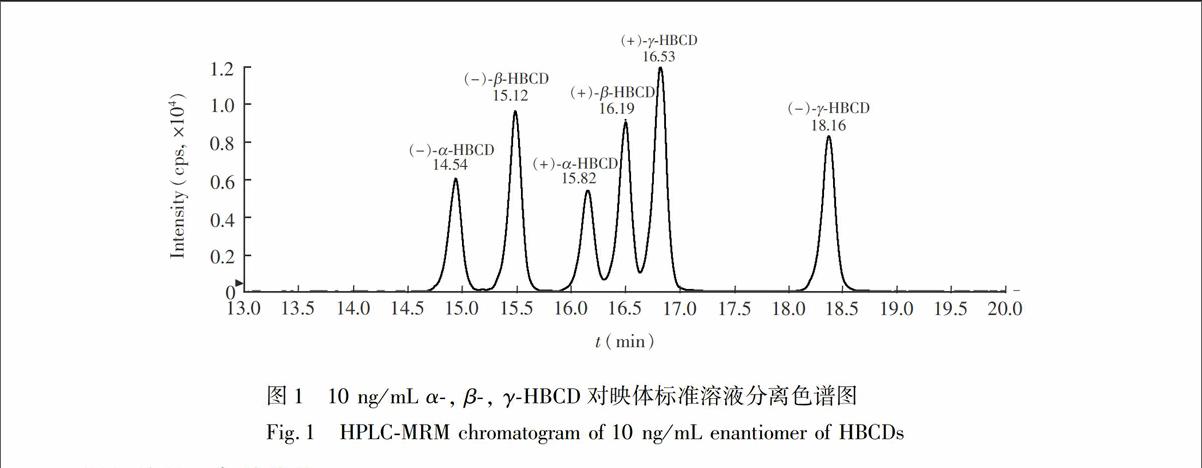
依据文献[13],选择乙腈-甲醇-水做流动相体系,通过对流动相组成比例的优化,最终确定了流动相组成比例,见表1。为了得到较高的灵敏度,加入甲酸和乙酸铵,5 mmoL乙酸铵被确定有较高的灵敏度,对映体的出峰顺序依据文献[12,13,17]确定, 典型色谱图见图1。
3.2 样品前处理条件优化
土壤:考察了正己烷-丙酮、正己烷-二氯甲烷、乙腈对土壤中HBCDs的ASE提取效果。结果表明,正己烷-二氯甲烷(1∶1,V/V)的回收率较好,乙腈提取回收率较低,而正己烷-丙酮提取出杂质较多。不同萃取温度(80℃,100℃和120℃)对回收率影响不大,但100℃时效果稍好。循环萃取2次回收率与循环3次相差不大。选择正己烷-二氯甲烷(1∶1,V/V)作为萃取剂,100℃循环萃取2次。
蚯蚓:考察了乙酸乙酯、二氯甲烷对蚯蚓中手性HBCDs的提取效果。结果表明,这两种溶剂对HBCDs的提取回收率都可达到要求,但是二氯甲烷在下层,离心后操作不方便,本研究选择乙酸乙酯作提取溶液。
蚯蚓样品的提取液含有血水、脂肪,颜色较深,直接过硅胶小柱,净化效果很差,杂质较多。本研究在过柱前先对提取液进行了磺化,除去90%以上的脂类化合物和色素[18],样品溶液也变得干净清澈。在待测组分的保留时间处均无杂质干扰,HBCDs异构体也未发生相互转化。因此,本研究采用以浓H2SO4磺化结合硅胶小柱净化的方式净化蚯蚓样品。土壤样品直接采用硅胶SPE小柱净化。
3.3 方法的线性关系、检出限、定量限
运用所建立的HPLC-MS/MS方法对标准溶液进行测定并建立校准曲线。线性回归分析结果表明,HBCDs的各个对映体在0.25~50 ng/mL浓度范围内与峰面积呈良好的线性关系,相关系数R2>0.999。方法检出限以线性最低点0.25 ng/mL分别添加到10 g土壤和5g蚯蚓中,平行7份,计算标准偏差(S),检出限以3.14 S(p=0.99)计算,定量限以10 S计算,结果见表3。
3.4 方法的准确度和精密度
方法的准确度通过空白添加回收率评估。在空白样品中加入适量标准溶液,得到土壤中含各对映体浓度分别为0.05和2.5 ng/g的加标样品,蚯蚓中含各对映体浓度分别为0.1和5 ng/g的加标样品,进行回收率测定。每个添加水平重复6次,计算重复测定的标准偏差与相对标准偏差,获得方法的精密度(表4)。各对映体在土壤中不同浓度的添加回收率为80.0%~95.9%,RSD在5.7%~11.9%之间;在蚯蚓中不同浓度的添加回收率为78.0%~94.4%,RSD在6.1%~12.2%之间。同位素定量内标d18-HBCDs各对映体回收率在69.2%~102.0%之间,RSD <14.3%。本方法精密度好,准确度高。
3.5 实际样品分析
采用本方法测定了3份实际土壤样品和1份蚯蚓样品,实验过程中d18-HBCDs同位素定量内标的回收率为65.3%~104.0%,实际样品中HBCDs的检测结果见表5,典型色谱图见图2。从检测结果可知,取自北京和安徽1#、3#农田土壤样品和4#蚯蚓样品未检出目标化合物,没有受到HBCDs的污染;而取自广东的2#土壤样品检出 了(±)-αHBCD、(±)-β-HBCD和(±)-γ-HBCD,2#样品可能受到广东清远
4 结 论
建立了高效液相色谱同位素稀释-三重四极杆串联质谱分析土壤和蚯蚓中α-,β-, γ-六溴环十二烷3对对映体的方法,本方法能有效消除土壤和蚯蚓中的基质干扰,保证分析检测的准确性;方法的灵敏度高,可以满足实际样品的测试需要。
References
1 HamersT, Kamstra J H, Sonneveld E, Murk A J, Kester M H, Andersson P L, Legler J, Brouwer A. Toxicol. Sci., 2006, 92(1): 157-173
2 Zeng Y H, Luo X J, Zheng X B, Tang B, Wu J P, Mai B X. Arch. Environ. Con. Tox., 2014, 67(3): 348-357
3 He M J, Luo X J, Yu L H, Zhang X L, Liu J, Chen S J, Chen D, Mai B X.Environ. Sci. Technol., 2010, 44(15): 5748-5754
4 Hassan Y,Shoei T. Sci. Total Environ., 2015, 505: 47-55
5 JIN Jun, YANG Cong-Qiao, WANG Ying, LIU An-Ming. Chinese J. Anal. Chem., 2009, 37(4): 585-588
金 军, 杨从巧, 王 英, 刘安明. 分析化学, 2009, 37(4): 585-588
6 Gao S, Wang J, Yu Z, Guo Q, Sheng G, Fu J. Environ. Sci. Technol., 2011, 45(6): 2093-2099
7 Xiang N, Chen L,Meng X Z, Dai X. Chemosphere, 2015, 118(1): 207-212
8 Rawn D F K, Gaertner D W, Weber D, Curran I H A, Cooke G M, Goodyer C G. Sci. Total Environ., 2014, 468-469: 622-629
9 Ryan J J, Rawn D F K. Enviro. Int., 2014, 70: 1-8
10 LUO Xiao-Jun, WU Jiang-Ping, CHEN She-Jun, MAI Bi-Xian. Scientia Sinica Chimica, 2013, 43(3): 291-304
罗孝俊, 吴江平, 陈社军, 麦碧娴. 中国科学: 化学, 2013, 43(3): 291-304
11 Vorkamp K, Rigét F F, Bossi R, Dietz R. Environ. Sci. Technol., 2011, 45(4):1243-1249
12 Heeb NV, Schweizer WB, Kohler M, Kohler M, Gerecke A C. Chemosphere, 2005, 61(1): 65-73
13 Du M, Lin L, Yan C, Zhang X. Environ. Sci. Technol, 2012, 46(20): 11040-11046
14 Zhang X L, Yang F X, Xu C, Liu W, Wen S, Xu Y. Toxicol. in Vitro., 2008, 22: 1520-1527
15 Zacs D, Rjabova J, Pugajeva I, Nakurte I, Viksna A, Bartkevics V. J. Chromatogr. A, 2014, 1366: 73-83
16 Hu X, Hu D, Song Q, Li J, Wang P. Chemosphere, 2011, 82(5): 698-707
17 Heeb N V, Schweizer W B, Mattrel P, Haag R, Gerecke A C, Kohler M, Schimd P, Zennegg M, Wolffensberger M, Chemosphere, 2007, 68(5): 940- 950
18 Karasali H, Balayiannis G, Anagnostopoulos H, Hourdakis A. Bull. Environ. Contam. Toxicol., 2005, 75(2): 257-263



摘 要 采用高效液相色谱-同位素稀释串联质谱法(LC-ID-MS/MS)建立了土壤和蚯蚓中手性α-,β-,γ-六溴环十二烷(HBCD)的分离分析方法。样品添加d18-HBCDs作为同位素内标后提取,土壤样品采用正己烷-二氯甲烷(1∶1, V/V)作萃取剂,加速溶剂萃取(ASE),硅胶固相萃取小柱净化;蚯蚓样品采用乙酸乙酯涡旋超声提取,浓硫酸磺化后过硅胶小柱净化。α-,β-,γ-HBCD各对映体的线性范围为0.25~50 ng/mL;土壤中检出限为0.00544~0.00766 ng/g,定量限为0.0173~0.0244 ng/g,在0.05和2.5 ng/g添加浓度的回收率为80.0%~95.9%,相对标准偏差RSD为5.7%~11.9%;在蚯蚓中,检出限为0.0103~0.0148 ng/g,定量限为0.0328~0.0471 ng/g,在0.1和5.0 ng/g添加浓度的回收率为78.0%~94.4%,相对标准偏差RSD为6.1%~12.2%。可满足实际样品的测定要求。
关键词 同位素稀释; 高效液相色谱-串联质谱; 六溴环十二烷; 对映体; 土壤; 蚯蚓
1 引 言
六溴环十二烷(C12H18Br6,简称HBCDs)是一种添加型阻燃剂,被广泛应用于聚苯乙烯泡沫、纺织品和电子产品等领域。研究表明,HBCDs为肝酶诱导剂,发育神经毒剂和内分泌干扰物[1]。在许多环境介质中都被检出,包括鱼类[2]、鸟类[3]、灰尘[4]、土壤[5,6]、淤泥[7]、人体[8~10],甚至北极地区[11]。HBCDs 的广泛使用及其毒性已对环境造成严重威胁,被斯德哥尔摩公约列为受审物质。商品化的HBCD 产品主要由α-HBCD (10%~13%)、β-HBCD (1%~12%) 与γ-HBCD (75%~89%)[12]构成。各异构体结构不同,导致其不同的环境行为及毒性风险;同时3种异构体又是外消旋体,各对映体之间在环境和生物体内也表现出不同的立体选择性行为及毒性效应。Du等[13]研究表明,斑马鱼选择性富集(+)-α-HBCD 和(+)-γ-HBCD相应的对映体。Zhang等[14]研究表明,(+)-α-,β-,γ-HBCD比相应(-)-α-,β-,γ-HBCD对HepG2细胞毒性更大。因此,建立手性HBCDs在环境样品中的分离分析方法,对于在对映体水平研究手性HBCDs的环境问题,准确评价其对人类健康和生态环境系统的风险具有重要意义。
目前,对HBCDs 异构体的测定普遍采用液相色谱-质谱技术[15,16],传统的非手性研究方法只能将一对对映体视作同一化合物进行研究,同时在测定过程中,基质化合物等因素对HBCDs的测定存在影响,而同位素稀释法不仅能够消除仪器波动造成的系统差异影响,而且能补偿样品在前处理和检测过程中基质效应。本研究利用手性液相色谱-同位素稀释质谱法,建立了土壤和蚯蚓中α-,β-, γ-HBCD对映体的分离分析方法,不仅可以提供对映体的准确信息,而且可以对实际样品进行准确分析。2 实验部分
2.1 仪器、试剂与样品
Agilent1200高效液相色谱仪(美国Agilent公司);API4000三重四级杆质谱仪及Analyst 1.5 数据采集软件(美国AB应用生物系统公司);ASE200 加速溶剂萃取仪(美国Dionex公司);PRO200匀浆器 (美国PRO公司);KL512/509J型12位恒温水浴氮吹仪(北京康林科技股份有限公司);LABOROTA 4001-efficient(Heidoloph)旋转蒸发仪;硅胶固相萃取小柱 (3 mL, 500 mg, 德国CNW公司);固相萃取装置(Supelco公司)
外消旋体α-, β-, γ-六溴环十二烷(美国AccuStandard公司); d18-六溴环十二烷(加拿大Wellington Laboratories 公司); 13C-α-, β-, γ-六溴环十二烷(美国Cambridge Isotope Laboratories公司);甲醇、乙腈等试剂(色谱纯,Fisher公司)。
土壤样品:分别取自北京、安徽和广东的3份0~10 cm农田表层土壤,自然阴干;蚯蚓:赤字爱胜蚓(Esenia fetida),购自北京大环顺鑫有机肥料厂,每条体重200~300 mg,环带明显的2月龄以上成熟蚯蚓。
2.2 色谱-质谱条件
色谱条件:Nucleodex β-PM手性色谱柱(200 mm×4.0 mm, 5 μm);流动相:乙腈-甲醇-水(含5 mmol乙酸胺),梯度洗脱,优化后的流动相条件见表1。柱温:室温;流速:500 μL/min;进样量10 μL。
质谱条件:采用电喷雾离子化方式,负离子模式检测;多反应监测(MRM) 模式;离子喷射电压(IS):
4500 V;碰撞气压力(CAD):55.16 kPa;气帘气压力(CUR):68.95 kPa;源内气体1压力(GS1):413.70 kPa;气体2压力(GS2):344.75 kPa;雾化温度(TEM):300℃;其它质谱参数见表2。
2.3 标准溶液配制
采用同位素稀释技术进行定量分析, 即用d18-HBCDs同位素内标定量,对定量内标的回收率采用13C-HBCDs进样内标计算。
HBCD及13C-HBCDs、d18-HBCDs标准储备液及工作液的配制: 分别量取α-,β-, γ-HBCD标准溶液, 用甲醇稀释定容,配制成含3种异构体各1 μg/mL的标准储备液,于
18℃条件下保存。使用时, 用甲醇稀释上述标准储备溶液, 配制成不同浓度的标准工作液。同法配制13C-HBCDs、d18-HBCDs标准储备液及工作液。
标准曲线溶液的配制:用甲醇逐级稀释α-, β-, γ-HBCD储备液, 得到单一对映体浓度分别为0.25,0.5, 2.5, 5, 25和50 ng/mL的混合标准工作溶液,其中13C-HBCDs、d18-HBCDs单一对映体浓度均为5 ng/mL,于4 ℃下保存, 现用现配。
2.4 样品前处理
土壤:阴凉处自然晾干,粉碎后过40目筛。准确称取10 g样品,加入5 g硅藻土混匀,放入22 mL ASE萃取池中,加入同位素稀释定量内标d18-HBCDs。以正己烷-二氯甲烷(1∶1, V/V)为提取剂,温度100℃,压力10 MPa,静态提取5 min。萃取液40℃减压旋转蒸至近干,以2 mL正己烷溶解,过硅胶SPE小柱,用15 mL正己烷-乙酸乙酯(8∶2, V/V)洗脱,洗脱液在40℃水浴中氮气吹近干,加入13C-HBCDs进样内标,甲醇定容1 mL,待HPLC-MS/MS检测。
蚯蚓:将蚯蚓样品匀浆1 min,称取5 g置于50 mL离心管中,加入同位素稀释定量内标d18-HBCDs。加25 mL乙酸乙酯涡旋提取3 min,超声提取10 min,4000 r/min离心5 min,上清液过无水Na2SO4后转入100 mL平底烧瓶中,另用25 mL乙酸乙酯按上述步骤重复提取残留物,合并提取液于平底烧瓶中,45℃水浴下减压旋转蒸发近干,用10 mL正己烷溶解,浓H2SO4磺化净化,浓缩约2 mL,过硅胶SPE小柱,步骤同土壤净化。
3 结果与讨论
3.1 手性HBCDs对映体分离条件优化及出峰顺序
依据文献[13],选择乙腈-甲醇-水做流动相体系,通过对流动相组成比例的优化,最终确定了流动相组成比例,见表1。为了得到较高的灵敏度,加入甲酸和乙酸铵,5 mmoL乙酸铵被确定有较高的灵敏度,对映体的出峰顺序依据文献[12,13,17]确定, 典型色谱图见图1。
3.2 样品前处理条件优化
土壤:考察了正己烷-丙酮、正己烷-二氯甲烷、乙腈对土壤中HBCDs的ASE提取效果。结果表明,正己烷-二氯甲烷(1∶1,V/V)的回收率较好,乙腈提取回收率较低,而正己烷-丙酮提取出杂质较多。不同萃取温度(80℃,100℃和120℃)对回收率影响不大,但100℃时效果稍好。循环萃取2次回收率与循环3次相差不大。选择正己烷-二氯甲烷(1∶1,V/V)作为萃取剂,100℃循环萃取2次。
蚯蚓:考察了乙酸乙酯、二氯甲烷对蚯蚓中手性HBCDs的提取效果。结果表明,这两种溶剂对HBCDs的提取回收率都可达到要求,但是二氯甲烷在下层,离心后操作不方便,本研究选择乙酸乙酯作提取溶液。
蚯蚓样品的提取液含有血水、脂肪,颜色较深,直接过硅胶小柱,净化效果很差,杂质较多。本研究在过柱前先对提取液进行了磺化,除去90%以上的脂类化合物和色素[18],样品溶液也变得干净清澈。在待测组分的保留时间处均无杂质干扰,HBCDs异构体也未发生相互转化。因此,本研究采用以浓H2SO4磺化结合硅胶小柱净化的方式净化蚯蚓样品。土壤样品直接采用硅胶SPE小柱净化。
3.3 方法的线性关系、检出限、定量限
运用所建立的HPLC-MS/MS方法对标准溶液进行测定并建立校准曲线。线性回归分析结果表明,HBCDs的各个对映体在0.25~50 ng/mL浓度范围内与峰面积呈良好的线性关系,相关系数R2>0.999。方法检出限以线性最低点0.25 ng/mL分别添加到10 g土壤和5g蚯蚓中,平行7份,计算标准偏差(S),检出限以3.14 S(p=0.99)计算,定量限以10 S计算,结果见表3。
3.4 方法的准确度和精密度
方法的准确度通过空白添加回收率评估。在空白样品中加入适量标准溶液,得到土壤中含各对映体浓度分别为0.05和2.5 ng/g的加标样品,蚯蚓中含各对映体浓度分别为0.1和5 ng/g的加标样品,进行回收率测定。每个添加水平重复6次,计算重复测定的标准偏差与相对标准偏差,获得方法的精密度(表4)。各对映体在土壤中不同浓度的添加回收率为80.0%~95.9%,RSD在5.7%~11.9%之间;在蚯蚓中不同浓度的添加回收率为78.0%~94.4%,RSD在6.1%~12.2%之间。同位素定量内标d18-HBCDs各对映体回收率在69.2%~102.0%之间,RSD <14.3%。本方法精密度好,准确度高。
3.5 实际样品分析
采用本方法测定了3份实际土壤样品和1份蚯蚓样品,实验过程中d18-HBCDs同位素定量内标的回收率为65.3%~104.0%,实际样品中HBCDs的检测结果见表5,典型色谱图见图2。从检测结果可知,取自北京和安徽1#、3#农田土壤样品和4#蚯蚓样品未检出目标化合物,没有受到HBCDs的污染;而取自广东的2#土壤样品检出 了(±)-αHBCD、(±)-β-HBCD和(±)-γ-HBCD,2#样品可能受到广东清远
4 结 论
建立了高效液相色谱同位素稀释-三重四极杆串联质谱分析土壤和蚯蚓中α-,β-, γ-六溴环十二烷3对对映体的方法,本方法能有效消除土壤和蚯蚓中的基质干扰,保证分析检测的准确性;方法的灵敏度高,可以满足实际样品的测试需要。
References
1 HamersT, Kamstra J H, Sonneveld E, Murk A J, Kester M H, Andersson P L, Legler J, Brouwer A. Toxicol. Sci., 2006, 92(1): 157-173
2 Zeng Y H, Luo X J, Zheng X B, Tang B, Wu J P, Mai B X. Arch. Environ. Con. Tox., 2014, 67(3): 348-357
3 He M J, Luo X J, Yu L H, Zhang X L, Liu J, Chen S J, Chen D, Mai B X.Environ. Sci. Technol., 2010, 44(15): 5748-5754
4 Hassan Y,Shoei T. Sci. Total Environ., 2015, 505: 47-55
5 JIN Jun, YANG Cong-Qiao, WANG Ying, LIU An-Ming. Chinese J. Anal. Chem., 2009, 37(4): 585-588
金 军, 杨从巧, 王 英, 刘安明. 分析化学, 2009, 37(4): 585-588
6 Gao S, Wang J, Yu Z, Guo Q, Sheng G, Fu J. Environ. Sci. Technol., 2011, 45(6): 2093-2099
7 Xiang N, Chen L,Meng X Z, Dai X. Chemosphere, 2015, 118(1): 207-212
8 Rawn D F K, Gaertner D W, Weber D, Curran I H A, Cooke G M, Goodyer C G. Sci. Total Environ., 2014, 468-469: 622-629
9 Ryan J J, Rawn D F K. Enviro. Int., 2014, 70: 1-8
10 LUO Xiao-Jun, WU Jiang-Ping, CHEN She-Jun, MAI Bi-Xian. Scientia Sinica Chimica, 2013, 43(3): 291-304
罗孝俊, 吴江平, 陈社军, 麦碧娴. 中国科学: 化学, 2013, 43(3): 291-304
11 Vorkamp K, Rigét F F, Bossi R, Dietz R. Environ. Sci. Technol., 2011, 45(4):1243-1249
12 Heeb NV, Schweizer WB, Kohler M, Kohler M, Gerecke A C. Chemosphere, 2005, 61(1): 65-73
13 Du M, Lin L, Yan C, Zhang X. Environ. Sci. Technol, 2012, 46(20): 11040-11046
14 Zhang X L, Yang F X, Xu C, Liu W, Wen S, Xu Y. Toxicol. in Vitro., 2008, 22: 1520-1527
15 Zacs D, Rjabova J, Pugajeva I, Nakurte I, Viksna A, Bartkevics V. J. Chromatogr. A, 2014, 1366: 73-83
16 Hu X, Hu D, Song Q, Li J, Wang P. Chemosphere, 2011, 82(5): 698-707
17 Heeb N V, Schweizer W B, Mattrel P, Haag R, Gerecke A C, Kohler M, Schimd P, Zennegg M, Wolffensberger M, Chemosphere, 2007, 68(5): 940- 950
18 Karasali H, Balayiannis G, Anagnostopoulos H, Hourdakis A. Bull. Environ. Contam. Toxicol., 2005, 75(2): 257-263

