枯草芽孢杆菌代谢组样品前处理方法的比较研究
王洪彬等
摘 要 本研究比较了不同淬灭剂(甲醇、60%甲醇、60%甲醇0.9% NaCl、60%甲醇0.9% (NH4)2CO3和60%甲醇0.9% NaAc)条件下胞内物质核酸、蛋白质和代谢物的渗漏情况,发现60%甲醇0.9%(NH4)2CO3和60%甲醇0.9% NaAc渗漏最少;比较了珠磨法、液氮研磨法、超声破碎3种细胞破碎方法条件下代谢物的提取效果,发现珠磨法提取效果最佳;比较了不同衍生时间(0.5~2.5 h)下代谢物相对丰度的变化,发现衍生时间达到2.0 h后,代谢物丰度不再有显著变化。最终确定了枯草芽孢杆菌代谢组样品最适前处理方法:预冷的60%甲醇0.9%(NH4)2CO3淬灭, 珠磨法破碎细胞, 细胞破碎物用OBis\[三甲基硅烷\]三氟乙酸盐(MSTFA)衍生2 h。采用本方法从枯草芽孢杆菌中共鉴定到223种代谢物,包括大量氨基酸、有机酸和糖类物质。本研究为枯草芽孢杆菌的代谢组学研究提供了基础。
关键词; 代谢组学; 枯草芽孢杆菌; 气相色谱质谱联用; 前处理
1 引 言
微生物代谢组学旨在分析微生物体系中所有的代谢物。由于代谢物结构的多样性及其浓度分布范围的宽广性,检测尽可能多的代谢物及其含量始终是一个巨大的技术挑战[1,2]。尽管代谢组分析技术近年来获得了快速发展[3~5],但是在代谢组样品制备环节仍然存在诸多问题[6~11]。代谢组学分析技术主要包括核磁共振(NMR)、气相色谱质谱联用(GCMS)和液相色谱质谱联用(LCMS)技术。NMR技术具有样品处理简单、样品破坏性小等优点,但是相比质谱技术灵敏度较低,检测动态范围比较窄。LCMS技术的代谢物适合范围广,可以与多种质谱联用,灵活性和普适性好,但是缺乏完备成熟的标准谱图库,难以高效准确地鉴定代谢物。采用GCMS技术,难挥发性样品需要衍生化,样品处理相对繁琐,但是其有最完整的标准图库,代谢物谱图可检索性较强,定性鉴定方便,因此在代谢组学研究中应用广泛。
基于GCMS的代谢组学分析方法,其样品前处理环节包括淬灭、破碎提取和衍生等步骤,各个步骤对分析质量都有较大的影响。理论上, 一种代谢组样品处理方法无法适合于所有种类的的微生物,因为不同种类微生物的细胞结构不同。目前, 关于微生物代谢组研究有许多报道,但所采用的样品处理方法在细胞淬灭、破碎和衍生化等步骤存在诸多差异。如在样品淬灭环节采用不同的溶剂,主要是60%甲醇或者在60%甲醇中添加一定比例的盐[12~14]。液氮冷冻也是细胞淬灭的常用方法[14],但主要用于动植物组织样品的处理,由于该法无法分开胞内外物质,因此不适于微生物代谢组的研究。细胞破碎方法,主要有珠磨法、超声破碎法和液氮研磨法等[15,16]。在样品衍生化环节可以采用不同的衍生试剂,其中OBis[三甲基硅烷]三氟乙酸盐(MSTFA)作为衍生剂使用比较广泛,文献报道中其衍生时间不尽相同[17~21]。
枯草芽孢杆菌是一种重要的工业微生物[22],广泛应用于蛋白酶和淀粉酶等酶制剂的生产、废水处理、饲料和益生菌行业,同时它也是基础研究领域重要的模式微生物,常用于研究芽孢的形成机制。因此,枯草芽孢杆菌代谢组学研究具有重要意义,但目前有关其代谢组学的研究报道较少,在Meyer等[23]对枯草芽孢杆菌的代谢组分析研究中,并没有对前处理方法展开深入研究。哪些方法更适合于工业微生物枯草芽孢杆菌的研究并没有相关的研究报道。本研究在淬灭、破碎提取和衍生3个重要环节对样品前处理方法进行了比较研究,确定最适合枯草芽孢杆菌的代谢组学研究的样品前处理方法,为枯草芽孢杆菌代谢组学分析研究提供技术支持。
2 实验部分
2.1 仪器与试剂
JY92II DN超声波细胞粉碎机(宁波新艺超声设备有限公司);Precellys 24多功能样品均质器(法国Bertin Technologies 公司);MilliQ Advantage A10超纯水制备系统(美国Millipore公司);7890 A 型气相色谱5975 C型四极杆质谱联用仪(美国Agilent公司);TU1810系列紫外可见分光光度计(北京普析通用有限公司)。
枯草芽孢杆菌AS1.398取自天津科技大学菌种保藏中心。色谱级十五烷酸、甲氧胺盐酸盐、添加有1% 三甲基氯硅烷(TMCS)的MSTFA购自Sigma公司;色谱纯乙腈、甲醇和吡啶购自天津康科德科技公司; NaCl、(NH4)2CO3和NaAc为分析纯,购自天津博欧特化工贸易有限公司;蛋白胨和酵母提取物购自英国Oxoid公司;实验用水为MilliQ超纯水。
2.2 实验方法
2.2.1 菌体培养 枯草芽孢杆菌 AS1.398采用LB液体培养基(1% NaCl,1% 蛋白胨,0.5% 酵母提取物),37℃过夜培养至对数生长期(A600≈2.2)时取样处理。
2.2.2 样品前处理 取培养的菌液10 mL,快速加入30 mL于
2.2.3 GCMS分析 使用气相色谱四极杆质谱联用仪对衍生的样品进行GCMS分析。对于GCMS分析,初始温度70℃,维持4 min,以3℃/min升到133℃,再以2℃/min升到200℃,再以3℃/min升到220℃,最后以5℃/min升到260℃。样口温度:270℃;接口温度:280℃;离子化方式:电子轰击(EI),温度230℃,电子能量70 eV;四极杆温度 150℃,质谱扫描范围为m/z 85~500。色谱条件:Agilent HP5 毛细管柱(30 m×250 μm× 0.25 μm),载气:高纯氦气;载气流速:l.0 mL/min;进样方式:不分流;进样量: 1 μL。测定结果通过安捷伦Chemistation软件内置的检索程序检索Nist08 数据库,结果中匹配度大于900且可能性大于85%的物质作为相对可靠的鉴定结果,通过内标法进行相对定量。
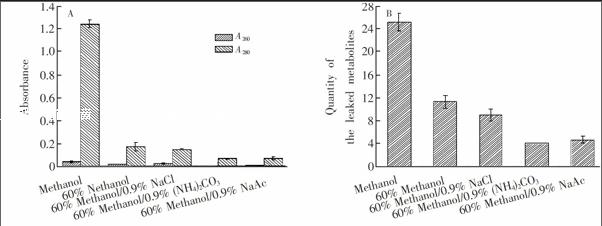
2.2.4 不同淬灭剂处理效果的比较 参考文献报道的淬灭剂进行淬灭处理,并通过检测核酸蛋白渗出和代谢物渗出比较淬灭效果,淬灭剂分别是甲醇、60%甲醇、60%甲醇0.9% NaCl、60%甲醇0.9% (NH4)2CO3和60%甲醇0.9% NaAc[12~14, 24,25]。每种淬灭剂平行处理3个样品。取10 mL培养的菌液,在4℃以6000 r/min离心10 min,弃去上清液,用0.9% NaCl溶液润洗菌体一次。将润洗后的菌体细胞分别重悬在2 mL
Symbolm@@ 40℃ 预冷的4种淬灭剂和阴性对照(2 mL 0.9% NaCl)中,在4℃以6000 r/min离心10 min,收集上清液。测定上清液在260和280 nm的吸光度,分别反映胞内核酸和蛋白质的渗出量。使用衍生后GCMS分析的方法测定上清液中的代谢物,反映胞内代谢物渗出情况,检测方法同2.2.3节,衍生时间选择2.0 h。
2.2.5 不同细胞破碎方法的比较 取10 mL培养的菌液,样品处理方法同2.2.4节,分别采用下列3种方法破碎细胞,其中淬灭剂采用60%甲醇/0.9%NaCl,衍生时间为2 h。衍生后GCMS分析代谢物的方法同2.2.3。每种破碎方法进行3次平行实验
3 结果与讨论
3.1 不同淬灭剂处理效果的比较
微生物细胞内存在许多周转率很高的代谢物,如ATP、ADP、6磷酸葡萄糖等。为了准确反映取样时细胞真实的代谢状态,取样后必须立刻通过细胞淬灭终止菌体代谢。同时又要防止对细胞结构造成较大破坏,以免代谢物大量渗出影响胞内代谢物的检测。因此,适合的淬灭剂既要有较高的淬灭效率,又要渗出较少的代谢物。低温的60%甲醇被证明可以有效淬灭细胞代谢[13],常在其中添加盐(如NaCl、(NH4)2CO3和NaAc等)以降低代谢物渗出。
3.2 不同细胞破碎方法的比较
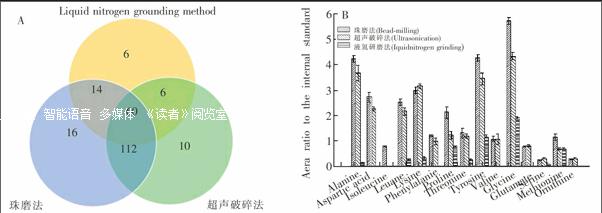
理想的细胞破碎方法不仅要考虑细胞破碎率,还应该无偏向性地将所有代谢物最大程度地释放出来,同时保持破碎提取过程中代谢物不发生改变。为保证代谢产物的稳定,破碎过程中应使酶处于持续失活状态。图2A显示了3种细胞破碎方法得到的代谢物鉴定结果的比较,可以看出,珠磨法所得样品中鉴定到的代谢物种类最多,总共202种,超声破碎法略少,为188种,而液氮研磨法鉴定到的代谢物种类最少,仅为86种;仅在珠磨法或超声破碎法样品中鉴定到的代谢物数量分别为30种和16种,而两种方法共同鉴定到的代谢物种类数量为172种,占据了各自的大多数。图2B给出了不同破碎条件下氨基酸的检测结果,可以看出,珠磨法和超声破碎法相比液氮研磨法不仅鉴定到了更多的氨基酸种类,而且对于共同检测到的氨基酸,前者检测到的含量也比后者要高。超声破碎过程只能在冰浴条件下进行,无法达到更低的温度,会影响酶的失活效果和提取过程中代谢物的稳定性。液氮研磨法虽然具有极低的细胞破碎温度,保证了代谢物的稳定,但是人为操作因素较多,细胞破碎效率和样品回收的重复性难以保证。相比而言,珠磨法不仅具有较少的人为操作影响和较高的细胞破碎效率,而且液氮提供的超低温环境保证了破碎过程中代谢物的稳定性。
3.3 衍生时间对代谢物分析结果的影响
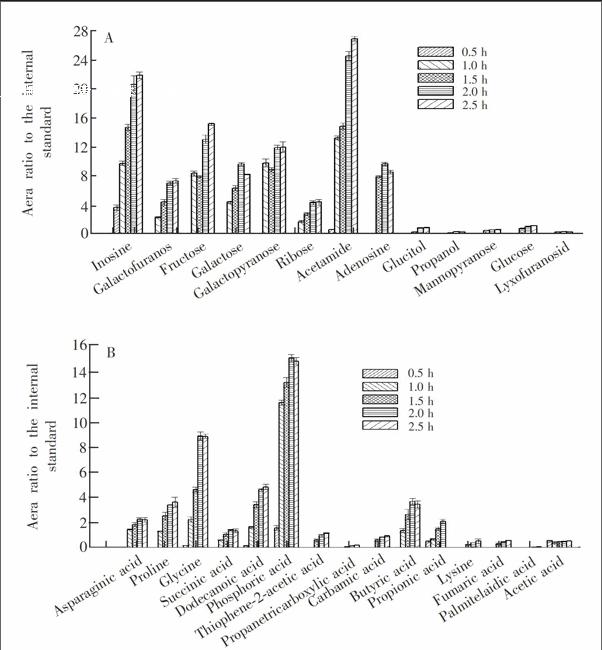
MSTFA是基于GCMS的代谢组研究中广泛采用的衍生剂,添加的1%的TMCS可以催化难以硅烷化的化合物以及一些与单独的MSTFA无法发生衍生反应的羟基发生反应,从而提高衍生效率[19]。MSTFA衍生过程中产生的副产物及其自身通常是与溶剂前沿一起洗脱的,适用于分析小分子物质。由于定量检测是以衍生化为基础,充分的衍生是可靠定量的前提。本研究对比了衍生化时间为0.5, 1.0, 1.5, 2.0和2.5 h时样品的分析结果,发现衍生时间达到2.0 h之后,代谢物在丰度上不再有明显的变化。图3显示了不同衍生时间下部分有机酸和糖类代谢物的检测结果,可以看出,衍生0.5 h时大多数物质浓度较低且有多种物质无法检测到,而衍生2.0和2.5 h时检测到的这些物质的浓度最高,且二者之间没有显著差异。
3.4 样品前处理最适方法的确定
通过对不同淬灭剂、细胞破碎方法和衍生时间条件下代谢组分析结果的比较,最终选择预冷的60%甲醇/0.9%(NH4)2CO3溶液淬灭、珠磨法破碎细胞和MSTFA衍生2.0 h进行枯草芽孢杆菌代谢组样品的前处理。60%甲醇0.9% (NH4)2CO3和60%甲醇0.9%NaAc的淬灭效果比较接近,但是 (NH4)2CO3作为挥发性盐同样适合LCMS代谢组学分析的要求,而NaAc并不适合。代谢组学研究经常同时采用GCMS和LCMS两种分析方案进行互补,故最终选择前者作为淬灭剂。超声破碎法所得样品中鉴定到的代谢物数量与珠磨法差别不大,但是因为后者无法控制在低温环境下进行,所以同样不是最佳选择。采用优化方法处理的样品经GCMS分析后共鉴定到了223种的代谢物,包含了15种氨基酸、21种糖类、76种有机酸等多类重要的代谢物质。
4 结 论
本研究以枯草芽孢杆菌的代谢组为研究对象,比较了不同淬灭剂、细胞破碎方法和衍生时间条件下代谢组分析结果,最终确定了枯草芽孢杆菌代谢组样品的最适前处理方法:采用预冷的60%甲醇0.9% (NH4)2CO3溶液淬灭、珠磨法破碎细胞,细胞破碎物使用OBis\[三甲基硅烷\]三氟乙酸盐(MSTFA)衍生2.0 h。采用本方法从枯草芽孢杆菌中共鉴定到223种代谢物,包括大量的氨基酸、有机酸和糖类物质。本工作为工业微生物枯草芽孢杆菌的代谢组研究建立了重要的方法基础,有助于开展更深入的代谢机制相关研究。
References
1 Koal T, Deigner H P. Curr. Mol. Med., 2010, 10(2): 216-226
2 XIA JianFei, LIANG QiongLin, HU Ping, WANG YiMing, LUO GuoAn. Chinese J. Anal. Chem., 2009, 37(1): 136-143
夏建飞, 梁琼麟, 胡 坪, 王义明, 罗国安. 分析化学, 2009, 37(1): 136-143
3 Canelas A B, ten Pierick A, Ras C, Seifar R M, van Dam J C, van Gulik W M, Heijnen J J. Anal. Chem., 2009, 81(17): 7379-7389
4 Enot D P, Haas B, Weinberger K M. Methods Mol. Biol., 2011, 719: 351-375
5 Zenobi R. Science, 2013, 342(6163): 1243259
6 Spura J, Christian Reimer L, Wieloch P, Schreiber K, Buchinger S, Schomburg D. Anal. Biochem., 2009, 394(2): 192-201
7 Krall L, Huege J, Catchpole G, Steinhauser D, Willmitzer L. J. Chromatogr. B, 2009, 877(27): 2952-2960
8 Johnson, C H, Gonzalez F J. J. Cell Physiol., 2012, 227(8): 2975-2981
9 TaymazNikerel H, de Mey M, Ras C, ten Pierick A, Seifar R M, van Dam J C, Heijnen J J, van Gulik W M. Anal. Biochem., 2009, 386(1): 9-19
10 Winder C L, Dunn W B. Schuler S, Broadhurst D, Jarvis R, Stephens G M, Goodacre R. Anal. Chem., 2008, 80(8): 2939-2948
11 Dettmer K, Aronov P A, Hammock B D. Mass Spectrom. Rev., 2007, 26(1): 51-78
12 VillasBoas S G, Bruheim P. Anal. Biochem., 2007, 370(1): 87-97
13 Wittmann C, Kromer J O, Kiefer P, Binz T, Heinzle E. Anal. Biochem., 2004, 327: 135-139
14 Spura J, Reimer L C, Wieloch P, Schreiber K, Buchinger S, Schomburg D. Anal. Biochem., 2009, 394(2): 192-201
15 VillasBoas S G, HojerPedersen J, Akesson M, Smedsgaard J, Nielsen J. Yeast, 2005, 22(14): 1155-1169
16 Meyer H, Liebeke M, Lalk M. Anal. Biochem., 2010, 401(2): 250-259
17 Ding M Z, Cheng J S, Xiao W H, Qiao B, Yuan Y J. Metabolomics, 2009, 5(2): 229-238
18 Jozefczuk S, Klie S, Catchpole G, Szymanski J, CuadrosInostroza A, Steinhauser D, Selbig J, Willmitzer L. Mol. Syst. Biol., 2010, 6: 364-379
19 Zhao C, Nambou K, Wei L J, Chen J, Imanaka T, Hua Q. Biochem. Engineer. J., 2014, 82: 63-70
20 Jige A J, Trygg J, Gullberg J, Johansson A I, Jonsson P, Antti H, Marklund S L, Moritz T. Anal. Chem., 2005, 77(24): 8086-8094
21 Casals G, Marcos J, Pozo O J, Alcaraz J, Martinez de Osaba M J, Jimenez W. J. Chromatogr. B, 2014, 960: 8-13
22 van Dijl J M, Hecker M. Microb. Cell Fact., 2013, 12: 3-8
23 Meyer H, Weidmann H, Lalk M. Microb. Cell Fact., 2013, 12: 69-81
24 Xin L, Dan L, Jian J, Yang W M, Zeng Z R, Guo S D, Qi G F, Chen S W. J. Microbiol. Methods, 2013, 94(1): 61-67
25 Zeng M M, Xiao Y, Liang Y Z, Wang B, Chen X, Cao D S, Li H D, Wang M, Zhou Z G. Metabolomics, 2010, 6(2): 303-311
Abstract An appropriate sample pretreatment method is crucial to the metabolomic analysis. Till now, many different sample pretreatment techniques for microbial metabolomics have been reported, but it is not clear which one is suitable for sample preparation for metabolomic analysis of Bacillus Subtilis. To improve the quality of metabolomic analysis of B. subtilis based on gas chromatographymass spectrometry (GCMS), in this study, the leakage of intracellular metabolites with five different quenching solvents was compared, and it was found that 60% methanol/0.9% (NH4)2CO3 and 60% methanol/0.9% NaAC had the least leakage. The effects of different cell disruption methods including beadmilling, liquid nitrogen grounding and ultrasonication on the extraction of metabolites were compared. The beadmilling method exhibited the highest extraction efficiency. The effects of derivatization time (0.5-2.5 h) on relative abundance of metabolite distribution were also investigated and it was found that 2 and 2.5 h were adequate for derivatization. The optimal sample pretreatment method for metabolomic analysis of B. subtilis was determined as follows: 60% methanol/0.9% (NH4)2CO3 as quencher, glass bead breaker used for cell disruption and the derivatization time of 2 h. With this method, 223 metabolites in B. subtilis. were identified by GCMS, including a large number of amino acids, organic acids and carbohydrates. This study lays the foundation for the comprehensive Metabolomics analysis of Bacillus Subtilis.
Keywords Metabolomics; Bacillus Subtilis; Gas chromatographymass spectrometry; Pretreatment
(Received 26 January 2015; accepted 4 June 2015)



摘 要 本研究比较了不同淬灭剂(甲醇、60%甲醇、60%甲醇0.9% NaCl、60%甲醇0.9% (NH4)2CO3和60%甲醇0.9% NaAc)条件下胞内物质核酸、蛋白质和代谢物的渗漏情况,发现60%甲醇0.9%(NH4)2CO3和60%甲醇0.9% NaAc渗漏最少;比较了珠磨法、液氮研磨法、超声破碎3种细胞破碎方法条件下代谢物的提取效果,发现珠磨法提取效果最佳;比较了不同衍生时间(0.5~2.5 h)下代谢物相对丰度的变化,发现衍生时间达到2.0 h后,代谢物丰度不再有显著变化。最终确定了枯草芽孢杆菌代谢组样品最适前处理方法:预冷的60%甲醇0.9%(NH4)2CO3淬灭, 珠磨法破碎细胞, 细胞破碎物用OBis\[三甲基硅烷\]三氟乙酸盐(MSTFA)衍生2 h。采用本方法从枯草芽孢杆菌中共鉴定到223种代谢物,包括大量氨基酸、有机酸和糖类物质。本研究为枯草芽孢杆菌的代谢组学研究提供了基础。
关键词; 代谢组学; 枯草芽孢杆菌; 气相色谱质谱联用; 前处理
1 引 言
微生物代谢组学旨在分析微生物体系中所有的代谢物。由于代谢物结构的多样性及其浓度分布范围的宽广性,检测尽可能多的代谢物及其含量始终是一个巨大的技术挑战[1,2]。尽管代谢组分析技术近年来获得了快速发展[3~5],但是在代谢组样品制备环节仍然存在诸多问题[6~11]。代谢组学分析技术主要包括核磁共振(NMR)、气相色谱质谱联用(GCMS)和液相色谱质谱联用(LCMS)技术。NMR技术具有样品处理简单、样品破坏性小等优点,但是相比质谱技术灵敏度较低,检测动态范围比较窄。LCMS技术的代谢物适合范围广,可以与多种质谱联用,灵活性和普适性好,但是缺乏完备成熟的标准谱图库,难以高效准确地鉴定代谢物。采用GCMS技术,难挥发性样品需要衍生化,样品处理相对繁琐,但是其有最完整的标准图库,代谢物谱图可检索性较强,定性鉴定方便,因此在代谢组学研究中应用广泛。
基于GCMS的代谢组学分析方法,其样品前处理环节包括淬灭、破碎提取和衍生等步骤,各个步骤对分析质量都有较大的影响。理论上, 一种代谢组样品处理方法无法适合于所有种类的的微生物,因为不同种类微生物的细胞结构不同。目前, 关于微生物代谢组研究有许多报道,但所采用的样品处理方法在细胞淬灭、破碎和衍生化等步骤存在诸多差异。如在样品淬灭环节采用不同的溶剂,主要是60%甲醇或者在60%甲醇中添加一定比例的盐[12~14]。液氮冷冻也是细胞淬灭的常用方法[14],但主要用于动植物组织样品的处理,由于该法无法分开胞内外物质,因此不适于微生物代谢组的研究。细胞破碎方法,主要有珠磨法、超声破碎法和液氮研磨法等[15,16]。在样品衍生化环节可以采用不同的衍生试剂,其中OBis[三甲基硅烷]三氟乙酸盐(MSTFA)作为衍生剂使用比较广泛,文献报道中其衍生时间不尽相同[17~21]。
枯草芽孢杆菌是一种重要的工业微生物[22],广泛应用于蛋白酶和淀粉酶等酶制剂的生产、废水处理、饲料和益生菌行业,同时它也是基础研究领域重要的模式微生物,常用于研究芽孢的形成机制。因此,枯草芽孢杆菌代谢组学研究具有重要意义,但目前有关其代谢组学的研究报道较少,在Meyer等[23]对枯草芽孢杆菌的代谢组分析研究中,并没有对前处理方法展开深入研究。哪些方法更适合于工业微生物枯草芽孢杆菌的研究并没有相关的研究报道。本研究在淬灭、破碎提取和衍生3个重要环节对样品前处理方法进行了比较研究,确定最适合枯草芽孢杆菌的代谢组学研究的样品前处理方法,为枯草芽孢杆菌代谢组学分析研究提供技术支持。
2 实验部分
2.1 仪器与试剂
JY92II DN超声波细胞粉碎机(宁波新艺超声设备有限公司);Precellys 24多功能样品均质器(法国Bertin Technologies 公司);MilliQ Advantage A10超纯水制备系统(美国Millipore公司);7890 A 型气相色谱5975 C型四极杆质谱联用仪(美国Agilent公司);TU1810系列紫外可见分光光度计(北京普析通用有限公司)。
枯草芽孢杆菌AS1.398取自天津科技大学菌种保藏中心。色谱级十五烷酸、甲氧胺盐酸盐、添加有1% 三甲基氯硅烷(TMCS)的MSTFA购自Sigma公司;色谱纯乙腈、甲醇和吡啶购自天津康科德科技公司; NaCl、(NH4)2CO3和NaAc为分析纯,购自天津博欧特化工贸易有限公司;蛋白胨和酵母提取物购自英国Oxoid公司;实验用水为MilliQ超纯水。
2.2 实验方法
2.2.1 菌体培养 枯草芽孢杆菌 AS1.398采用LB液体培养基(1% NaCl,1% 蛋白胨,0.5% 酵母提取物),37℃过夜培养至对数生长期(A600≈2.2)时取样处理。
2.2.2 样品前处理 取培养的菌液10 mL,快速加入30 mL于
2.2.3 GCMS分析 使用气相色谱四极杆质谱联用仪对衍生的样品进行GCMS分析。对于GCMS分析,初始温度70℃,维持4 min,以3℃/min升到133℃,再以2℃/min升到200℃,再以3℃/min升到220℃,最后以5℃/min升到260℃。样口温度:270℃;接口温度:280℃;离子化方式:电子轰击(EI),温度230℃,电子能量70 eV;四极杆温度 150℃,质谱扫描范围为m/z 85~500。色谱条件:Agilent HP5 毛细管柱(30 m×250 μm× 0.25 μm),载气:高纯氦气;载气流速:l.0 mL/min;进样方式:不分流;进样量: 1 μL。测定结果通过安捷伦Chemistation软件内置的检索程序检索Nist08 数据库,结果中匹配度大于900且可能性大于85%的物质作为相对可靠的鉴定结果,通过内标法进行相对定量。
2.2.4 不同淬灭剂处理效果的比较 参考文献报道的淬灭剂进行淬灭处理,并通过检测核酸蛋白渗出和代谢物渗出比较淬灭效果,淬灭剂分别是甲醇、60%甲醇、60%甲醇0.9% NaCl、60%甲醇0.9% (NH4)2CO3和60%甲醇0.9% NaAc[12~14, 24,25]。每种淬灭剂平行处理3个样品。取10 mL培养的菌液,在4℃以6000 r/min离心10 min,弃去上清液,用0.9% NaCl溶液润洗菌体一次。将润洗后的菌体细胞分别重悬在2 mL
Symbolm@@ 40℃ 预冷的4种淬灭剂和阴性对照(2 mL 0.9% NaCl)中,在4℃以6000 r/min离心10 min,收集上清液。测定上清液在260和280 nm的吸光度,分别反映胞内核酸和蛋白质的渗出量。使用衍生后GCMS分析的方法测定上清液中的代谢物,反映胞内代谢物渗出情况,检测方法同2.2.3节,衍生时间选择2.0 h。
2.2.5 不同细胞破碎方法的比较 取10 mL培养的菌液,样品处理方法同2.2.4节,分别采用下列3种方法破碎细胞,其中淬灭剂采用60%甲醇/0.9%NaCl,衍生时间为2 h。衍生后GCMS分析代谢物的方法同2.2.3。每种破碎方法进行3次平行实验
3 结果与讨论
3.1 不同淬灭剂处理效果的比较
微生物细胞内存在许多周转率很高的代谢物,如ATP、ADP、6磷酸葡萄糖等。为了准确反映取样时细胞真实的代谢状态,取样后必须立刻通过细胞淬灭终止菌体代谢。同时又要防止对细胞结构造成较大破坏,以免代谢物大量渗出影响胞内代谢物的检测。因此,适合的淬灭剂既要有较高的淬灭效率,又要渗出较少的代谢物。低温的60%甲醇被证明可以有效淬灭细胞代谢[13],常在其中添加盐(如NaCl、(NH4)2CO3和NaAc等)以降低代谢物渗出。
3.2 不同细胞破碎方法的比较
理想的细胞破碎方法不仅要考虑细胞破碎率,还应该无偏向性地将所有代谢物最大程度地释放出来,同时保持破碎提取过程中代谢物不发生改变。为保证代谢产物的稳定,破碎过程中应使酶处于持续失活状态。图2A显示了3种细胞破碎方法得到的代谢物鉴定结果的比较,可以看出,珠磨法所得样品中鉴定到的代谢物种类最多,总共202种,超声破碎法略少,为188种,而液氮研磨法鉴定到的代谢物种类最少,仅为86种;仅在珠磨法或超声破碎法样品中鉴定到的代谢物数量分别为30种和16种,而两种方法共同鉴定到的代谢物种类数量为172种,占据了各自的大多数。图2B给出了不同破碎条件下氨基酸的检测结果,可以看出,珠磨法和超声破碎法相比液氮研磨法不仅鉴定到了更多的氨基酸种类,而且对于共同检测到的氨基酸,前者检测到的含量也比后者要高。超声破碎过程只能在冰浴条件下进行,无法达到更低的温度,会影响酶的失活效果和提取过程中代谢物的稳定性。液氮研磨法虽然具有极低的细胞破碎温度,保证了代谢物的稳定,但是人为操作因素较多,细胞破碎效率和样品回收的重复性难以保证。相比而言,珠磨法不仅具有较少的人为操作影响和较高的细胞破碎效率,而且液氮提供的超低温环境保证了破碎过程中代谢物的稳定性。
3.3 衍生时间对代谢物分析结果的影响
MSTFA是基于GCMS的代谢组研究中广泛采用的衍生剂,添加的1%的TMCS可以催化难以硅烷化的化合物以及一些与单独的MSTFA无法发生衍生反应的羟基发生反应,从而提高衍生效率[19]。MSTFA衍生过程中产生的副产物及其自身通常是与溶剂前沿一起洗脱的,适用于分析小分子物质。由于定量检测是以衍生化为基础,充分的衍生是可靠定量的前提。本研究对比了衍生化时间为0.5, 1.0, 1.5, 2.0和2.5 h时样品的分析结果,发现衍生时间达到2.0 h之后,代谢物在丰度上不再有明显的变化。图3显示了不同衍生时间下部分有机酸和糖类代谢物的检测结果,可以看出,衍生0.5 h时大多数物质浓度较低且有多种物质无法检测到,而衍生2.0和2.5 h时检测到的这些物质的浓度最高,且二者之间没有显著差异。
3.4 样品前处理最适方法的确定
通过对不同淬灭剂、细胞破碎方法和衍生时间条件下代谢组分析结果的比较,最终选择预冷的60%甲醇/0.9%(NH4)2CO3溶液淬灭、珠磨法破碎细胞和MSTFA衍生2.0 h进行枯草芽孢杆菌代谢组样品的前处理。60%甲醇0.9% (NH4)2CO3和60%甲醇0.9%NaAc的淬灭效果比较接近,但是 (NH4)2CO3作为挥发性盐同样适合LCMS代谢组学分析的要求,而NaAc并不适合。代谢组学研究经常同时采用GCMS和LCMS两种分析方案进行互补,故最终选择前者作为淬灭剂。超声破碎法所得样品中鉴定到的代谢物数量与珠磨法差别不大,但是因为后者无法控制在低温环境下进行,所以同样不是最佳选择。采用优化方法处理的样品经GCMS分析后共鉴定到了223种的代谢物,包含了15种氨基酸、21种糖类、76种有机酸等多类重要的代谢物质。
4 结 论
本研究以枯草芽孢杆菌的代谢组为研究对象,比较了不同淬灭剂、细胞破碎方法和衍生时间条件下代谢组分析结果,最终确定了枯草芽孢杆菌代谢组样品的最适前处理方法:采用预冷的60%甲醇0.9% (NH4)2CO3溶液淬灭、珠磨法破碎细胞,细胞破碎物使用OBis\[三甲基硅烷\]三氟乙酸盐(MSTFA)衍生2.0 h。采用本方法从枯草芽孢杆菌中共鉴定到223种代谢物,包括大量的氨基酸、有机酸和糖类物质。本工作为工业微生物枯草芽孢杆菌的代谢组研究建立了重要的方法基础,有助于开展更深入的代谢机制相关研究。
References
1 Koal T, Deigner H P. Curr. Mol. Med., 2010, 10(2): 216-226
2 XIA JianFei, LIANG QiongLin, HU Ping, WANG YiMing, LUO GuoAn. Chinese J. Anal. Chem., 2009, 37(1): 136-143
夏建飞, 梁琼麟, 胡 坪, 王义明, 罗国安. 分析化学, 2009, 37(1): 136-143
3 Canelas A B, ten Pierick A, Ras C, Seifar R M, van Dam J C, van Gulik W M, Heijnen J J. Anal. Chem., 2009, 81(17): 7379-7389
4 Enot D P, Haas B, Weinberger K M. Methods Mol. Biol., 2011, 719: 351-375
5 Zenobi R. Science, 2013, 342(6163): 1243259
6 Spura J, Christian Reimer L, Wieloch P, Schreiber K, Buchinger S, Schomburg D. Anal. Biochem., 2009, 394(2): 192-201
7 Krall L, Huege J, Catchpole G, Steinhauser D, Willmitzer L. J. Chromatogr. B, 2009, 877(27): 2952-2960
8 Johnson, C H, Gonzalez F J. J. Cell Physiol., 2012, 227(8): 2975-2981
9 TaymazNikerel H, de Mey M, Ras C, ten Pierick A, Seifar R M, van Dam J C, Heijnen J J, van Gulik W M. Anal. Biochem., 2009, 386(1): 9-19
10 Winder C L, Dunn W B. Schuler S, Broadhurst D, Jarvis R, Stephens G M, Goodacre R. Anal. Chem., 2008, 80(8): 2939-2948
11 Dettmer K, Aronov P A, Hammock B D. Mass Spectrom. Rev., 2007, 26(1): 51-78
12 VillasBoas S G, Bruheim P. Anal. Biochem., 2007, 370(1): 87-97
13 Wittmann C, Kromer J O, Kiefer P, Binz T, Heinzle E. Anal. Biochem., 2004, 327: 135-139
14 Spura J, Reimer L C, Wieloch P, Schreiber K, Buchinger S, Schomburg D. Anal. Biochem., 2009, 394(2): 192-201
15 VillasBoas S G, HojerPedersen J, Akesson M, Smedsgaard J, Nielsen J. Yeast, 2005, 22(14): 1155-1169
16 Meyer H, Liebeke M, Lalk M. Anal. Biochem., 2010, 401(2): 250-259
17 Ding M Z, Cheng J S, Xiao W H, Qiao B, Yuan Y J. Metabolomics, 2009, 5(2): 229-238
18 Jozefczuk S, Klie S, Catchpole G, Szymanski J, CuadrosInostroza A, Steinhauser D, Selbig J, Willmitzer L. Mol. Syst. Biol., 2010, 6: 364-379
19 Zhao C, Nambou K, Wei L J, Chen J, Imanaka T, Hua Q. Biochem. Engineer. J., 2014, 82: 63-70
20 Jige A J, Trygg J, Gullberg J, Johansson A I, Jonsson P, Antti H, Marklund S L, Moritz T. Anal. Chem., 2005, 77(24): 8086-8094
21 Casals G, Marcos J, Pozo O J, Alcaraz J, Martinez de Osaba M J, Jimenez W. J. Chromatogr. B, 2014, 960: 8-13
22 van Dijl J M, Hecker M. Microb. Cell Fact., 2013, 12: 3-8
23 Meyer H, Weidmann H, Lalk M. Microb. Cell Fact., 2013, 12: 69-81
24 Xin L, Dan L, Jian J, Yang W M, Zeng Z R, Guo S D, Qi G F, Chen S W. J. Microbiol. Methods, 2013, 94(1): 61-67
25 Zeng M M, Xiao Y, Liang Y Z, Wang B, Chen X, Cao D S, Li H D, Wang M, Zhou Z G. Metabolomics, 2010, 6(2): 303-311
Abstract An appropriate sample pretreatment method is crucial to the metabolomic analysis. Till now, many different sample pretreatment techniques for microbial metabolomics have been reported, but it is not clear which one is suitable for sample preparation for metabolomic analysis of Bacillus Subtilis. To improve the quality of metabolomic analysis of B. subtilis based on gas chromatographymass spectrometry (GCMS), in this study, the leakage of intracellular metabolites with five different quenching solvents was compared, and it was found that 60% methanol/0.9% (NH4)2CO3 and 60% methanol/0.9% NaAC had the least leakage. The effects of different cell disruption methods including beadmilling, liquid nitrogen grounding and ultrasonication on the extraction of metabolites were compared. The beadmilling method exhibited the highest extraction efficiency. The effects of derivatization time (0.5-2.5 h) on relative abundance of metabolite distribution were also investigated and it was found that 2 and 2.5 h were adequate for derivatization. The optimal sample pretreatment method for metabolomic analysis of B. subtilis was determined as follows: 60% methanol/0.9% (NH4)2CO3 as quencher, glass bead breaker used for cell disruption and the derivatization time of 2 h. With this method, 223 metabolites in B. subtilis. were identified by GCMS, including a large number of amino acids, organic acids and carbohydrates. This study lays the foundation for the comprehensive Metabolomics analysis of Bacillus Subtilis.
Keywords Metabolomics; Bacillus Subtilis; Gas chromatographymass spectrometry; Pretreatment
(Received 26 January 2015; accepted 4 June 2015)

