基于分子信标及核酸染料SYBR Green Ⅰ定量检测土壤中的汞
翟琨等
摘 要 利用分子信标、单链核酸(ssDNA)及核酸染料SYBR GreenⅠ,通过同步荧光分析法,建立了一种高灵敏、高选择性土壤汞(Hg2+)的定量检测方法。在该体系中,分子信标的荧光基团设计为荧光胺(FAM),分子信标的环设计为与ssDNA互补, 但有4个T碱基错配的序列。在Hg2+存在时,分子信标的环与ssDNA通过“THg2+T”特异性结合形成双链DNA,分子信标的茎被打开,荧光基团与猝灭基团分开,荧光恢复; 同时,核酸染料SYBR GreenⅠ与双链DNA作用,SYBR GreenⅠ的荧光信号显著增强。SYBR GreenⅠ与FAM的最大激发波长与最大发射波长都很接近,通过同步荧光分析法检测时,两种荧光染料的荧光峰重叠,荧光信号增强,可实现Hg2+的高灵敏检测。体系的最优检测条件为:缓冲溶液的pH=8.0,孵育温度为50℃, 孵育4 min, 缓冲溶液中NaCl的浓度为
1 引 言
汞(Hg)是有毒的重金属元素,在人体中具有累积效应和神经毒性,严重威胁着人类健康[1]。随着工业化、农业现代化及城市化进程的加快,大量的汞通过矿物开采、施肥及空气传播等方式进入农田,而土壤中的汞又通过“土壤植物人”的途径进入人体,对人类健康产生潜在的威胁[2]。
目前,定量检测汞的常用方法有原子发射光谱[3]、原子吸收分光光度法[4]、原子荧光[5]、色谱与光谱联用[6,7]及电感耦合等离子体质谱法[8]等。其中,很多方法需要较昂贵的仪器设备,不适合常规检测。
核酸染料SYBR GreenⅠ是一种不对称的菁类核酸染料,它本身的荧光信号很弱,与单链DNA几乎不发生作用,但它与双链DNA有很强的亲和性,且与双链DNA结合后,其荧光强度会显著增加。据报道,当核酸染料SYBR GreenⅠ与双链DNA结合后荧光强度会增加800倍以上,是目前所发现的最灵敏的核酸染料之一[9]。基于特异性的“THg2+T”结构对汞的检测方法已多有报道。Ono[10]及Wang[11]等分别基于“THg2+T”的特异性结构建立了高灵敏、高特异性的检测水中汞的方法。此后,各种基于“THg2+T”结构对汞的定量检测,进一步提高了这类方法的灵敏度、选择性及设备的便携性等[12~17]。尽管基于“THg2+T”结构对汞的定量检测方法较多,但方法的灵敏度并不令人满意。
本实验利用T碱基与Hg2+能特异性结合形成稳定“THg2+T”结构的特点,将分子信标的环设计成与单链DNA互补且T碱基错配的序列,荧光基团设计为荧光胺(FAM)当分子信标在Hg2+存在时,与富含T碱基的单链DNA通过“THg2+T”结构形成双链,再与核酸染料SYBR GreenⅠ作用,使体系的荧光显著增强。据此建立了一种高灵敏的Hg2+荧光定量检测方法,并将其应用于土壤样品的分析中。
2 实验部分
土壤样品为黄棕壤,取自湖北恩施白地坪汞矿附近表土(0~20 cm)。
2.2 实验方法
2.2.1 样品制备 将分子信标及单链核酸C分别溶解在磷酸盐缓冲液中,均配制成2×10
Symbolm@@ 7 mol/L的溶液,各取50 μL混合均匀后,再加入50 μL不同浓度的Hg(NO3)2溶液,加缓冲液至总体积为400 μL,50℃孵育4 min,冷却至室温,加入100 μL SYBR GreenⅠ工作液并在室温下反应10 min,然后检测体系的荧光。在所有的实验中,除文中标注或说明外,分子信标及单链核酸的浓度均为2×1Symbolm@@ 8 mol/L,Hg2+的浓度为4×10Symbolm@@ 8 mol/L。
土壤样品的消化:称取1.00 g样品,置于消解罐中,加入6 mL王水和4 mL 30% H2O2,密封后将消解罐放入微波炉中加热,升温程序为140℃保持30 min,160℃保持30 min,180℃保持25 min,样品消解完全后自然冷至室温。将样品消解液转移至100 mL容量瓶中,用1% HNO3定容,摇匀待测。在土壤样品中汞的测定及加标回收实验中,均取50 μL的待测溶液,按样品制备方法处理后进行测定。
2.2.2 Hg2+的检测
将制备好的样品放入比色皿中,用同步荧光分析法对Hg2+进行检测。同步扫描的波长间隔设置为25 nm,荧光分光光度计的激发及发射狭缝宽度均设置为10 nm。
3 结果与讨论
3.1 方法可行性分析
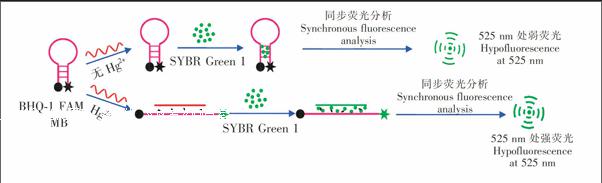
Hg2+的检测原理如图1所示。没有Hg2+时,分子信标的环与ssDNA中有多个TT错配碱基,不能形成双链结构,核酸染料SYBR GreenⅠ只与分子信标的茎(双链部分)作用,由于分子信标双链很短(只有6个碱基对),其荧光信号较弱; 在有Hg2+时,分子信标与富含T碱基的单链核酸通过“THg2+T”特异性结合形成双链DNA,与SYBR GreenⅠ的作用增强,其荧光信号显著放大; 同时,分子信标的茎环结构被破坏,荧光基团FAM与猝灭基团BHQ1分开,FAM的荧光恢复。SYBR GreenⅠ与FAM的最大激发波长与最大发射波长都很接近,它们的波长间隔(Δλ)也几乎相等,因此,当Hg2+通过同步荧光分析法进行检测时,两种荧光染料的荧光峰重叠,荧光信号显著增强,因此实现Hg2+的高灵敏检测。
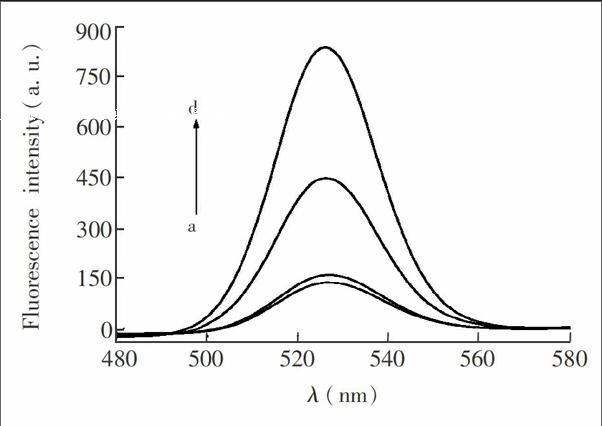
实验结果表明,只有分子信标和荧光染料SYBR GreenⅠ时,体系的荧光强度相对较弱(图2a); 在此体系中引入单链核酸(C),而没有Hg2+存在时,体系的荧光强度略有增加,但增加幅度很小(图2b); 当在上述体系中引入单链核酸,而又有Hg2+存在时,体系的荧光强度显著增加,且Hg2+浓度不同时,其所对应的荧光强度具有明显的区别(图2c和图2d),证明了利用上述原理对Hg2+定量检测的可行性。a, 分子信标+SYBR GreenⅠ; b, a+单链核酸; c, b+2.5×10Symbolm@@ 8 mol/L Hg2+; d, b+5×10Symbolm@@ 8 mol/L Hg2+。a, molecular beacon (MB)+SYBR GreenⅠ; b, a+single stranded DNA (ssDNA); c, b+2.5×10Symbolm@@ 8 mol/L Hg2+; d, b+5×10Symbolm@@ 8mol/L Hg2+
3.2 Hg2+测定条件的优化
3.2.1 加入SYBR GreenⅠ体积的优化 根据实验原理,SYBR GreenⅠ在分析体系中应该保持相对过量,但浓度过大又会产生大的背景信号。考察了实验中加入SYBR GreenⅠ工作液的体积对荧光检测信号的影响。结果表明,SYBR GreenⅠ工作液的体积在达到60 μL后,其荧光强度不再发生改变。为了保证实验过程中SYBR GreenⅠ相对过量,本实验选择其体积为100 μL。
3.2.2 pH值的影响 实验以磷酸盐缓冲液作为缓冲体系,考察pH值对测定结果的影响。结果表明,在pH 6.8~8.0范围内,体系的荧光强度随pH值增加而增大,随着pH值继续增加,荧光强度略有降低。本研究选择pH 8.0 的磷酸盐缓冲体系。
3.2.3 孵育温度和孵育时间的影响
加热孵育的目的是为了打开分子信标的茎(双链部分解链),从而加快分子信标与单链核酸反应的速度。体系在冷却过程中,分子信标与富含T碱基的单链核酸在Hg2+存在时,通过“THg2+T”特异性结合形成双链DNA。孵育时间设为4 min,考察孵育温度进行了考察。结果表明,反应温度在30℃~50℃时,体系的荧光强度随着温度的升高而增大; 当温度超过50℃后,体系的荧光强度几乎不变,说明在50℃时,分子信标的茎可以完全被打开。因此后续实验选择孵育温度为50℃。
孵育温度设为50℃,考察了孵育时间在2~10 min内的影响。体系的荧光强度随着时间延长而增加,当孵育时间超过4 min时,荧光强度趋于稳定,分子信标的茎已完全打开,因此孵育时间选择为4 min。
3.2.4 离子强度的影响 离子强度对双链DNA的形成具有明显的影响。通过加入不同浓度的NaCl考察离子强度对体系荧光强度的影响,结果表明,NaCl浓度在10~30 mmol/L之间时,体系的荧光强度随着NaCl浓度的增加而增大,当NaCl浓度超30 mmol/L后,其荧光强度略有下降,这主要是因为高浓度Cl-对荧光染料有猝灭作用[18]。本研究选择最适NaCl浓度为30 mmol/L。
3.3 最优条件下的工作曲线及检出限
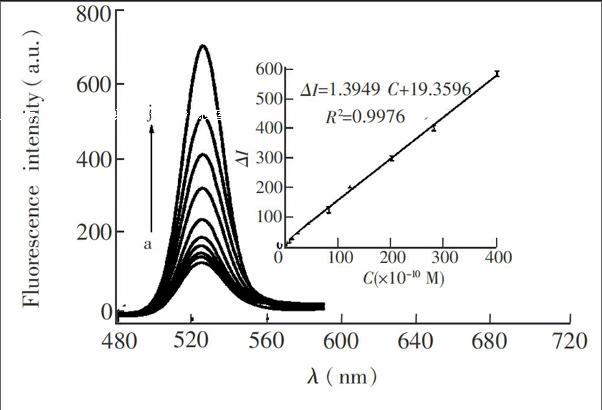
在最优实验条件下,即缓冲溶液的pH=8.0,孵育温度为50℃, 孵育时间为4 min, 缓冲溶液中NaCl的浓度为30 mmol/L,SYBR Green I工作液的体积为100SymbolmA@ L,测定不同浓度Hg2+存在时的体系荧光强度(图3)。Hg2+浓度在5×10Symbolm@@ 10~4×10
3.4 干扰实验
对土壤中常见的干扰离子Ca干扰实验的结果如图4所示,加入土壤中的干扰离子浓度为Hg2+浓度(4×10
Symbolm@@ 8 mol/L)1000倍时,Hg2+所对应的相对荧光强度仍远大于其它干扰离子,表明本方法法对土壤中Hg2+的检测具有很高的选择性。
3.5 土壤中汞含量的检测及加标回收实验
分别取4份相同的土壤样品,分别加入不同浓度Hg(NO3)2,按前述方法消化后,采用本法检测各样品中汞的含量(表1)。结果显示,本实验所测土壤样品中汞的含量为3.10 mg/kg,加标样品的回收率为97.7%~100.6%。
取2份相同的土壤样品,按前述方法消化后,分别用本方法和原子荧光法测定汞含量,结果分别为3.11和3.23 mg/kg(n=3), 两种方法测定结果基本相同,说明本方法具有较好的准确性。
3.5 土壤中汞含量的检测及加标回收实验
分别取4份相同的土壤样品,分别加入不同浓度Hg(NO3)2,按前述方法消化后,采用本法检测各样品中汞的含量(表1)。结果显示,本实验所测土壤样品中汞的含量为3.10 mg/kg,加标样品的回收率为97.7%~100.6%。
取2份相同的土壤样品,按前述方法消化后,分别用本方法和原子荧光法测定汞含量,结果分别为3.11和3.23 mg/kg(n=3), 两种方法测定结果基本相同,说明本方法具有较好的准确性。
4 结 论
本实验利用分子信标及含TT错配的碱基的单链核酸,结合核酸染料SYBR GreenⅠ,建立了一种土壤中Hg2+的定量检测方法。与以前报道的基于“THg2+T”结构测定汞的分析方法相比[10,16,17],本方法利用核酸染料SYBR GreenⅠ及分子信标的荧光基团所产生的荧光采用同步荧光法对汞进行检测,方法的灵敏度更高,检出限更低,而分子信标的引入,使方法的特异性增强,选择性更高。
References
1 Ekinci M, Ceylan E, Keles S, Cagatay H H, Apil A, Tanyildiz B, Uludag G. Med. Sci. Monitor, 2014, 20: 1284-1290
2 Leterme B, Blanc P, Jacques D. Environ. Sci. Pollut. R., 2014, 21(21): 12279-12293
3 Han F X X, Patterson W D, Xia Y J, Sridhar B B, Su Y. Water Air Soil Poll., 2006, 170(1): 161-171
4 HUANG ZhenNong, SUN Yi, RUAN XiaoLin, WU BangHua, ZHANG AiHua, HUANG JunYi, HUANG YanLing, HUANG HanLin. Spectroscopy and Spectral Analysis, 2014, 34(5): 1412-1415
黄振侬, 孙 毅, 阮小林, 吴邦华, 张爱华, 黄钧宜, 黄燕玲, 黄汉林. 光谱学与光谱分析, 2014, 34(5): 1412-1415
5 WANG Mei, LI Shan, ZHOU JianDong, XU Ying, LONG JunBiao, YANG BingYi. Spectroscopy and Spectral Analysis, 2014, 34(8): 2254-2258
王 梅, 李 姗, 周建栋, 徐 英, 龙军标, 杨冰仪. 光谱学与光谱分析, 2014, 34(8): 2254-2258
6 Yin Y G, Liu Y, Liu J F, He B, Jiang G B. Anal. Methods, 2012, 4(4): 1122-1125
7 GU YuXiao, MENG Mei, SHAO JunJuan, SHI JianBo, HE Bin, JIANG GuiBin. Chinese J. Anal. Chem., 2013, 41(11): 1754-1757
顾昱晓, 孟 梅, 邵俊娟, 史建波, 何 滨, 江桂斌. 分析化学, 2013, 41(11): 1754-1757
8 Chen X P, Han C, Cheng H Y, Wang Y C, Liu J H, Xu Z G, Hu L. J. Chromatogr. A, 2013, 1314: 86-93
9 Xiang D S, Zhai K, Xiang W J, Wang L Z. Talanta, 2014, 129: 249-253
10 Ono A, Togashi H. Angew. Chem. Int. Edit., 2004, 43(33): 4300-4302
11 Wang J, Liu B. Chem. Commun., 2008, 39: 4759-4761
12 Ge J, Li X P, Jiang J H, Yu R Q. Talanta, 2014, 122: 85-90
13 Ma F, Zhang Y, Qi H, Gao Q, Zhang C, Miao W. Biosens. Bioelectron., 2012, 32(1): 37-42
14 Stobiecka M, Molinero A A, Chalupa A, Hepel M. Anal. Chem., 2012, 84(11): 4970-4978
15 Zhang Y, Zhao H, Wu Z, Xue Y, Zhang X, He Y, Li X, Yuan Z. Biosens. Bioelectron., 2013, 48: 180-187
16 LEI ZhaoJing, ZHANG CunZheng, HU QiuHui, LIU Yuan, ZHANG Qiang, LIU XianJin. Chinese J. Anal. Chem., 2012, 40(12): 1827-1831
雷兆静, 张存政, 胡秋辉, 刘 媛, 张 强, 刘贤金. 分析化学, 2012, 40(12): 1827-1831
17 BO HongYan, HUANG ShaoFeng, ZENG WenJin, ZHANG Mi, DU QingLan, GUO QingYu, GAO Qiang. Chinese J. Anal. Chem., 2011, 39(12): 1893-1897
薄红艳, 黄绍峰, 曾文静, 张 宓, 杜青兰, 郭庆羽, 高 强. 分析化学, 2011, 39(12): 1893-1897
18 Gao XiangYang. Instrumental Analysis. Beijing: Science Press, 2009: 56
高向阳. 新编仪器分析(第三版). 北京: 科学出版社, 2009: 56
Abstract A highly sensitive and selective fluorescence method for quantitative detection of mercury in soil was developed based on molecular beacon (MB), singlestranded nucleic acid (ssDNA) and nucleic acid dye SYBR Green I by synchronous fluorescence analysis. In this strategy, the fluorophore of MB was 6carboxyfluorescein group (FAM), and the loop of MB was complementary to the ssDNA with four TT mismatches. In the presence of Hg2+, the MBs and ssDNA with TT mismatches formed doublestranded DNA (dsDNA) via THg2+T coordination structure, then the fluorophore FAM was separated from the quencher BHQ1, thus emitted fluorescence. Meanwhile, SYBR Green I bound to dsDNA, so the fluorescence intensity of SYBR Green I was significantly enhanced. When subjected to synchronous fluorescence analysis, the fluorescence peaks of FAM and SYBR Green I overlapped completely, so the fluorescence signal of system could be significantly enhanced. Thus, highly sensitive fluorescence quantitative detection for Hg2+could be realized. In this strategy, the optimal conditions for Hg2+ determination were as follows: buffer solution pH of 8.0, incubation temperature of 50℃, incubation time of 4 min, 30 mmol/L NaCl in buffer solution and the volume of SYBR Green I of 100 μL. Under the optimum conditions, the total fluorescence intensity of SYBR GreenⅠ and FAM exhibited a good linear dependence on quantity of Hg2+ in the range of 5.0×10
Symbolm@@ 10-400×10
Symbolm@@ 8 mol/L. The regression equation was ΔI=1.3949C+19.3596 with a correlation coefficient of 0.9976 (R2), where ΔI was the total fluorescence intensity difference in the presence and absence of Hg2+. The detection limit was 3×10
Symbolm@@ 10 mol/L (3σ, n=11). The proposed method exhibited good precision, high selection, simple operation, fast detection speed, low detection limit and high sensitivity. This method was applied to detect mercury ion in soil and a satisfactory recovery of 97.7%-100.6% was obtained. The detection result was consistent with that by atomic fluorescence spectrometric method.



摘 要 利用分子信标、单链核酸(ssDNA)及核酸染料SYBR GreenⅠ,通过同步荧光分析法,建立了一种高灵敏、高选择性土壤汞(Hg2+)的定量检测方法。在该体系中,分子信标的荧光基团设计为荧光胺(FAM),分子信标的环设计为与ssDNA互补, 但有4个T碱基错配的序列。在Hg2+存在时,分子信标的环与ssDNA通过“THg2+T”特异性结合形成双链DNA,分子信标的茎被打开,荧光基团与猝灭基团分开,荧光恢复; 同时,核酸染料SYBR GreenⅠ与双链DNA作用,SYBR GreenⅠ的荧光信号显著增强。SYBR GreenⅠ与FAM的最大激发波长与最大发射波长都很接近,通过同步荧光分析法检测时,两种荧光染料的荧光峰重叠,荧光信号增强,可实现Hg2+的高灵敏检测。体系的最优检测条件为:缓冲溶液的pH=8.0,孵育温度为50℃, 孵育4 min, 缓冲溶液中NaCl的浓度为
1 引 言
汞(Hg)是有毒的重金属元素,在人体中具有累积效应和神经毒性,严重威胁着人类健康[1]。随着工业化、农业现代化及城市化进程的加快,大量的汞通过矿物开采、施肥及空气传播等方式进入农田,而土壤中的汞又通过“土壤植物人”的途径进入人体,对人类健康产生潜在的威胁[2]。
目前,定量检测汞的常用方法有原子发射光谱[3]、原子吸收分光光度法[4]、原子荧光[5]、色谱与光谱联用[6,7]及电感耦合等离子体质谱法[8]等。其中,很多方法需要较昂贵的仪器设备,不适合常规检测。
核酸染料SYBR GreenⅠ是一种不对称的菁类核酸染料,它本身的荧光信号很弱,与单链DNA几乎不发生作用,但它与双链DNA有很强的亲和性,且与双链DNA结合后,其荧光强度会显著增加。据报道,当核酸染料SYBR GreenⅠ与双链DNA结合后荧光强度会增加800倍以上,是目前所发现的最灵敏的核酸染料之一[9]。基于特异性的“THg2+T”结构对汞的检测方法已多有报道。Ono[10]及Wang[11]等分别基于“THg2+T”的特异性结构建立了高灵敏、高特异性的检测水中汞的方法。此后,各种基于“THg2+T”结构对汞的定量检测,进一步提高了这类方法的灵敏度、选择性及设备的便携性等[12~17]。尽管基于“THg2+T”结构对汞的定量检测方法较多,但方法的灵敏度并不令人满意。
本实验利用T碱基与Hg2+能特异性结合形成稳定“THg2+T”结构的特点,将分子信标的环设计成与单链DNA互补且T碱基错配的序列,荧光基团设计为荧光胺(FAM)当分子信标在Hg2+存在时,与富含T碱基的单链DNA通过“THg2+T”结构形成双链,再与核酸染料SYBR GreenⅠ作用,使体系的荧光显著增强。据此建立了一种高灵敏的Hg2+荧光定量检测方法,并将其应用于土壤样品的分析中。
2 实验部分
土壤样品为黄棕壤,取自湖北恩施白地坪汞矿附近表土(0~20 cm)。
2.2 实验方法
2.2.1 样品制备 将分子信标及单链核酸C分别溶解在磷酸盐缓冲液中,均配制成2×10
Symbolm@@ 7 mol/L的溶液,各取50 μL混合均匀后,再加入50 μL不同浓度的Hg(NO3)2溶液,加缓冲液至总体积为400 μL,50℃孵育4 min,冷却至室温,加入100 μL SYBR GreenⅠ工作液并在室温下反应10 min,然后检测体系的荧光。在所有的实验中,除文中标注或说明外,分子信标及单链核酸的浓度均为2×1Symbolm@@ 8 mol/L,Hg2+的浓度为4×10Symbolm@@ 8 mol/L。
土壤样品的消化:称取1.00 g样品,置于消解罐中,加入6 mL王水和4 mL 30% H2O2,密封后将消解罐放入微波炉中加热,升温程序为140℃保持30 min,160℃保持30 min,180℃保持25 min,样品消解完全后自然冷至室温。将样品消解液转移至100 mL容量瓶中,用1% HNO3定容,摇匀待测。在土壤样品中汞的测定及加标回收实验中,均取50 μL的待测溶液,按样品制备方法处理后进行测定。
2.2.2 Hg2+的检测
将制备好的样品放入比色皿中,用同步荧光分析法对Hg2+进行检测。同步扫描的波长间隔设置为25 nm,荧光分光光度计的激发及发射狭缝宽度均设置为10 nm。
3 结果与讨论
3.1 方法可行性分析
Hg2+的检测原理如图1所示。没有Hg2+时,分子信标的环与ssDNA中有多个TT错配碱基,不能形成双链结构,核酸染料SYBR GreenⅠ只与分子信标的茎(双链部分)作用,由于分子信标双链很短(只有6个碱基对),其荧光信号较弱; 在有Hg2+时,分子信标与富含T碱基的单链核酸通过“THg2+T”特异性结合形成双链DNA,与SYBR GreenⅠ的作用增强,其荧光信号显著放大; 同时,分子信标的茎环结构被破坏,荧光基团FAM与猝灭基团BHQ1分开,FAM的荧光恢复。SYBR GreenⅠ与FAM的最大激发波长与最大发射波长都很接近,它们的波长间隔(Δλ)也几乎相等,因此,当Hg2+通过同步荧光分析法进行检测时,两种荧光染料的荧光峰重叠,荧光信号显著增强,因此实现Hg2+的高灵敏检测。
实验结果表明,只有分子信标和荧光染料SYBR GreenⅠ时,体系的荧光强度相对较弱(图2a); 在此体系中引入单链核酸(C),而没有Hg2+存在时,体系的荧光强度略有增加,但增加幅度很小(图2b); 当在上述体系中引入单链核酸,而又有Hg2+存在时,体系的荧光强度显著增加,且Hg2+浓度不同时,其所对应的荧光强度具有明显的区别(图2c和图2d),证明了利用上述原理对Hg2+定量检测的可行性。a, 分子信标+SYBR GreenⅠ; b, a+单链核酸; c, b+2.5×10Symbolm@@ 8 mol/L Hg2+; d, b+5×10Symbolm@@ 8 mol/L Hg2+。a, molecular beacon (MB)+SYBR GreenⅠ; b, a+single stranded DNA (ssDNA); c, b+2.5×10Symbolm@@ 8 mol/L Hg2+; d, b+5×10Symbolm@@ 8mol/L Hg2+
3.2 Hg2+测定条件的优化
3.2.1 加入SYBR GreenⅠ体积的优化 根据实验原理,SYBR GreenⅠ在分析体系中应该保持相对过量,但浓度过大又会产生大的背景信号。考察了实验中加入SYBR GreenⅠ工作液的体积对荧光检测信号的影响。结果表明,SYBR GreenⅠ工作液的体积在达到60 μL后,其荧光强度不再发生改变。为了保证实验过程中SYBR GreenⅠ相对过量,本实验选择其体积为100 μL。
3.2.2 pH值的影响 实验以磷酸盐缓冲液作为缓冲体系,考察pH值对测定结果的影响。结果表明,在pH 6.8~8.0范围内,体系的荧光强度随pH值增加而增大,随着pH值继续增加,荧光强度略有降低。本研究选择pH 8.0 的磷酸盐缓冲体系。
3.2.3 孵育温度和孵育时间的影响
加热孵育的目的是为了打开分子信标的茎(双链部分解链),从而加快分子信标与单链核酸反应的速度。体系在冷却过程中,分子信标与富含T碱基的单链核酸在Hg2+存在时,通过“THg2+T”特异性结合形成双链DNA。孵育时间设为4 min,考察孵育温度进行了考察。结果表明,反应温度在30℃~50℃时,体系的荧光强度随着温度的升高而增大; 当温度超过50℃后,体系的荧光强度几乎不变,说明在50℃时,分子信标的茎可以完全被打开。因此后续实验选择孵育温度为50℃。
孵育温度设为50℃,考察了孵育时间在2~10 min内的影响。体系的荧光强度随着时间延长而增加,当孵育时间超过4 min时,荧光强度趋于稳定,分子信标的茎已完全打开,因此孵育时间选择为4 min。
3.2.4 离子强度的影响 离子强度对双链DNA的形成具有明显的影响。通过加入不同浓度的NaCl考察离子强度对体系荧光强度的影响,结果表明,NaCl浓度在10~30 mmol/L之间时,体系的荧光强度随着NaCl浓度的增加而增大,当NaCl浓度超30 mmol/L后,其荧光强度略有下降,这主要是因为高浓度Cl-对荧光染料有猝灭作用[18]。本研究选择最适NaCl浓度为30 mmol/L。
3.3 最优条件下的工作曲线及检出限
在最优实验条件下,即缓冲溶液的pH=8.0,孵育温度为50℃, 孵育时间为4 min, 缓冲溶液中NaCl的浓度为30 mmol/L,SYBR Green I工作液的体积为100SymbolmA@ L,测定不同浓度Hg2+存在时的体系荧光强度(图3)。Hg2+浓度在5×10Symbolm@@ 10~4×10
3.4 干扰实验
对土壤中常见的干扰离子Ca干扰实验的结果如图4所示,加入土壤中的干扰离子浓度为Hg2+浓度(4×10
Symbolm@@ 8 mol/L)1000倍时,Hg2+所对应的相对荧光强度仍远大于其它干扰离子,表明本方法法对土壤中Hg2+的检测具有很高的选择性。
3.5 土壤中汞含量的检测及加标回收实验
分别取4份相同的土壤样品,分别加入不同浓度Hg(NO3)2,按前述方法消化后,采用本法检测各样品中汞的含量(表1)。结果显示,本实验所测土壤样品中汞的含量为3.10 mg/kg,加标样品的回收率为97.7%~100.6%。
取2份相同的土壤样品,按前述方法消化后,分别用本方法和原子荧光法测定汞含量,结果分别为3.11和3.23 mg/kg(n=3), 两种方法测定结果基本相同,说明本方法具有较好的准确性。
3.5 土壤中汞含量的检测及加标回收实验
分别取4份相同的土壤样品,分别加入不同浓度Hg(NO3)2,按前述方法消化后,采用本法检测各样品中汞的含量(表1)。结果显示,本实验所测土壤样品中汞的含量为3.10 mg/kg,加标样品的回收率为97.7%~100.6%。
取2份相同的土壤样品,按前述方法消化后,分别用本方法和原子荧光法测定汞含量,结果分别为3.11和3.23 mg/kg(n=3), 两种方法测定结果基本相同,说明本方法具有较好的准确性。
4 结 论
本实验利用分子信标及含TT错配的碱基的单链核酸,结合核酸染料SYBR GreenⅠ,建立了一种土壤中Hg2+的定量检测方法。与以前报道的基于“THg2+T”结构测定汞的分析方法相比[10,16,17],本方法利用核酸染料SYBR GreenⅠ及分子信标的荧光基团所产生的荧光采用同步荧光法对汞进行检测,方法的灵敏度更高,检出限更低,而分子信标的引入,使方法的特异性增强,选择性更高。
References
1 Ekinci M, Ceylan E, Keles S, Cagatay H H, Apil A, Tanyildiz B, Uludag G. Med. Sci. Monitor, 2014, 20: 1284-1290
2 Leterme B, Blanc P, Jacques D. Environ. Sci. Pollut. R., 2014, 21(21): 12279-12293
3 Han F X X, Patterson W D, Xia Y J, Sridhar B B, Su Y. Water Air Soil Poll., 2006, 170(1): 161-171
4 HUANG ZhenNong, SUN Yi, RUAN XiaoLin, WU BangHua, ZHANG AiHua, HUANG JunYi, HUANG YanLing, HUANG HanLin. Spectroscopy and Spectral Analysis, 2014, 34(5): 1412-1415
黄振侬, 孙 毅, 阮小林, 吴邦华, 张爱华, 黄钧宜, 黄燕玲, 黄汉林. 光谱学与光谱分析, 2014, 34(5): 1412-1415
5 WANG Mei, LI Shan, ZHOU JianDong, XU Ying, LONG JunBiao, YANG BingYi. Spectroscopy and Spectral Analysis, 2014, 34(8): 2254-2258
王 梅, 李 姗, 周建栋, 徐 英, 龙军标, 杨冰仪. 光谱学与光谱分析, 2014, 34(8): 2254-2258
6 Yin Y G, Liu Y, Liu J F, He B, Jiang G B. Anal. Methods, 2012, 4(4): 1122-1125
7 GU YuXiao, MENG Mei, SHAO JunJuan, SHI JianBo, HE Bin, JIANG GuiBin. Chinese J. Anal. Chem., 2013, 41(11): 1754-1757
顾昱晓, 孟 梅, 邵俊娟, 史建波, 何 滨, 江桂斌. 分析化学, 2013, 41(11): 1754-1757
8 Chen X P, Han C, Cheng H Y, Wang Y C, Liu J H, Xu Z G, Hu L. J. Chromatogr. A, 2013, 1314: 86-93
9 Xiang D S, Zhai K, Xiang W J, Wang L Z. Talanta, 2014, 129: 249-253
10 Ono A, Togashi H. Angew. Chem. Int. Edit., 2004, 43(33): 4300-4302
11 Wang J, Liu B. Chem. Commun., 2008, 39: 4759-4761
12 Ge J, Li X P, Jiang J H, Yu R Q. Talanta, 2014, 122: 85-90
13 Ma F, Zhang Y, Qi H, Gao Q, Zhang C, Miao W. Biosens. Bioelectron., 2012, 32(1): 37-42
14 Stobiecka M, Molinero A A, Chalupa A, Hepel M. Anal. Chem., 2012, 84(11): 4970-4978
15 Zhang Y, Zhao H, Wu Z, Xue Y, Zhang X, He Y, Li X, Yuan Z. Biosens. Bioelectron., 2013, 48: 180-187
16 LEI ZhaoJing, ZHANG CunZheng, HU QiuHui, LIU Yuan, ZHANG Qiang, LIU XianJin. Chinese J. Anal. Chem., 2012, 40(12): 1827-1831
雷兆静, 张存政, 胡秋辉, 刘 媛, 张 强, 刘贤金. 分析化学, 2012, 40(12): 1827-1831
17 BO HongYan, HUANG ShaoFeng, ZENG WenJin, ZHANG Mi, DU QingLan, GUO QingYu, GAO Qiang. Chinese J. Anal. Chem., 2011, 39(12): 1893-1897
薄红艳, 黄绍峰, 曾文静, 张 宓, 杜青兰, 郭庆羽, 高 强. 分析化学, 2011, 39(12): 1893-1897
18 Gao XiangYang. Instrumental Analysis. Beijing: Science Press, 2009: 56
高向阳. 新编仪器分析(第三版). 北京: 科学出版社, 2009: 56
Abstract A highly sensitive and selective fluorescence method for quantitative detection of mercury in soil was developed based on molecular beacon (MB), singlestranded nucleic acid (ssDNA) and nucleic acid dye SYBR Green I by synchronous fluorescence analysis. In this strategy, the fluorophore of MB was 6carboxyfluorescein group (FAM), and the loop of MB was complementary to the ssDNA with four TT mismatches. In the presence of Hg2+, the MBs and ssDNA with TT mismatches formed doublestranded DNA (dsDNA) via THg2+T coordination structure, then the fluorophore FAM was separated from the quencher BHQ1, thus emitted fluorescence. Meanwhile, SYBR Green I bound to dsDNA, so the fluorescence intensity of SYBR Green I was significantly enhanced. When subjected to synchronous fluorescence analysis, the fluorescence peaks of FAM and SYBR Green I overlapped completely, so the fluorescence signal of system could be significantly enhanced. Thus, highly sensitive fluorescence quantitative detection for Hg2+could be realized. In this strategy, the optimal conditions for Hg2+ determination were as follows: buffer solution pH of 8.0, incubation temperature of 50℃, incubation time of 4 min, 30 mmol/L NaCl in buffer solution and the volume of SYBR Green I of 100 μL. Under the optimum conditions, the total fluorescence intensity of SYBR GreenⅠ and FAM exhibited a good linear dependence on quantity of Hg2+ in the range of 5.0×10
Symbolm@@ 10-400×10
Symbolm@@ 8 mol/L. The regression equation was ΔI=1.3949C+19.3596 with a correlation coefficient of 0.9976 (R2), where ΔI was the total fluorescence intensity difference in the presence and absence of Hg2+. The detection limit was 3×10
Symbolm@@ 10 mol/L (3σ, n=11). The proposed method exhibited good precision, high selection, simple operation, fast detection speed, low detection limit and high sensitivity. This method was applied to detect mercury ion in soil and a satisfactory recovery of 97.7%-100.6% was obtained. The detection result was consistent with that by atomic fluorescence spectrometric method.

