基质辅助激光解吸电离飞行时间串联质谱法分析人乳β—酪蛋白新生儿体外消化模型多肽组
李相怡 方曦 任皓威 程琳 张拓 付国红 刘宁
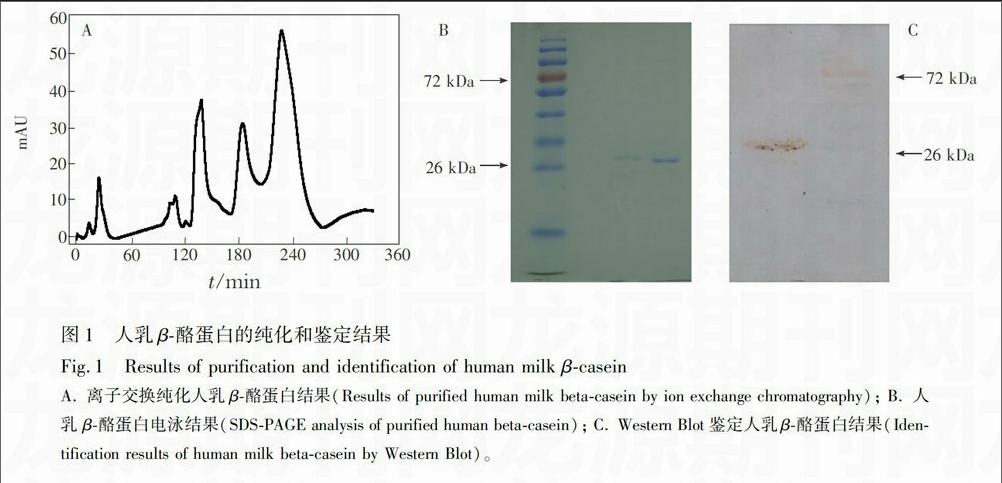
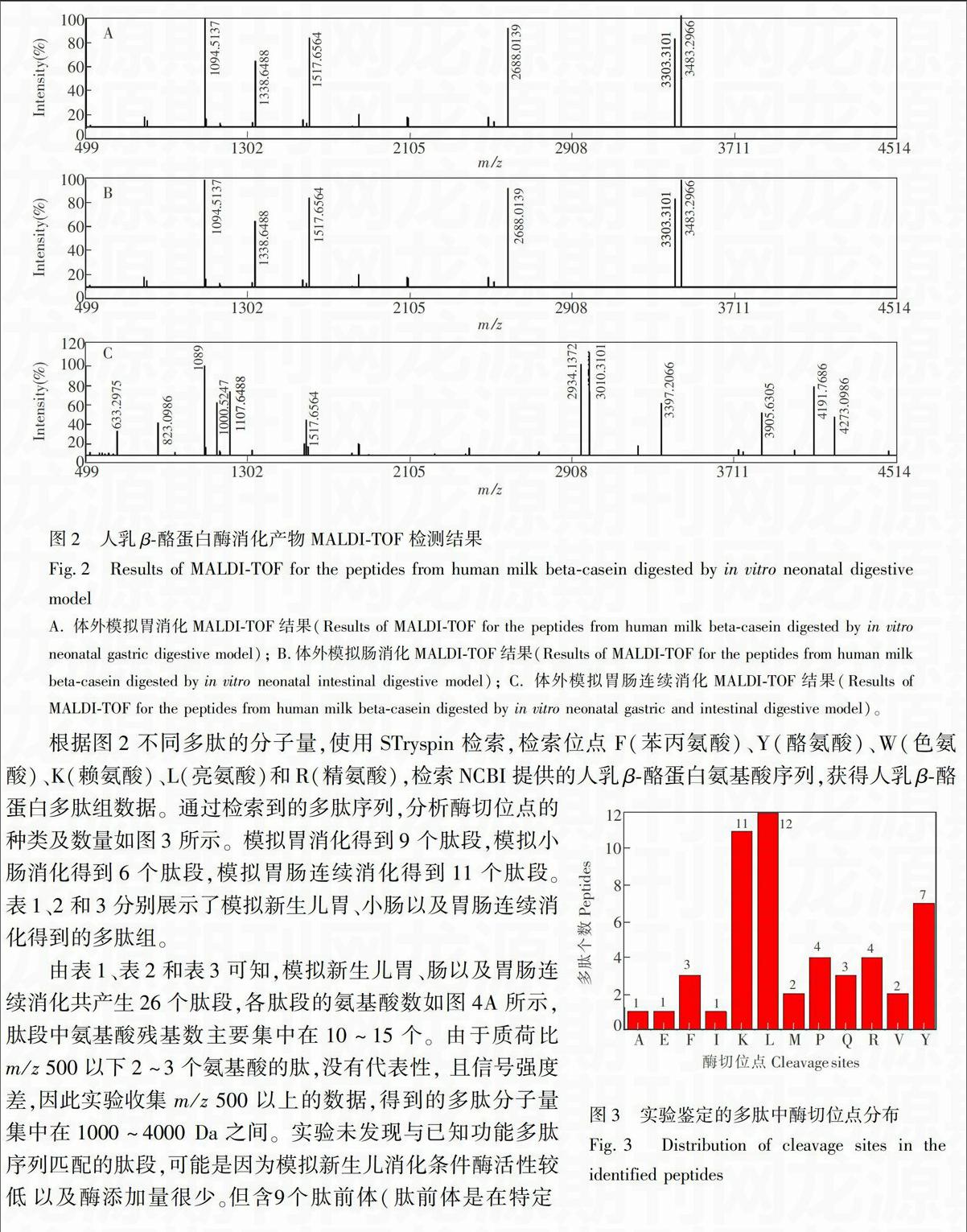
摘 要 通过体外模拟新生儿消化道条件,用基质辅助激光解吸离子化飞行时间串联质谱法(MALDI-TOF/TOF)探究人乳β-酪蛋白消化后的多肽组。在离子源加速电压为20 kV,激光波长337 nm,激光频率200 Hz,离子延迟提取时间330 ns,质谱信号单次扫描累加2000次条件下,扫描质量范围m/z 500~ 5000的肽段。结果表明,消化后得到26个肽段,分子量集中在1000~4000 Da。与已知功能的肽段序列进行对比,人乳β-酪蛋白在新生儿体外模型消化后未产生与已知功能的活性肽序列匹配的肽段,但发现9个肽前体,其中含4个血管紧张素转化酶 (ACE)抑制肽前体,2个酪蛋白磷酸肽(CPP)前体,2个抗氧化肽前体,1个免疫活性肽前体,由酶切位点推测分析,肽前体可以继续在蛋白酶作用下转化为生物活性肽。
关键词 β-酪蛋白; 新生儿; 体外消化; 多肽组; 基质辅助激光解吸电离飞行时间串联质谱
1 引 言
多肽组(Peptidome)是指器官、组织、细胞和体液中全部内源性多肽组分,包括生物体内具有特殊功能的活性多肽和蛋白质代谢产生的多肽【1~3】,多肽组学(peptidomics)研究的是多肽组的成分、功能、变化规律及其相关关系【2】,已应用于人体体液多肽组分析【4,5】。人乳以富含多种优质蛋白质以及活性肽等优点被公认是新生儿最好的食品,其中β-酪蛋白的含量为30%~35%【6~8】,是人乳中比重最大的酪蛋白【9,10】。本课题组在人乳β-酪蛋白(尤其是中国人乳β-酪蛋白)的鉴定和结构功能方面已开展了前期研究【11~13】。目前, 关于人乳β-酪蛋白的研究集中于对其消化产物的分离、鉴定和生物学功能方面【14~17】,还没有针对人乳β-酪蛋白消化后多肽组学的报道,而研究人乳β-酪蛋白消化后的多肽组可以为日后研发更适合婴幼儿的配方食品提供参考。婴儿(≤12月龄)尤其是新生儿(≤28日龄)的消化系统尚未发育成熟,代谢旺盛,但蛋白酶活性很低,胃蛋白酶活性和分泌量与婴儿生长发育的时间成正相关,而胰蛋白酶的活性以及分泌量在3~24月龄时也低于成年人【18,19】。本研究在普遍使用的婴儿体外消化方法【20】基础上,根据新生儿蛋白酶活性低的特点,建立了更适合研究新生儿体外消化的模型。以此模型消化人乳β-酪蛋白,用基质辅助激光解吸电离飞行时间串联质谱法分析其消化产物多肽组。
2 实验部分
2.1 仪器与试剂
GL-21M高速冷冻离心机(上海离心机械研究所); Delta320型pH计和AL204精密电子天平(瑞士梅特勒-托利多有限公司); 真空冷冻干燥机(上海医用仪器厂); DYY-10C型电泳仪和转膜仪(北京六一仪器); 凝胶成像系统(美国Bio-RAD公司); 蛋白质纯化仪AKTA purifer 100(美国GE公司); AB4700 MALDI TOF/TOF串联质谱仪(美国Applied Biosystems公司)。
DEAE-Sepharose Fast Flow葡聚糖凝胶(美国GE公司); ziptip C18层析柱(美国GE公司); 人乳采自中国汉族人乳; 胃蛋白酶、胰蛋白酶、尿素 (美国Sigma公司); 预染蛋白Marker(美国Thermo scientific公司); 30 %聚丙烯酰胺(北京Solarbio公司); 兔抗人β-酪蛋白抗体(美国Abcam公司); 增强型HRP-DAB底物显色试剂盒(Tiangen公司)。其它试剂均为分析纯; 实验用水为超纯水。
2.2 实验方法
2.2.1 人乳β-酪蛋白的纯化与鉴定 参照文献\低以及酶添加量很少。但含9个肽前体(肽前体是在特定
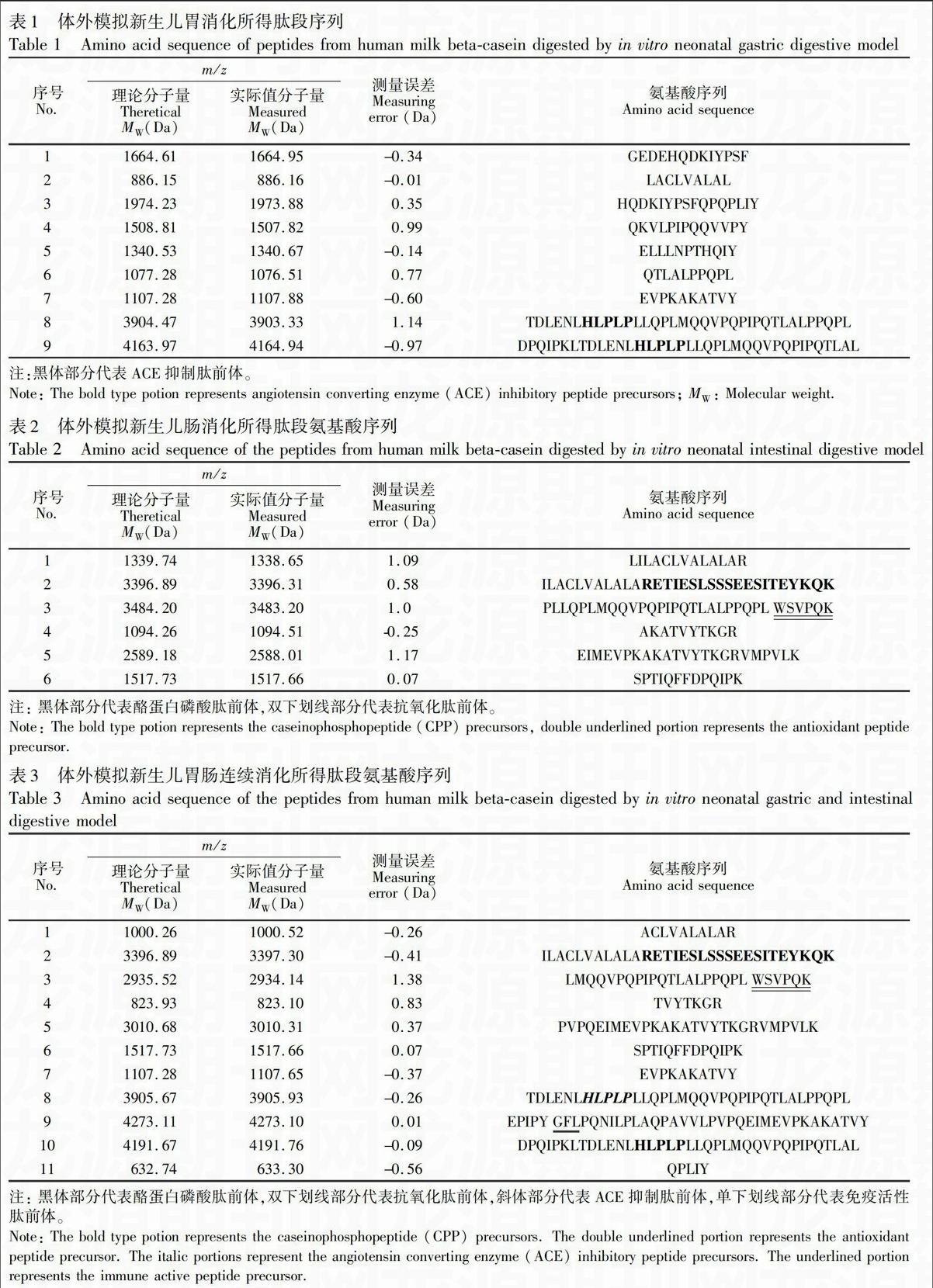
环境下,经蛋白酶消化可以转化为生物活性肽的多肽),其中酪蛋白磷酸肽前体2个,抗氧化肽前体2个,ACE抑制肽前体4个,免疫活性肽前体1个,各种多肽的功能分布见图4B。在图4C中,根据存在的酶切位点推测肽前体可以在胃蛋白酶或者羧肽酶B等作用下转化成活性肽(除黑色外,其它颜色的部分为活性肽序列),如第一个CPP前体可被蛋白酶K消化成CPP。
4 结 论
新生儿体外消化模型消化人乳β-酪蛋白,获得人乳β-酪蛋白多肽组数据,模拟胃消化得到9个肽段,模拟小肠消化得到6个肽段,模拟胃肠连续消化得到11个肽段。实验未发现与已知功能活性肽序列匹配的肽段; 但发现有9个肽前体,其中CCP肽前体2个,抗氧化肽前体2个,ACE抑制肽前体4个,免疫活性肽前体1个,由酶切位点推测分析肽前体可以继续在蛋白酶作用下转化为生物活性肽。这些多肽可能具有促进新生儿肠道菌群的建立及肠黏膜的发育等功能,具体的功能有待后续实验探究。
References
1 Schrader M, Schulz-Knappe P. Trends Biotechnol., 2001, 19(10): 55-60
2 Schulz-Knappe P, Schrader M, Zucht H D. Comb. Chem. & High Throughput Screening, 2005, 8(8): 697-704
3 Ji L, Barrett T, Ayanbule O, Troup DB, Rudnev D, Muertter R N, Tomashevsky M, Soboleva A, Slotta D J. Nucleic Acids Res., 2010, 38(database): 731-735
4 Zougman A, Pilch B, Podtelejnikov A, Kiehntopf M, Schnabel C, Kumar C, Mann M. J Proteome Res., 2008, 7(1): 386-399
5 Wan J, Cui X W, Zhang J, Fu Z Y, Guo X R, Sun L Z, Ji C B. Biochem. Biophys. Res. Commun., 2013, 438(1): 236-241
6 Hambraeus L, Lonnerdal B, Forsum E M, Gebre-medhin M. Acta. Paediatr. Scand., 1978, 67(5): 561-565
7 ZHANG Lan-Wei, ZHOU Xiao-Hong. China Dairy Industry, 1997, 25(3): 39-41
张兰威, 周晓红. 中国乳品工业, 1997, 25(3): 39-41
8 Carratu B, Boniglia C, Scalise F, Ambruzzi A M, Sanzini E. Food Chem., 2003, 81(3): 357-362
9 Chtourou A, Brignon G, Ribadeau-Dumas B. J. Dairy. Res., 1985, 52(2): 239-247
10 Picciano M F. Pediatr. Clin. North Am., 2001, 48(1): 263-264
11 HUANG Yu, REN Hao-Wei, LIU Biao, LIU Ning, LI Meng, WANG Dong-Mao. Chinese Journal of Chromatograph, 2013, 31(5): 429-434
黄 宇, 任皓威, 刘 彪, 刘 宁, 李 萌, 王东茂. 色谱, 2013, 31(5): 429-434
12 LIU Wei, LI Meng, REN Hao-Wei, LIU Ning. J. Spectroscopy and Spectral Anylysis, 2014, 34(12): 3281-3287
刘 微, 李 萌, 任皓威, 刘 宁. 光谱与光谱学分析, 2014, 34(12): 3281-3287
13 REN Hao-Wei, ZHANG Wan-Shu, LI Xiang-Yi, LIU Ning. Spectroscopy and Spectral Anylysis, 2015, 35(2): 384-389
任皓威, 张婉舒, 李相怡, 刘 宁. 光谱与光谱学分析, 2015, 35(2): 384-389
14 Yasuaki W, Bo L. J. Nutr. Biochem., 2014, 25(5): 503-514
15 Apollinaire T, Andrea R, Lyness B, Jean C L, Havard J, James K F. Food Chem., 2011, 126(3): 1138-1143
16 Mandal S M, Bharti R, Porto W F, Gauri S S, Mandal M, Franco O L, Ghosh A K. Peptides,2014, 56: 84-93
17 Puri A, Bhattacharya M, Tripathi L M, Haq W. Inter. Immunopharmacol., 2009, 9(9): 1092-1096
18 Richard A. P, William W.F, Steven H. A. Fetal and Neonatal Physiology. America: Saunders, 2011: 1241-1243
19 Agunod M, Yamaguchi N, Lopez R, Luhby L, George B, Jerzy G. Am. J. Dig. Dis., 1969, 14: 400-414
20 Johns P W. Analytical Method for the Determination of Infant Formula Protein Digestibility In vitro: United States, US 7939659B2. 2008-07-01



摘 要 通过体外模拟新生儿消化道条件,用基质辅助激光解吸离子化飞行时间串联质谱法(MALDI-TOF/TOF)探究人乳β-酪蛋白消化后的多肽组。在离子源加速电压为20 kV,激光波长337 nm,激光频率200 Hz,离子延迟提取时间330 ns,质谱信号单次扫描累加2000次条件下,扫描质量范围m/z 500~ 5000的肽段。结果表明,消化后得到26个肽段,分子量集中在1000~4000 Da。与已知功能的肽段序列进行对比,人乳β-酪蛋白在新生儿体外模型消化后未产生与已知功能的活性肽序列匹配的肽段,但发现9个肽前体,其中含4个血管紧张素转化酶 (ACE)抑制肽前体,2个酪蛋白磷酸肽(CPP)前体,2个抗氧化肽前体,1个免疫活性肽前体,由酶切位点推测分析,肽前体可以继续在蛋白酶作用下转化为生物活性肽。
关键词 β-酪蛋白; 新生儿; 体外消化; 多肽组; 基质辅助激光解吸电离飞行时间串联质谱
1 引 言
多肽组(Peptidome)是指器官、组织、细胞和体液中全部内源性多肽组分,包括生物体内具有特殊功能的活性多肽和蛋白质代谢产生的多肽【1~3】,多肽组学(peptidomics)研究的是多肽组的成分、功能、变化规律及其相关关系【2】,已应用于人体体液多肽组分析【4,5】。人乳以富含多种优质蛋白质以及活性肽等优点被公认是新生儿最好的食品,其中β-酪蛋白的含量为30%~35%【6~8】,是人乳中比重最大的酪蛋白【9,10】。本课题组在人乳β-酪蛋白(尤其是中国人乳β-酪蛋白)的鉴定和结构功能方面已开展了前期研究【11~13】。目前, 关于人乳β-酪蛋白的研究集中于对其消化产物的分离、鉴定和生物学功能方面【14~17】,还没有针对人乳β-酪蛋白消化后多肽组学的报道,而研究人乳β-酪蛋白消化后的多肽组可以为日后研发更适合婴幼儿的配方食品提供参考。婴儿(≤12月龄)尤其是新生儿(≤28日龄)的消化系统尚未发育成熟,代谢旺盛,但蛋白酶活性很低,胃蛋白酶活性和分泌量与婴儿生长发育的时间成正相关,而胰蛋白酶的活性以及分泌量在3~24月龄时也低于成年人【18,19】。本研究在普遍使用的婴儿体外消化方法【20】基础上,根据新生儿蛋白酶活性低的特点,建立了更适合研究新生儿体外消化的模型。以此模型消化人乳β-酪蛋白,用基质辅助激光解吸电离飞行时间串联质谱法分析其消化产物多肽组。
2 实验部分
2.1 仪器与试剂
GL-21M高速冷冻离心机(上海离心机械研究所); Delta320型pH计和AL204精密电子天平(瑞士梅特勒-托利多有限公司); 真空冷冻干燥机(上海医用仪器厂); DYY-10C型电泳仪和转膜仪(北京六一仪器); 凝胶成像系统(美国Bio-RAD公司); 蛋白质纯化仪AKTA purifer 100(美国GE公司); AB4700 MALDI TOF/TOF串联质谱仪(美国Applied Biosystems公司)。
DEAE-Sepharose Fast Flow葡聚糖凝胶(美国GE公司); ziptip C18层析柱(美国GE公司); 人乳采自中国汉族人乳; 胃蛋白酶、胰蛋白酶、尿素 (美国Sigma公司); 预染蛋白Marker(美国Thermo scientific公司); 30 %聚丙烯酰胺(北京Solarbio公司); 兔抗人β-酪蛋白抗体(美国Abcam公司); 增强型HRP-DAB底物显色试剂盒(Tiangen公司)。其它试剂均为分析纯; 实验用水为超纯水。
2.2 实验方法
2.2.1 人乳β-酪蛋白的纯化与鉴定 参照文献\低以及酶添加量很少。但含9个肽前体(肽前体是在特定
环境下,经蛋白酶消化可以转化为生物活性肽的多肽),其中酪蛋白磷酸肽前体2个,抗氧化肽前体2个,ACE抑制肽前体4个,免疫活性肽前体1个,各种多肽的功能分布见图4B。在图4C中,根据存在的酶切位点推测肽前体可以在胃蛋白酶或者羧肽酶B等作用下转化成活性肽(除黑色外,其它颜色的部分为活性肽序列),如第一个CPP前体可被蛋白酶K消化成CPP。
4 结 论
新生儿体外消化模型消化人乳β-酪蛋白,获得人乳β-酪蛋白多肽组数据,模拟胃消化得到9个肽段,模拟小肠消化得到6个肽段,模拟胃肠连续消化得到11个肽段。实验未发现与已知功能活性肽序列匹配的肽段; 但发现有9个肽前体,其中CCP肽前体2个,抗氧化肽前体2个,ACE抑制肽前体4个,免疫活性肽前体1个,由酶切位点推测分析肽前体可以继续在蛋白酶作用下转化为生物活性肽。这些多肽可能具有促进新生儿肠道菌群的建立及肠黏膜的发育等功能,具体的功能有待后续实验探究。
References
1 Schrader M, Schulz-Knappe P. Trends Biotechnol., 2001, 19(10): 55-60
2 Schulz-Knappe P, Schrader M, Zucht H D. Comb. Chem. & High Throughput Screening, 2005, 8(8): 697-704
3 Ji L, Barrett T, Ayanbule O, Troup DB, Rudnev D, Muertter R N, Tomashevsky M, Soboleva A, Slotta D J. Nucleic Acids Res., 2010, 38(database): 731-735
4 Zougman A, Pilch B, Podtelejnikov A, Kiehntopf M, Schnabel C, Kumar C, Mann M. J Proteome Res., 2008, 7(1): 386-399
5 Wan J, Cui X W, Zhang J, Fu Z Y, Guo X R, Sun L Z, Ji C B. Biochem. Biophys. Res. Commun., 2013, 438(1): 236-241
6 Hambraeus L, Lonnerdal B, Forsum E M, Gebre-medhin M. Acta. Paediatr. Scand., 1978, 67(5): 561-565
7 ZHANG Lan-Wei, ZHOU Xiao-Hong. China Dairy Industry, 1997, 25(3): 39-41
张兰威, 周晓红. 中国乳品工业, 1997, 25(3): 39-41
8 Carratu B, Boniglia C, Scalise F, Ambruzzi A M, Sanzini E. Food Chem., 2003, 81(3): 357-362
9 Chtourou A, Brignon G, Ribadeau-Dumas B. J. Dairy. Res., 1985, 52(2): 239-247
10 Picciano M F. Pediatr. Clin. North Am., 2001, 48(1): 263-264
11 HUANG Yu, REN Hao-Wei, LIU Biao, LIU Ning, LI Meng, WANG Dong-Mao. Chinese Journal of Chromatograph, 2013, 31(5): 429-434
黄 宇, 任皓威, 刘 彪, 刘 宁, 李 萌, 王东茂. 色谱, 2013, 31(5): 429-434
12 LIU Wei, LI Meng, REN Hao-Wei, LIU Ning. J. Spectroscopy and Spectral Anylysis, 2014, 34(12): 3281-3287
刘 微, 李 萌, 任皓威, 刘 宁. 光谱与光谱学分析, 2014, 34(12): 3281-3287
13 REN Hao-Wei, ZHANG Wan-Shu, LI Xiang-Yi, LIU Ning. Spectroscopy and Spectral Anylysis, 2015, 35(2): 384-389
任皓威, 张婉舒, 李相怡, 刘 宁. 光谱与光谱学分析, 2015, 35(2): 384-389
14 Yasuaki W, Bo L. J. Nutr. Biochem., 2014, 25(5): 503-514
15 Apollinaire T, Andrea R, Lyness B, Jean C L, Havard J, James K F. Food Chem., 2011, 126(3): 1138-1143
16 Mandal S M, Bharti R, Porto W F, Gauri S S, Mandal M, Franco O L, Ghosh A K. Peptides,2014, 56: 84-93
17 Puri A, Bhattacharya M, Tripathi L M, Haq W. Inter. Immunopharmacol., 2009, 9(9): 1092-1096
18 Richard A. P, William W.F, Steven H. A. Fetal and Neonatal Physiology. America: Saunders, 2011: 1241-1243
19 Agunod M, Yamaguchi N, Lopez R, Luhby L, George B, Jerzy G. Am. J. Dig. Dis., 1969, 14: 400-414
20 Johns P W. Analytical Method for the Determination of Infant Formula Protein Digestibility In vitro: United States, US 7939659B2. 2008-07-01

