五味子治疗大鼠糖尿病肾病作用机制的血清代谢组学研究
皮子凤 门丽慧 张静 周园 宋凤瑞 刘志强

摘 要 采用基于超高效液相色谱与串联四级杆飞行时间质谱仪(Ultra-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry, UPLC/Q-TOF-MS)联用技术的代谢组学方法, 通过分析大鼠血清内源性代谢物的变化, 研究五味子治疗糖尿病肾病的作用机制。利用高脂高糖饲料喂养并腹腔注射链脲佐菌素(STZ)建立糖尿病大鼠模型。给药12周后, 采用试剂盒方法测定尿蛋白、尿肌酐的含量, 结果表明五味子水提取物可以显著降低模型动物的尿蛋白含量(p<0.05), 对糖尿病大鼠肾病并发症具有一定的改善作用。采用UPLC/Q-TOF-MS方法分析了五味子对糖尿病肾病大鼠的血清代谢轮廓, 分析了健康组、模型组和五味子给药组的大鼠血清, 采用偏最小二乘法-判别分析(Partial least squares discriminant analysis, PLS-DA)进行数据分析。PLS-DA得分图显示健康组、模型组和五味子组的代谢轮廓有显著差别, 根据正交偏最小二乘法-判别分析(Orthogonal partial least squares discriminant analysis, OPLS-DA)载荷图筛选, 将对各组分离贡献大的化合物的串联质谱分析数据, 经Human Metabolome Database(HMDB)等数据库检索, 进行质谱信息匹配, 鉴定出黄尿酸、油酰胺、棕榈酰胺、尿酸、5-羟基己酸、硫酸对甲酚、对甲酚葡萄糖苷酸7种内源性代谢物为生物标记物。研究结果表明五味子通过影响色氨酸代谢、嘌呤代谢、肠内菌代谢、脂肪酸代谢等通路对糖尿病肾病发挥治疗作用, 其中嘌呤代谢、肠内菌代谢通路可能是五味子发挥治疗作用的重要途径。
关键词 五味子; 糖尿病肾病; 血清; 代谢组学
1 引 言
北五味子为木兰科植物五味子(Schisandra chinensis (Turcz.) Baill.)的干燥成熟果实, 具有敛肺滋肾、生津敛汗、涩精止泻、宁心安神等功效【1】。研究表明, 五味子有效成分主要包括木脂素、多糖、挥发油、有机酸、脂肪油、氨基酸、色素、鞣质等, 药理作用涉及中枢神经系统、心血管系统、消化系统、生殖系统以及泌尿系统等各个方面。
研究表明, 五味子油可以改善STZ联合高脂饮食诱导的Ⅱ型糖尿病大鼠胰岛素抵抗, 改善β细胞的功能缺陷, 提高胰岛素的分泌量, 增加胰岛素和胰十二指肠同源盒因子基因的表达, 从而发挥降血糖作用【2】。五味子多糖可控制糖尿病小鼠体重减轻、多饮和血糖升高的症状【3】, 能显著促进肝糖原的合成,抑制肝糖原分解而发挥降糖作用, 且对糖尿病所引起的脂代谢异常也具有改善作用。五味子抗炎、抗氧化、清除氧自由基、增加周围组织对葡萄糖的摄取等药理活性在糖尿病肾病治疗中效果明显【4,5】。五味子醇提液能显著改善C57BL/614小鼠的糖尿病肾病, 阻抑肾小管上皮细胞-间充质转化及纤溶酶原活化抑制因子-1表达是其作用机制【6】。
目前, 文献报道的五味子治疗糖尿病作用机制的研究, 大多数是从药理作用以及分子角度进行的。近年来, 越来越多的研究采用代谢组学方法考察中药治疗糖尿病机制【7~9】, 但尚无从五味子整体作用角度对其治疗糖尿病肾病的作用机制进行研究的报道。本研究采用代谢组学方法, 基于UPLC/Q-TOF-MS技术, 对五味子治疗前后糖尿病肾病大鼠血清中内源性代谢物进行了分析鉴定, 从中药作用的整体性角度, 初步阐明了五味子治疗糖尿病肾病的作用机制。
2 实验部分
2.1 仪器与试剂
WatersAcquity UPLC液相色谱系统、Q-TOF SYNAPT G2 HDMS质谱仪和Waters ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm, 1.7 μm)。
五味子购自北京同仁堂药店;链脲佐菌素(STZ, Sigma公司);乙腈和甲酸(色谱纯, 美国Fisher公司);水经Millipore制得。SD大鼠购自吉林大学白求恩医学院动物实验中心, 实验动物许可证: SCXK(吉)2013-0001。尿蛋白试剂盒、尿肌酐试剂盒购自南京建成生物工程研究所(批号20140515, 20140506)。
2.2 动物实验
正常对照组(Control group): 给予8只SD雄性大鼠标准饲料, 正常喂养。
Ⅱ型糖尿病大鼠造模参照文献【7】进行。
16只糖尿病大鼠随机分为两组: 模型组(Model group)和五味子组(WWZ group)。五味子组每日灌胃五味子水提液, 剂量为每kg体重5 g生药, 模型组和空白组灌胃蒸馏水。连续给药12星期后, 收集24 h尿液, 按照试剂盒方法测定尿蛋白、尿肌酐含量。末次给药24 h后, 动物断头处死, 取血, 3000 r/min离心, 收集空白对照组、模型组和五味子组的血清,
储存备用。
2.3 样品收集和制备
五味子水提物制备: 药材粉碎后称取适量, 加10倍体积水浸泡20 min, 加热回流提取两次, 每次45 min, 合并提取液, 浓缩后冻干, 阴凉干燥处储存备用。
样品检测前, 4 ℃融化血清样品, 在100 μL血清样品中加入400 μL无水乙腈, 剧烈振荡30 s, 室温静置10 min, 样品在4 ℃条件下, 12000 r/min离心10 min, 上清液用0.22 μm滤膜过滤, 滤液供UPLC/MS测定。
2.4 色谱质谱条件及样品分析
色谱条件: A超纯水(0.1%甲酸), B乙腈;梯度洗脱: 0~2 min, 5%~60% B;2~4 min, 60%~70% B;4~7 min, 70%~100% B;7~8 min: 100% B。柱温: 30℃;流速: 0.5 mL/min, 进样量5 μL。
质谱条件: 电离源温度120℃;锥孔气为氮气, 流速50 L/h;去溶剂气为氮气, 温度350 ℃, 流速700 L/h。正离子模式下毛细管电压为 3.0 kV, 锥孔电压为 30 V, 提取锥孔电压为 5.0 V;负离子模式下毛细管电压为 2.0 kV, 锥孔电压为 30 V, 提取锥孔电压为 5.0 V。甲酸钠建立质量轴标准曲线, 亮氨酸脑啡肽进行实时质量校正。串联质谱碰撞气为氩气, 低碰撞能为 5 eV, 高碰撞能为 25~35 eV。
为保证整个分析系统的稳定性, 在本实验中使用质控样品(Quality control, QC)进行方法验证, QC样品由每个正常样品各取100μL混合而得。为避免误差样品的检测顺序为随机进行。对样品进行分析前, 先运行5次QC样品, 以起到平衡系统的作用。样品的检测过程中, 每检测5个正常样品后运行1次QC样品以衡量系统的稳定性。
2.5 数据处理
样本用UPLC/Q-TOF-MS进行检测, 得到样品的总离子流色谱图, 利用MarkerLynx对采集得到的谱图进行离子对的提取、峰对齐、峰匹配和峰强度校正等操作, 将结果转化为包含化合物的保留时间和质荷比信息的csv格式文件。再将其导入EZinfo 2.0统计软件进行分析。使用HMDB (http://www.hmdb.ca/)、METLIN (http://metlin.scripps.edu/)等生物学数据库进行生物标志物的鉴定和代谢通路的分析。
3 结果与讨论
3.1 五味子对糖尿病肾病大鼠尿肌酐、尿蛋白含量的影响
糖尿病肾病早期, 肾小球基底膜受损, 过滤能力下降, 会出现尿蛋白增加、尿肌酐含量减少的状况。实验结果表明(表1), 大鼠经糖尿病造模后12周, 尿液中蛋白数量显著增加(p<0.05)、尿肌酐水平显著下降(p<0.01), 说明糖尿病模型大鼠发生了肾病并发症, 肾小球滤过能力下降。经五味子治疗后, 尿蛋白排泄水平明显低于模型组(p<0.05), 尿肌酐水平显著增加(p<0.05), 表明五味子对糖尿病肾病具有一定的治疗作用。
3.2 五味子治疗糖尿病肾病的血清代谢组学研究
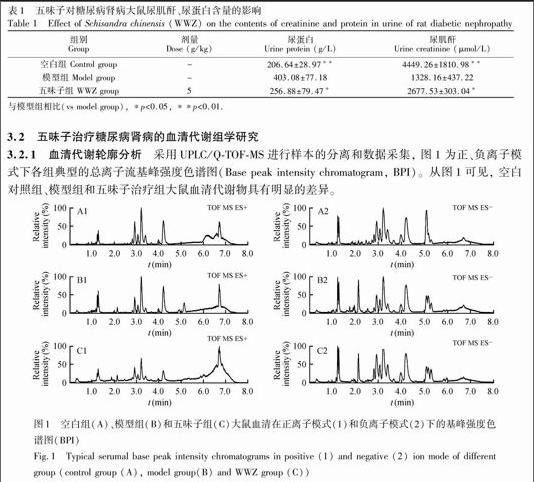
3.2.1 血清代谢轮廓分析 采用UPLC/Q-TOF-MS进行样本的分离和数据采集, 图1为正、负离子模式下各组典型的总离子流基峰强度色谱图(Base peak intensity chromatogram, BPI)。从图1可见, 空白对照组、模型组和五味子治疗组大鼠血清代谢物具有明显的差异。图1 空白组(A)、模型组(B)和五味子组(C)大鼠血清在正离子模式(1)和负离子模式(2)下的基峰强度色谱图(BPI)
Fig.1 Typical serumal base peak intensity chromatograms in positive (1) and negative (2) ion mode of different group (control group (A), model group(B) and WWZ group (C))
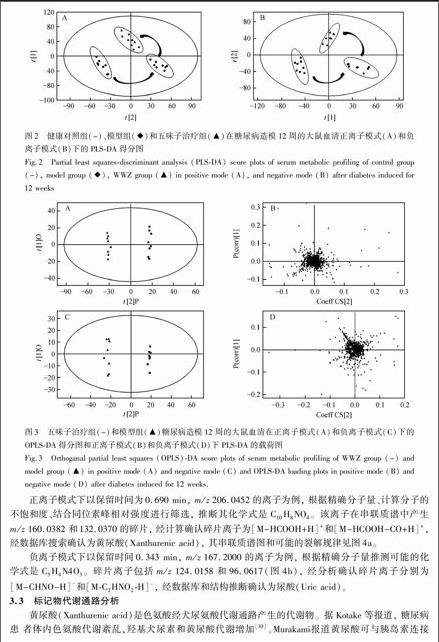
由空白对照组、模型组和五味子组的偏最小二乘法判别分析法(PLS-DA)得分图(图2)可以看出, 在正谱或负谱中, 3组均能明显分开, 其中正离子模式下模型的评价指标为R2X=0.9986, Q2=0.8675, 负离子模式下模型的评价指标为R2X=0.9943, Q2=0.9026。如图2所示, STZ造模成功12周后, 模型大鼠血清中的内源性代谢物与正常动物相比发生了明显的变化, 经五味子治疗后, 糖尿病大鼠血清代谢轮廓向着正常组方向转变。
3.2.2 潜在标记物鉴定 对五味子治疗组和糖尿病组在STZ造模12周的血样进行正交偏最小二乘法判别分析(OPLS-DA)。正离子模式下模型评价指标为R2Y=0.9986、Q2=0.8675, 负离子模式下模型评价指标为R2Y=0.9942和Q2=0.9026, 说明模式质量良好。如OPLS-DA得分图(图3 A和C)所示, 五味子治疗组和糖尿病模型组可以明显区分。载荷图上远离原点的化合物为潜在的标记物(图3B和3D), 同时将 VIP>1且有统计学意义的变量(p <0.05)作为标记物的判断标准, 根据它们精确分子量和串联质谱结果以及与Human Metabolome Database(HMDB)和Mass Bank.jp等代谢产物和质谱数据库进行质谱信息匹配, 对可能的潜在标记物进行初步鉴定, 再用标准品的串联质谱进行验证, 鉴定了7种化合物, 结果列于表2。
正离子模式下以保留时间为0.690 min, m/z 206.0452的离子为例, 根据精确分子量、计算分子的不饱和度、结合同位素峰相对强度进行筛选, 推断其化学式是C10H8NO4。该离子在串联质谱中产生m/z 160.0382 和132.0370的碎片, 经计算确认碎片离子为【M-HCOOH+H】+和【M-HCOOH-CO+H】+, 经数据库搜索确认为黄尿酸(Xanthurenic acid), 其串联质谱图和可能的裂解规律见图4a。
负离子模式下以保留时间0.343 min, m/z 167.2000的离子为例, 根据精确分子量推测可能的化学式是C5H4N4O3。碎片离子包括m/z 124.0158和96.0617(图4b), 经分析确认碎片离子分别为【M-CHNO-H】
经数据库和结构推断确认为尿酸(Uric acid)。
3.3 标记物代谢通路分析
黄尿酸(Xanthurenic acid)是色氨酸经犬尿氨酸代谢通路产生的代谢物。据Kotake等报道, 糖尿病患者体内色氨酸代谢紊乱, 羟基犬尿素和黄尿酸代谢增加【10】。Murakami报道黄尿酸可与胰岛素连接
较游离胰岛素低, 降低了胰岛素的生物学效应, 从而导致糖尿病。五味子给药后血液中黄尿酸含量降低, 对糖尿病模型的色氨酸代谢途径有积极的调节作用。
油酰胺(Oleamide)是长链脂肪酰胺, 研究发现具有降低身体核心体温等多种生理功能。油酰胺没有特定的受体, 但最有可能作用大麻素受体(CB-1和CB-2)【12】和几种血清素受体【13】, 而这两种大麻素和血清素受体参与控制胰岛素分泌。有研究证明CB-1受体可以促进人骨骼肌细胞和小鼠脂肪细胞的胰岛素抵抗【14】。棕榈酰胺(Palmitic amide), 属于脂肪酰胺, 由棕榈酸降解产生。五味子治疗后, 油酰胺、棕榈酰胺水平下调, 说明五味子对糖尿病大鼠脂肪酸代谢通路具有调节作用。
尿酸(Uric acid)是嘌呤代谢的最终产物, 能够减缓肾血流量, 激活肾素血管紧张素系统。高血尿酸也可加速肾脏损伤, 造成肾小管不可逆性损伤【15】, 会造成低密度脂蛋白胆固醇的氧化和脂质过氧化反应。研究表明, 尿酸是糖尿病肾病的一种介质, 可通过增强肾素-血管紧张素-醛固酮系统活性和炎症级联反应等途径介导糖尿病肾病的发生【16】, 加重糖尿病患者的肾脏损伤程度。五味子治疗后血尿酸水平下调, 可减少模型动物血清中高尿酸水平对肾脏的损伤, 从而发挥治疗糖尿病肾病的作用。
硫酸对甲酚(p-Cresol sulfate)和对甲酚葡萄糖苷酸(p-Cresol glucuronide)都是尿毒症毒素, 是对甲苯酚通过尿液排泄的衍生物,二者是苯丙氨酸和酪氨酸经肠道厌氧菌作用的代谢产物。硫酸对甲酚(PCS)是一种典型的难解离蛋白结合毒素, 当毒素结合到蛋白上后, 能导致蛋白自身分子结构、电荷甚至功能的变化, 甚至造成其它组织、器官的损伤【17】。尿毒症患者肾脏排泄PCS的能力显著下降, 血液中PCS与白蛋白结合显著增高。由于PCS与白蛋白有高度亲和力, 使其不易与白蛋白解离、不能代偿性地由肾脏排出, 从而对全身各个组织、系统、器官造成毒性损害。五味子治疗后, 糖尿病大鼠血清中的此类物质含量下调, 说明五味子会通过调节肠内菌代谢通路、减少硫酸对甲酚的产生, 从而发挥治疗糖尿病肾病的作用。
5-羟基己酸(5-Hydroxyhexanoic acid)是一种脂肪酸的单羟基羧酸降解产物。在伴有酮酸中毒的糖尿病患者中检测到该化合物【18】。五味子的治疗减少了糖尿病肾病大鼠血清中5-羟基己酸的浓度, 表明五味子在减轻糖尿病酮酸中毒症状中可能达到重要的作用。
4 结 论
本研究采用 UPLC-Q-TOF-MS 结合PLS-DA的分析手段, 进行了五味子治疗糖尿病肾病大鼠血清代谢组学研究。共鉴定了7种内源性代谢产物, 分别为黄尿酸、油酰胺、棕榈酰胺、尿素、5-羟基己酸、硫酸对甲酚和对甲酚葡萄糖苷酸, 说明五味子通过影响色氨酸代谢、嘌呤代谢、脂肪酸代谢、肠内菌代谢等通路发挥治疗作用, 其中嘌呤代谢、肠内菌代谢通路是其减少肾病损伤的重要作用途径。从五味子整体作用角度初步阐明了其治疗糖尿病肾病的作用机理。
References
1 WANG Sen, ZHANG Jian-Guo. Econom. Fores. Res., 2003, 21(4): 126-127
王 森, 张建国. 经济林研究, 2003, 21(4): 126-127
2 AN Li-Ping, WANG Ying-Ping, LIU Xiao-Mei, WANG Chun-Mei, ZHAN Jin-Zhuo, SUN Hui, LI Na, WANG Tuo, DU Pei-Ge, SUN Zhi-Wei. Chinese Tradit. Herb. Drugs, 2012, 43(3): 552-556
安丽萍, 王英平, 刘晓梅, 王春梅, 詹巾卓, 孙 汇, 李 娜, 王 拓, 杜培革, 孙志伟. 中草药, 2012, 43(3): 552-556
3 GAO Xiao-Xu, MENG Xian-Jun, LI Ji-Hai, QIN Qin, NA Guang-Ning. Food Res. Dev., 2008, 29 (9): 27-30
高晓旭, 孟宪军, 李继海, 秦 琴, 那广宁. 食品研究与开发, 2008, 29(9): 27-30
4 Ip S P, Ko K M. Biochem. Pharmacol., 1996, 52: 1687-1693
5 Pan S Y,Han Y F, Carlier P R, Pang Y P, Mak D H F, Lam B Y H , KO K M. Planta Med., 2002, 68(3): 217-220
6 LIU Miao, ZHANG Mian-Zhi, TAN Xiao-Yue, YUAN Sha-Sha. Tianjin Medic. J., 2011, 39(6): 557-559
刘 苗, 张勉之, 谭小月, 袁沙沙. 天津医药, 2011, 39(6): 557-559
7 GU Jin-Ning, NIU Jun, PI Zi-Feng, YUE Hao, WU Sui-Sheng, LIU Shu-Ying. Chinese J. Anal. Chem., 2013, 41(3): 371-376
谷金宁, 牛 俊, 皮子凤, 越 皓, 吴绥生, 刘淑莹. 分析化学, 2013, 41(3): 371-376
8 Niu J, Pi Z F, Yue H, Wang Y, Yu Q, Liu S Y. Rapid Commun. Mass Spectrom., 2012, 26(23): 2683-2689
9 Zhang S X, Sun H, Sun W J, Jiao G Z, Wang X J. J.Pharmaceut. Biomed., 2010, 53: 1011-1014
10 Kotake Y, Inada T. J. Biochem., 1953, 40(3): 291-294
11 Kotake Y, Murakami E. Am. J. Clin. Nutr., 1971, 24(7): 826-829
12 Leggett J D, Aspley S, Beckett S R G, D'antona A M,Kendall D A. Brit. J. Pharmacol., 2004, 141(2): 253-262
13 Boger D L, Patterson J E, Jin Q. P. Natl. Acad. Sci. USA, 1998, 95(8): 4102-4107
14 D′eon T M, Pierce K A, Roix J J, Tyler A, Chen H, Teiceira S. Diabetes, 2008, 57(5): 1262-1268
15 Nakagawa T, Mazzali M, Kang D H, Kanelis J, Watanabe S, Sanchez-lozada L G, Rodriduez-lturbe B, Herrera-acosta J, Johnson R J. Am. J. Nephrol., 2002, 23(1): 2-7
16 Jalal D I, Maahs D M, Hovind P, Nakagawa T. Semin. Nephrol., 2011, 31(5): 459-465
17 Glorieux G, Vanholder R. Contrib. Nephrol., 2011, 168(1) : 117-128
18 Kamerling J P, Duran M, Bruinvis L, Ketting D, Wadman S K, Vliegenthart J F G. Clin. Chim. Acta, 1982, 125(3): 247-254



摘 要 采用基于超高效液相色谱与串联四级杆飞行时间质谱仪(Ultra-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry, UPLC/Q-TOF-MS)联用技术的代谢组学方法, 通过分析大鼠血清内源性代谢物的变化, 研究五味子治疗糖尿病肾病的作用机制。利用高脂高糖饲料喂养并腹腔注射链脲佐菌素(STZ)建立糖尿病大鼠模型。给药12周后, 采用试剂盒方法测定尿蛋白、尿肌酐的含量, 结果表明五味子水提取物可以显著降低模型动物的尿蛋白含量(p<0.05), 对糖尿病大鼠肾病并发症具有一定的改善作用。采用UPLC/Q-TOF-MS方法分析了五味子对糖尿病肾病大鼠的血清代谢轮廓, 分析了健康组、模型组和五味子给药组的大鼠血清, 采用偏最小二乘法-判别分析(Partial least squares discriminant analysis, PLS-DA)进行数据分析。PLS-DA得分图显示健康组、模型组和五味子组的代谢轮廓有显著差别, 根据正交偏最小二乘法-判别分析(Orthogonal partial least squares discriminant analysis, OPLS-DA)载荷图筛选, 将对各组分离贡献大的化合物的串联质谱分析数据, 经Human Metabolome Database(HMDB)等数据库检索, 进行质谱信息匹配, 鉴定出黄尿酸、油酰胺、棕榈酰胺、尿酸、5-羟基己酸、硫酸对甲酚、对甲酚葡萄糖苷酸7种内源性代谢物为生物标记物。研究结果表明五味子通过影响色氨酸代谢、嘌呤代谢、肠内菌代谢、脂肪酸代谢等通路对糖尿病肾病发挥治疗作用, 其中嘌呤代谢、肠内菌代谢通路可能是五味子发挥治疗作用的重要途径。
关键词 五味子; 糖尿病肾病; 血清; 代谢组学
1 引 言
北五味子为木兰科植物五味子(Schisandra chinensis (Turcz.) Baill.)的干燥成熟果实, 具有敛肺滋肾、生津敛汗、涩精止泻、宁心安神等功效【1】。研究表明, 五味子有效成分主要包括木脂素、多糖、挥发油、有机酸、脂肪油、氨基酸、色素、鞣质等, 药理作用涉及中枢神经系统、心血管系统、消化系统、生殖系统以及泌尿系统等各个方面。
研究表明, 五味子油可以改善STZ联合高脂饮食诱导的Ⅱ型糖尿病大鼠胰岛素抵抗, 改善β细胞的功能缺陷, 提高胰岛素的分泌量, 增加胰岛素和胰十二指肠同源盒因子基因的表达, 从而发挥降血糖作用【2】。五味子多糖可控制糖尿病小鼠体重减轻、多饮和血糖升高的症状【3】, 能显著促进肝糖原的合成,抑制肝糖原分解而发挥降糖作用, 且对糖尿病所引起的脂代谢异常也具有改善作用。五味子抗炎、抗氧化、清除氧自由基、增加周围组织对葡萄糖的摄取等药理活性在糖尿病肾病治疗中效果明显【4,5】。五味子醇提液能显著改善C57BL/614小鼠的糖尿病肾病, 阻抑肾小管上皮细胞-间充质转化及纤溶酶原活化抑制因子-1表达是其作用机制【6】。
目前, 文献报道的五味子治疗糖尿病作用机制的研究, 大多数是从药理作用以及分子角度进行的。近年来, 越来越多的研究采用代谢组学方法考察中药治疗糖尿病机制【7~9】, 但尚无从五味子整体作用角度对其治疗糖尿病肾病的作用机制进行研究的报道。本研究采用代谢组学方法, 基于UPLC/Q-TOF-MS技术, 对五味子治疗前后糖尿病肾病大鼠血清中内源性代谢物进行了分析鉴定, 从中药作用的整体性角度, 初步阐明了五味子治疗糖尿病肾病的作用机制。
2 实验部分
2.1 仪器与试剂
WatersAcquity UPLC液相色谱系统、Q-TOF SYNAPT G2 HDMS质谱仪和Waters ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm, 1.7 μm)。
五味子购自北京同仁堂药店;链脲佐菌素(STZ, Sigma公司);乙腈和甲酸(色谱纯, 美国Fisher公司);水经Millipore制得。SD大鼠购自吉林大学白求恩医学院动物实验中心, 实验动物许可证: SCXK(吉)2013-0001。尿蛋白试剂盒、尿肌酐试剂盒购自南京建成生物工程研究所(批号20140515, 20140506)。
2.2 动物实验
正常对照组(Control group): 给予8只SD雄性大鼠标准饲料, 正常喂养。
Ⅱ型糖尿病大鼠造模参照文献【7】进行。
16只糖尿病大鼠随机分为两组: 模型组(Model group)和五味子组(WWZ group)。五味子组每日灌胃五味子水提液, 剂量为每kg体重5 g生药, 模型组和空白组灌胃蒸馏水。连续给药12星期后, 收集24 h尿液, 按照试剂盒方法测定尿蛋白、尿肌酐含量。末次给药24 h后, 动物断头处死, 取血, 3000 r/min离心, 收集空白对照组、模型组和五味子组的血清,
储存备用。
2.3 样品收集和制备
五味子水提物制备: 药材粉碎后称取适量, 加10倍体积水浸泡20 min, 加热回流提取两次, 每次45 min, 合并提取液, 浓缩后冻干, 阴凉干燥处储存备用。
样品检测前, 4 ℃融化血清样品, 在100 μL血清样品中加入400 μL无水乙腈, 剧烈振荡30 s, 室温静置10 min, 样品在4 ℃条件下, 12000 r/min离心10 min, 上清液用0.22 μm滤膜过滤, 滤液供UPLC/MS测定。
2.4 色谱质谱条件及样品分析
色谱条件: A超纯水(0.1%甲酸), B乙腈;梯度洗脱: 0~2 min, 5%~60% B;2~4 min, 60%~70% B;4~7 min, 70%~100% B;7~8 min: 100% B。柱温: 30℃;流速: 0.5 mL/min, 进样量5 μL。
质谱条件: 电离源温度120℃;锥孔气为氮气, 流速50 L/h;去溶剂气为氮气, 温度350 ℃, 流速700 L/h。正离子模式下毛细管电压为 3.0 kV, 锥孔电压为 30 V, 提取锥孔电压为 5.0 V;负离子模式下毛细管电压为 2.0 kV, 锥孔电压为 30 V, 提取锥孔电压为 5.0 V。甲酸钠建立质量轴标准曲线, 亮氨酸脑啡肽进行实时质量校正。串联质谱碰撞气为氩气, 低碰撞能为 5 eV, 高碰撞能为 25~35 eV。
为保证整个分析系统的稳定性, 在本实验中使用质控样品(Quality control, QC)进行方法验证, QC样品由每个正常样品各取100μL混合而得。为避免误差样品的检测顺序为随机进行。对样品进行分析前, 先运行5次QC样品, 以起到平衡系统的作用。样品的检测过程中, 每检测5个正常样品后运行1次QC样品以衡量系统的稳定性。
2.5 数据处理
样本用UPLC/Q-TOF-MS进行检测, 得到样品的总离子流色谱图, 利用MarkerLynx对采集得到的谱图进行离子对的提取、峰对齐、峰匹配和峰强度校正等操作, 将结果转化为包含化合物的保留时间和质荷比信息的csv格式文件。再将其导入EZinfo 2.0统计软件进行分析。使用HMDB (http://www.hmdb.ca/)、METLIN (http://metlin.scripps.edu/)等生物学数据库进行生物标志物的鉴定和代谢通路的分析。
3 结果与讨论
3.1 五味子对糖尿病肾病大鼠尿肌酐、尿蛋白含量的影响
糖尿病肾病早期, 肾小球基底膜受损, 过滤能力下降, 会出现尿蛋白增加、尿肌酐含量减少的状况。实验结果表明(表1), 大鼠经糖尿病造模后12周, 尿液中蛋白数量显著增加(p<0.05)、尿肌酐水平显著下降(p<0.01), 说明糖尿病模型大鼠发生了肾病并发症, 肾小球滤过能力下降。经五味子治疗后, 尿蛋白排泄水平明显低于模型组(p<0.05), 尿肌酐水平显著增加(p<0.05), 表明五味子对糖尿病肾病具有一定的治疗作用。
3.2 五味子治疗糖尿病肾病的血清代谢组学研究
3.2.1 血清代谢轮廓分析 采用UPLC/Q-TOF-MS进行样本的分离和数据采集, 图1为正、负离子模式下各组典型的总离子流基峰强度色谱图(Base peak intensity chromatogram, BPI)。从图1可见, 空白对照组、模型组和五味子治疗组大鼠血清代谢物具有明显的差异。图1 空白组(A)、模型组(B)和五味子组(C)大鼠血清在正离子模式(1)和负离子模式(2)下的基峰强度色谱图(BPI)
Fig.1 Typical serumal base peak intensity chromatograms in positive (1) and negative (2) ion mode of different group (control group (A), model group(B) and WWZ group (C))
由空白对照组、模型组和五味子组的偏最小二乘法判别分析法(PLS-DA)得分图(图2)可以看出, 在正谱或负谱中, 3组均能明显分开, 其中正离子模式下模型的评价指标为R2X=0.9986, Q2=0.8675, 负离子模式下模型的评价指标为R2X=0.9943, Q2=0.9026。如图2所示, STZ造模成功12周后, 模型大鼠血清中的内源性代谢物与正常动物相比发生了明显的变化, 经五味子治疗后, 糖尿病大鼠血清代谢轮廓向着正常组方向转变。
3.2.2 潜在标记物鉴定 对五味子治疗组和糖尿病组在STZ造模12周的血样进行正交偏最小二乘法判别分析(OPLS-DA)。正离子模式下模型评价指标为R2Y=0.9986、Q2=0.8675, 负离子模式下模型评价指标为R2Y=0.9942和Q2=0.9026, 说明模式质量良好。如OPLS-DA得分图(图3 A和C)所示, 五味子治疗组和糖尿病模型组可以明显区分。载荷图上远离原点的化合物为潜在的标记物(图3B和3D), 同时将 VIP>1且有统计学意义的变量(p <0.05)作为标记物的判断标准, 根据它们精确分子量和串联质谱结果以及与Human Metabolome Database(HMDB)和Mass Bank.jp等代谢产物和质谱数据库进行质谱信息匹配, 对可能的潜在标记物进行初步鉴定, 再用标准品的串联质谱进行验证, 鉴定了7种化合物, 结果列于表2。
正离子模式下以保留时间为0.690 min, m/z 206.0452的离子为例, 根据精确分子量、计算分子的不饱和度、结合同位素峰相对强度进行筛选, 推断其化学式是C10H8NO4。该离子在串联质谱中产生m/z 160.0382 和132.0370的碎片, 经计算确认碎片离子为【M-HCOOH+H】+和【M-HCOOH-CO+H】+, 经数据库搜索确认为黄尿酸(Xanthurenic acid), 其串联质谱图和可能的裂解规律见图4a。
负离子模式下以保留时间0.343 min, m/z 167.2000的离子为例, 根据精确分子量推测可能的化学式是C5H4N4O3。碎片离子包括m/z 124.0158和96.0617(图4b), 经分析确认碎片离子分别为【M-CHNO-H】
经数据库和结构推断确认为尿酸(Uric acid)。
3.3 标记物代谢通路分析
黄尿酸(Xanthurenic acid)是色氨酸经犬尿氨酸代谢通路产生的代谢物。据Kotake等报道, 糖尿病患者体内色氨酸代谢紊乱, 羟基犬尿素和黄尿酸代谢增加【10】。Murakami报道黄尿酸可与胰岛素连接
较游离胰岛素低, 降低了胰岛素的生物学效应, 从而导致糖尿病。五味子给药后血液中黄尿酸含量降低, 对糖尿病模型的色氨酸代谢途径有积极的调节作用。
油酰胺(Oleamide)是长链脂肪酰胺, 研究发现具有降低身体核心体温等多种生理功能。油酰胺没有特定的受体, 但最有可能作用大麻素受体(CB-1和CB-2)【12】和几种血清素受体【13】, 而这两种大麻素和血清素受体参与控制胰岛素分泌。有研究证明CB-1受体可以促进人骨骼肌细胞和小鼠脂肪细胞的胰岛素抵抗【14】。棕榈酰胺(Palmitic amide), 属于脂肪酰胺, 由棕榈酸降解产生。五味子治疗后, 油酰胺、棕榈酰胺水平下调, 说明五味子对糖尿病大鼠脂肪酸代谢通路具有调节作用。
尿酸(Uric acid)是嘌呤代谢的最终产物, 能够减缓肾血流量, 激活肾素血管紧张素系统。高血尿酸也可加速肾脏损伤, 造成肾小管不可逆性损伤【15】, 会造成低密度脂蛋白胆固醇的氧化和脂质过氧化反应。研究表明, 尿酸是糖尿病肾病的一种介质, 可通过增强肾素-血管紧张素-醛固酮系统活性和炎症级联反应等途径介导糖尿病肾病的发生【16】, 加重糖尿病患者的肾脏损伤程度。五味子治疗后血尿酸水平下调, 可减少模型动物血清中高尿酸水平对肾脏的损伤, 从而发挥治疗糖尿病肾病的作用。
硫酸对甲酚(p-Cresol sulfate)和对甲酚葡萄糖苷酸(p-Cresol glucuronide)都是尿毒症毒素, 是对甲苯酚通过尿液排泄的衍生物,二者是苯丙氨酸和酪氨酸经肠道厌氧菌作用的代谢产物。硫酸对甲酚(PCS)是一种典型的难解离蛋白结合毒素, 当毒素结合到蛋白上后, 能导致蛋白自身分子结构、电荷甚至功能的变化, 甚至造成其它组织、器官的损伤【17】。尿毒症患者肾脏排泄PCS的能力显著下降, 血液中PCS与白蛋白结合显著增高。由于PCS与白蛋白有高度亲和力, 使其不易与白蛋白解离、不能代偿性地由肾脏排出, 从而对全身各个组织、系统、器官造成毒性损害。五味子治疗后, 糖尿病大鼠血清中的此类物质含量下调, 说明五味子会通过调节肠内菌代谢通路、减少硫酸对甲酚的产生, 从而发挥治疗糖尿病肾病的作用。
5-羟基己酸(5-Hydroxyhexanoic acid)是一种脂肪酸的单羟基羧酸降解产物。在伴有酮酸中毒的糖尿病患者中检测到该化合物【18】。五味子的治疗减少了糖尿病肾病大鼠血清中5-羟基己酸的浓度, 表明五味子在减轻糖尿病酮酸中毒症状中可能达到重要的作用。
4 结 论
本研究采用 UPLC-Q-TOF-MS 结合PLS-DA的分析手段, 进行了五味子治疗糖尿病肾病大鼠血清代谢组学研究。共鉴定了7种内源性代谢产物, 分别为黄尿酸、油酰胺、棕榈酰胺、尿素、5-羟基己酸、硫酸对甲酚和对甲酚葡萄糖苷酸, 说明五味子通过影响色氨酸代谢、嘌呤代谢、脂肪酸代谢、肠内菌代谢等通路发挥治疗作用, 其中嘌呤代谢、肠内菌代谢通路是其减少肾病损伤的重要作用途径。从五味子整体作用角度初步阐明了其治疗糖尿病肾病的作用机理。
References
1 WANG Sen, ZHANG Jian-Guo. Econom. Fores. Res., 2003, 21(4): 126-127
王 森, 张建国. 经济林研究, 2003, 21(4): 126-127
2 AN Li-Ping, WANG Ying-Ping, LIU Xiao-Mei, WANG Chun-Mei, ZHAN Jin-Zhuo, SUN Hui, LI Na, WANG Tuo, DU Pei-Ge, SUN Zhi-Wei. Chinese Tradit. Herb. Drugs, 2012, 43(3): 552-556
安丽萍, 王英平, 刘晓梅, 王春梅, 詹巾卓, 孙 汇, 李 娜, 王 拓, 杜培革, 孙志伟. 中草药, 2012, 43(3): 552-556
3 GAO Xiao-Xu, MENG Xian-Jun, LI Ji-Hai, QIN Qin, NA Guang-Ning. Food Res. Dev., 2008, 29 (9): 27-30
高晓旭, 孟宪军, 李继海, 秦 琴, 那广宁. 食品研究与开发, 2008, 29(9): 27-30
4 Ip S P, Ko K M. Biochem. Pharmacol., 1996, 52: 1687-1693
5 Pan S Y,Han Y F, Carlier P R, Pang Y P, Mak D H F, Lam B Y H , KO K M. Planta Med., 2002, 68(3): 217-220
6 LIU Miao, ZHANG Mian-Zhi, TAN Xiao-Yue, YUAN Sha-Sha. Tianjin Medic. J., 2011, 39(6): 557-559
刘 苗, 张勉之, 谭小月, 袁沙沙. 天津医药, 2011, 39(6): 557-559
7 GU Jin-Ning, NIU Jun, PI Zi-Feng, YUE Hao, WU Sui-Sheng, LIU Shu-Ying. Chinese J. Anal. Chem., 2013, 41(3): 371-376
谷金宁, 牛 俊, 皮子凤, 越 皓, 吴绥生, 刘淑莹. 分析化学, 2013, 41(3): 371-376
8 Niu J, Pi Z F, Yue H, Wang Y, Yu Q, Liu S Y. Rapid Commun. Mass Spectrom., 2012, 26(23): 2683-2689
9 Zhang S X, Sun H, Sun W J, Jiao G Z, Wang X J. J.Pharmaceut. Biomed., 2010, 53: 1011-1014
10 Kotake Y, Inada T. J. Biochem., 1953, 40(3): 291-294
11 Kotake Y, Murakami E. Am. J. Clin. Nutr., 1971, 24(7): 826-829
12 Leggett J D, Aspley S, Beckett S R G, D'antona A M,Kendall D A. Brit. J. Pharmacol., 2004, 141(2): 253-262
13 Boger D L, Patterson J E, Jin Q. P. Natl. Acad. Sci. USA, 1998, 95(8): 4102-4107
14 D′eon T M, Pierce K A, Roix J J, Tyler A, Chen H, Teiceira S. Diabetes, 2008, 57(5): 1262-1268
15 Nakagawa T, Mazzali M, Kang D H, Kanelis J, Watanabe S, Sanchez-lozada L G, Rodriduez-lturbe B, Herrera-acosta J, Johnson R J. Am. J. Nephrol., 2002, 23(1): 2-7
16 Jalal D I, Maahs D M, Hovind P, Nakagawa T. Semin. Nephrol., 2011, 31(5): 459-465
17 Glorieux G, Vanholder R. Contrib. Nephrol., 2011, 168(1) : 117-128
18 Kamerling J P, Duran M, Bruinvis L, Ketting D, Wadman S K, Vliegenthart J F G. Clin. Chim. Acta, 1982, 125(3): 247-254

