双分子印迹聚合物微球选择固相萃取环境和食品样品中壬基酚和双酚A
韦寿莲+刘玲+黎京华+汪洪武+刘永
摘 要 以壬基酚(NP)、双酚A(BPA)为模板分子, a-甲基丙烯酸(MAA)为功能单体,通过乳液聚合法制备了双模板分子印迹聚合物(D-MIP),并以D-MIP为固相萃取填料,建立了双分子印迹固相萃取-高效液相色谱荧光检测环境食品中痕量NP和BPA的方法。采用红外光谱和吸附实验对其性能进行了研究。结果表明, D-MIP对NP和BPA的饱和吸附量分别为73.3和97.5 mg/g,相对选择性系数分别为2.2和1.7。在最佳条件下,本方法的线性范围为0.01~2.3 mg/L (R2>0.998), 检出限(S/N=3)为0.001~0.002 mg/L。将本方法应用于江水、啤酒、鲫鱼中NP和BPA含量测定,回收率在86.4%~99.1%范围内,相对标准偏差小于6.2%。 本方法选择性好、灵敏度高,对环境和食品中NP和BPA的富集、分离显示出良好的应用前景。
关键词 双模板分子印迹;壬基酚;双酚A;固相萃取;高效液相色谱
1 引 言
烷基酚类和双酚类内分泌干扰物因广泛存在各种环境介质中,能干扰生物体的内分泌系统而受到极大关注,尤其是壬基酚(NP)和双酚A (BPA)[1]。由于环境水体和食品中NP、BPA的含量低、基体复杂,在色谱分析前常需要进行样品前处理[2,3]。很多样品前处理技术已经用于提取不同样品中的NP和BPA,如液液萃取[4,5]、加速溶剂提取[6,7]、Oasis或C18固相萃取[8,9]等,但这些常规的提取技术缺乏选择性。
分子印迹技术是制备在空间结构和结合位点上与特定分子匹配的印迹聚合物。目前,制备NP或BPA分子印迹聚合物(MIPs)的方法多采用封管聚合法[10~13]。该方法简单、合成条件易于控制,但所得MIPs颗粒形状不规则,印迹位点包埋较深。乳液聚合法因可容易制备出粒径可控、识别选择性较高的印迹聚合物微球而受到青睐[14],但使用单一模板分子制备的MIPs同时去除复杂环境食品样品中烷基酚类和双酚类干扰物有其局限性。多数情况下,以BPA为模板分子制备的MIPs对烷基酚类物质识别选择性较差,反之亦然。Dickert等[15]提出双模板印迹的理念。用双模板或多模板分子制备的MIPs包含两种或多种印迹位点,可有效提高对不同类别目标分子的选择性识别[16,17]。目前,以NP和BPA为模板分子制备双模板分子印迹聚合物尚未见文献报道。
本实验应用双模板的理念,结合乳液聚合的优点,以壬基酚和双酚A为双模板分子,制备一种新型双分子印迹聚合物,并将其作为固相萃取填料,结合高效液相色谱-荧光检测(HPLC-FID),建立了环境水样、啤酒、鲫鱼中痕量NP和BPA的固相萃取-HPLC-FID分析方法。
2 实验部分
2.1 仪器与试剂
Agilent 1200高效液相色谱仪(美国 Agilent公司),UV/VIS 916 紫外可见分光光度计(澳大利亚GBC公司),FTIR-8400S红外分光光度计(日本岛津公司),SHA-B水浴恒温振荡器(深圳市亿通科技有限公司),KUDOS SK8200H超声清洗器(上海科导超声仪器有限公司),固相萃取装置(北京康林科技公司)。
壬基酚(NP)、双酚A(BPA)、3-氨基酚(3-AP)、对叔丁基苯酚(p-TBP)、a-甲基丙烯酸(MAA)、乙二醇二甲基丙烯酸酯(EGDMA)、偶氮二异丁腈(AIBN),均为分析纯(上海晶纯试剂有限公司);正十四烷、司盘80(Span80)和十六烷基三甲基溴化铵(CTAB),均为分析纯(天津市科密欧化学试剂有限公司); 甲醇为色谱纯; 实验用水为 Milli-Q水(美国Millipore公司)。
2.2 色谱检测条件
色谱柱为ODS-AP柱(250 mm× 4.6 mm, 5 μm),流动相:甲醇-水(95∶5, V/V),流速1.0 mL/min,荧光检测:激发波长228 nm,发射波长305 nm; 进样量20 μL。
2.3 乳化液的配制和分子印迹聚合物的制备
配制50 mL 1% 乳化液(含Span80-CTAB(3∶7, w/w),0.8 mmol十六烷)。超声20 min,形成稳定乳化液。
将0.22 g壬基酚、0.23 g双酚A溶于5 mL氯仿,加入0.34 g MAA和4.2 g EGDMA,超声5 min,通氮气5 min,将其缓慢倒入盛有25 mL乳化液的反应器中,超声乳化20 min,加入50 mg AIBN,于80 ℃水浴中机械搅拌,通氮气反应17 h。所得聚合物离心抽滤,依次用乙醇、水洗涤多次,再用甲醇-乙酸(9∶1, V/V)溶液反复洗涤至紫外检测不到壬基酚和双酚A,最后用蒸馏水洗至中性,60 ℃真空干燥,得到分子印迹聚合物(MIP)。非印迹聚合物(NIP)的制备方法除不加入模板分子外,其余步骤同上。
2.4 吸附实验
称取30 mg MIPs 和NIPs多份,分别加入10 mL不同浓度(0.4, 0.6, 0.8, 1.0, 1.2, 1.5和1.8 g/L)BPA或NP溶液中,室温振荡2 h,离心分离,取上清液稀释后,用紫外分光光度计分别在BPA和NP的最大吸收波长处测定其对应的吸光度,根据吸附前后溶液浓度的变化,由方程Q=(c0-c)V/m计算聚合物对BPA和NP的吸附量Q(mg/g)。
称取30.0 mg MIP和NIP,分别加入10 mL 1.0 g/L BPA, NP, 3-AP和p-TBP溶液,室温振荡2 h,离心,取上清液稀释后,用紫外分光光度计测各组分的平衡浓度,计算MIP和NIP对底物的选择性系数。
2.5 样品预处理
于2012年3月在肇庆市江滨码头进行单点表层采样[18]。采集的江水过0.22 μm 纤维素滤膜,于棕色玻璃瓶4 ℃贮存。 啤酒购自本地超市。取50 mL啤酒,超声脱气20 min。为去除单宁,加50 mL 1%聚乙烯醇6000,4 ℃温育过夜, 4000 r/min离心20 min,过0.22 μm滤膜,置于棕色玻璃瓶、4 ℃贮存。
市购鲫鱼6尾,重量500 g ± 200 g。将新鲜鱼鳃和鱼肉分别置于绞肉机中绞碎、匀浆成鱼泥。称取5 g鱼泥置于50 mL离心管,加入5 mL乙腈,涡旋2 min,4000 r/min离心10 min,分离上清液,残渣用5 mL乙腈重复提取一次。合并两次上清液,60 ℃下氮气吹至2 mL,进行固相萃取。
称取200 mg MIPs,均匀装填入商品SPE柱管(500 mg, 3 mL, 美国Supelco公司),加入筛板压实, 制成MISPE柱。依次用20 mL甲醇-乙酸(9∶1, V/V)溶液、3 mL水、5 mL甲醇活化柱子。将1 mL含0.10 mg/L BPA和NP溶液上样。考察不同种类和不同用量的淋洗剂、洗脱剂对BPA、NP萃取回收率的影响,优化萃取条件。
3 结果与讨论
3.1 聚合物的FTIR光谱
3.2 吸附特性
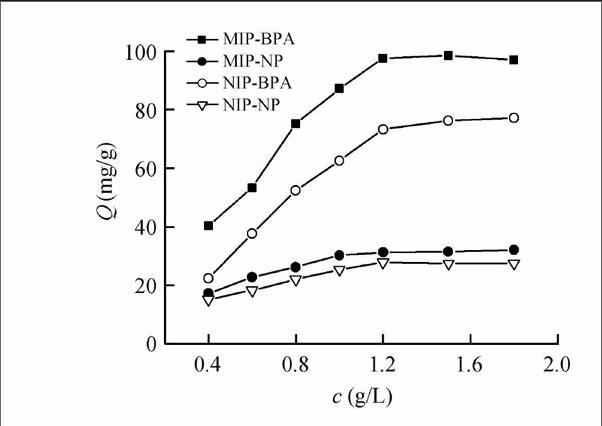
图2分别为MIP和NIP对NP, BPA的静态吸附曲线。由图2可见,MIP对NP和BPA的吸附在1.2 g/L达到饱和, NP, BPA的饱和吸附量分别为73.3 和97.5 mg/g。而相应条件下,NIP对NP, BPA的饱和吸附量分别为27.8 和31.2 mg/g。MIP对NP, BPA的吸附量显著高于NIP,这归因于MIP分子印迹效应形成的特异性识别的多静电作用位点和空间结构的互补性。
3.3 MIP的选择识别能力
选择3-氨基酚(3-AP)和对叔丁基苯酚(p-TBP)为结构类似物,考察MIP的吸附选择性。由实验测得吸附量(Qe),根据公式(2~4)计算分配系数(Kd),选择性系数(k)、相对选择性系数(α),结果如表1。由表1可知,MIP对BPA, NP的吸附量和分配系数远大于对3-AP和p-TBP;BPA, NP在MIP上的相对选择性系数分别是NIP的2.2和1.7倍。以上结果表明, MIP对模板分子BPA和NP具有强的结合能力和高的选择性。
3.4 固相萃取条件优化
考察3 mL 0~20%(V/V)甲醇-水的淋洗效果。结果表明,当甲醇含量大于5%,随甲醇用量增大,NP和BPA的损失缓慢增大,因此选择5%甲醇-水为淋洗液。考察淋洗液用量的影响。结果发现,当淋洗液用量大于4 mL,NP和BPA有不同程度的损失。因此淋洗液用量选择4 mL。
考察甲醇-水(9∶1, V/V)、纯甲醇和甲醇-乙酸(9∶1, V/V)3种洗脱液的洗脱效果。结果表明,以甲醇-乙酸为洗脱液,NP、BPA的萃取回收率最高。这是由于乙酸能够破坏分析物与印迹位点之间的氢键。相反,以甲醇-水为洗脱剂,NP、BPA的回收率最低,这是因为分析物的水溶性差; 而以纯甲醇为洗脱剂,杂质干扰比较大。因此,选择甲醇-乙酸(9∶1, V/V)为洗脱剂。考察洗脱剂用量对萃取回收率的影响。结果表明,随洗脱剂用量的增加,NP、BPA的萃取回收率增加,6 mL时达最大,分别为98.8%和98.1%。因此,洗脱剂的用量选择6 mL。
3.5 MISPE-HPLC-FID方法的建立
在优化的条件下,分别对BPA, NP, 3-AP和p-TBP系列混合标准溶液进行萃取和HPLC分析。BPA和NP的线性范围为0.01~2.3 mg/L,3-AP和p-TBP的线性范围为0.0055~1.5 mg/L;BPA, NP, 3-AP和p-TBP线性方程分别为y= Symbolm@@ 0.12+2762.78x (R2=0.9994),y= Symbolm@@ 3.83 + 753.38x (R2=0.9987),y=19.00+10005.72x (R2=0.9992),y= Symbolm@@ 1.16 + 1207.16x (R2=0.9993),检出限(S/N=3)为0.001~0.002 mg/L。对0.02 mg/L的BPA, NP, 3-AP和p-TBP水样进行5次平行测定,相应的回收率分别为98.1%, 97.3%, 91.6%和93.3%,RSD<5%。图3为0.02 mg/L混合标准溶液的高效液相色谱图。
3.6 实际样品分析
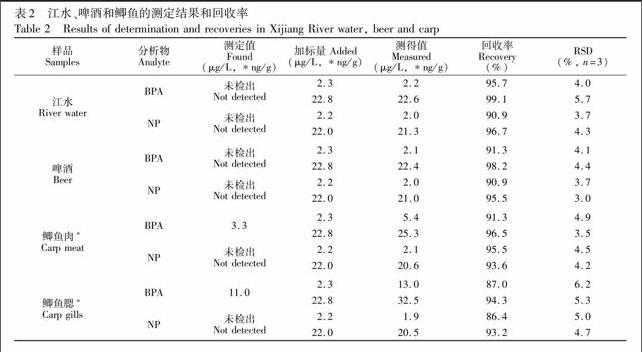
将本方法用于江水、啤酒和鲫鱼中BPA和NP的测定。图4为江水样品的HPLC图,分析结果见表2。从图4可见,样品经MISPE萃取后,可以有效去除基质的干扰。由表2可知,江水和啤酒中未检出BPA和NP;鱼肉和鱼鳃中未检出NP,但分别检出BPA,含量分别为3.3和11.0 ng/g; 鱼鳃中BPA的含量是鱼肉的3.3倍。4种样品的加标回收率在86.4%~99.1%之间,RSD≤6.2%。
References
1 López-Darias J, Germn-Hernndez M, Pino V, Afonso A M. Talanta, 2010, 80(5): 1611-1618
2 Ding W H, Wu C Y. J. Chinese Chem. Soci., ?2000, ?47(5): 1155-1160
3 Zhao R S, Wang X, Yuan J P, Zhang L L. Microchim. Acta, ?2009, ?165(3): 443-447
4 Wu M H, Wang L, Xu G, Liu N, Tang L, Zheng J, Bu T T, Lei B L. Environ. Monit. Assess, ?2013, ?185(11): 3149-3161
5 Salgueiro-Gonzlez N, Concha-Graa E, Turnes-Carou I, Muniategui-Lorenzo S, López-Mahía P, Prada-Rodríguez D. J. Chromatogr. A, ?2012, ?1223: 1-8
6 Shao B, Han H, Li D M, Ma Y, Tu X M, Wu Y G. Food Chem., ?2007, ?105(3): ?1236-1241
7 Sun H, Ge X, Lv Y, Wang A. J.Chromatogr. A, ?2012, ?1237: 1-23
8 Vega-Morales T, Sosa-Ferrera Z, Santana-Rodríguez J J. J.Chromatogr. A, ?2012, ?1230: 66-76
9 Cao X L, Perez-Locas C, Dufresne G, Clement G, Popovic S, Beraldin F, Dabeka R W, Feeley M. Food Add. Cont., ?2011, ?28: 791-798
10 XU Jing, WANG Huan-Huang, LIU Juan, ZHU Jing-Bo. Polyvinyl Chloride, ?2010, ?38(7): 35-38
徐 靖, 汪欢晃, 刘 娟, 朱静波. 聚氯乙烯, 2010, ?38(7): 35-38
11 Du T, Cheng J, Wu M, Wang X, Zhou H, Cheng M. J.Chromatogr. B, ?2014, ?951-952: ?104-109
12 LIN Fu-Hua, HUANG Xiao-Jia, YUAN Dong-Xing, NONG Shu-Yu. Chinese J. Anal. Chem., ?2012, ?40(2): ?243-248
林福华, 黄晓佳, 袁东星, 农舒予. 分析化学, 2012, ?40(2): ?243-248
13 Wang Y X, Ding Y, Rong F, Fu D. Polym. Bull., ?2012, ?68: 1255-1270
14 ZHU Li-Li, CAO Yu-Hua, CAO Guang-Qun. ?Chinese J. Anal. Chem., ?2013, ?41(11): 1724-1728
朱丽丽, 曹玉华, 曹光群. 分析化学, 2013, ?41(11): 1724-1728
15 Dickert F, Achatz P, Halikias K. Fresen J. Anal. Chem., ?2001, ?371(1): 11-15
16 Xia X L, Lai E P C, rmeci B. Environ. Sci. Pollut. Res., ?2013, ?20: 3331-3339
17 Zhang T, Ma C, Wu M, Ye Y, Chen H X, Huang J L. Microchim Acta, ?2013, ?180: ?695-702
18 Baggiani C, Baravalle P, Giovannoli C, Anfossi L, Giraudi G. Anal. Bioanal. Chem., ?2010, ?397: 815-822
Selective Solid Phase Extraction of Nonylphenol and Bisphenol A
in Environmental and Food Samples Using Double-Molecularly
Imprinted Polymer Microsphere
WEI Shou-Lian*1, LIU Ling1, LI Jing-Hua2, WANG Hong-Wu1, LIU Yong1
1(Faculty of Chemistry and Chemical Engineering, Zhaoqing University, Zhaoqing 526061, China)
2(Blue Ribbon Beer Co. Ltd., Zhaoqing 526040, China)
Abstract Double template molecularly imprinted polymer (D-MIP) was prepared by emulsion polymerization method using the nonylphenol (NP), bisphenol A (BPA) as templates, α-methyl methacrylate(MAA) as functional monomer. Then using the D-MIP as solid phase extraction materials, a method based on double-molecularly imprinted solid phase extraction coupled with high performance liquid chromatographic fluorescence detection was developed for the determination of trace NP and BPA from environmental and food samples. The D-MIP was characterized by Fourier transform infrared spectroscopy (FT-IR) and adsorption experiments. The results showed that the saturated adsorption capacity of the D-MIP for NP and BPA was 73.3 and 97.5 mg/g, respectively, and the relative selectivity coefficient was 2.2 and 1.7, respectively. Moreover, the conditions affecting extraction efficiency, such as washing conditions and desorption conditions were optimized. Under the optimal conditions, there was a good linear correlation in the concentration range of 0.01-2.3 mg/L with correlation coefficients (R2) greater than 0.998 for NP and BPA. The detection limits (S/N=3) were 0.001 and 0.002 mg/L. The proposed method was applied to determine NP and BPA in river water, beer and crucian carp samples. The recoveries of NP and BPA were in the range of 86.4%-99.1% with the relative standard deviation less than 6.2%. This method has good selectivity and high sensitivity and shows good prospects for the application in the enrichment and separation of NP and BPA in real samples.
Keywords Double-template molecularly imprinted; Nonylphenols; Bisphenol A; Solid phase extraction; High performance liquid chromatography
(Received 4 July 2014; accepted 8 October 2014


摘 要 以壬基酚(NP)、双酚A(BPA)为模板分子, a-甲基丙烯酸(MAA)为功能单体,通过乳液聚合法制备了双模板分子印迹聚合物(D-MIP),并以D-MIP为固相萃取填料,建立了双分子印迹固相萃取-高效液相色谱荧光检测环境食品中痕量NP和BPA的方法。采用红外光谱和吸附实验对其性能进行了研究。结果表明, D-MIP对NP和BPA的饱和吸附量分别为73.3和97.5 mg/g,相对选择性系数分别为2.2和1.7。在最佳条件下,本方法的线性范围为0.01~2.3 mg/L (R2>0.998), 检出限(S/N=3)为0.001~0.002 mg/L。将本方法应用于江水、啤酒、鲫鱼中NP和BPA含量测定,回收率在86.4%~99.1%范围内,相对标准偏差小于6.2%。 本方法选择性好、灵敏度高,对环境和食品中NP和BPA的富集、分离显示出良好的应用前景。
关键词 双模板分子印迹;壬基酚;双酚A;固相萃取;高效液相色谱
1 引 言
烷基酚类和双酚类内分泌干扰物因广泛存在各种环境介质中,能干扰生物体的内分泌系统而受到极大关注,尤其是壬基酚(NP)和双酚A (BPA)[1]。由于环境水体和食品中NP、BPA的含量低、基体复杂,在色谱分析前常需要进行样品前处理[2,3]。很多样品前处理技术已经用于提取不同样品中的NP和BPA,如液液萃取[4,5]、加速溶剂提取[6,7]、Oasis或C18固相萃取[8,9]等,但这些常规的提取技术缺乏选择性。
分子印迹技术是制备在空间结构和结合位点上与特定分子匹配的印迹聚合物。目前,制备NP或BPA分子印迹聚合物(MIPs)的方法多采用封管聚合法[10~13]。该方法简单、合成条件易于控制,但所得MIPs颗粒形状不规则,印迹位点包埋较深。乳液聚合法因可容易制备出粒径可控、识别选择性较高的印迹聚合物微球而受到青睐[14],但使用单一模板分子制备的MIPs同时去除复杂环境食品样品中烷基酚类和双酚类干扰物有其局限性。多数情况下,以BPA为模板分子制备的MIPs对烷基酚类物质识别选择性较差,反之亦然。Dickert等[15]提出双模板印迹的理念。用双模板或多模板分子制备的MIPs包含两种或多种印迹位点,可有效提高对不同类别目标分子的选择性识别[16,17]。目前,以NP和BPA为模板分子制备双模板分子印迹聚合物尚未见文献报道。
本实验应用双模板的理念,结合乳液聚合的优点,以壬基酚和双酚A为双模板分子,制备一种新型双分子印迹聚合物,并将其作为固相萃取填料,结合高效液相色谱-荧光检测(HPLC-FID),建立了环境水样、啤酒、鲫鱼中痕量NP和BPA的固相萃取-HPLC-FID分析方法。
2 实验部分
2.1 仪器与试剂
Agilent 1200高效液相色谱仪(美国 Agilent公司),UV/VIS 916 紫外可见分光光度计(澳大利亚GBC公司),FTIR-8400S红外分光光度计(日本岛津公司),SHA-B水浴恒温振荡器(深圳市亿通科技有限公司),KUDOS SK8200H超声清洗器(上海科导超声仪器有限公司),固相萃取装置(北京康林科技公司)。
壬基酚(NP)、双酚A(BPA)、3-氨基酚(3-AP)、对叔丁基苯酚(p-TBP)、a-甲基丙烯酸(MAA)、乙二醇二甲基丙烯酸酯(EGDMA)、偶氮二异丁腈(AIBN),均为分析纯(上海晶纯试剂有限公司);正十四烷、司盘80(Span80)和十六烷基三甲基溴化铵(CTAB),均为分析纯(天津市科密欧化学试剂有限公司); 甲醇为色谱纯; 实验用水为 Milli-Q水(美国Millipore公司)。
2.2 色谱检测条件
色谱柱为ODS-AP柱(250 mm× 4.6 mm, 5 μm),流动相:甲醇-水(95∶5, V/V),流速1.0 mL/min,荧光检测:激发波长228 nm,发射波长305 nm; 进样量20 μL。
2.3 乳化液的配制和分子印迹聚合物的制备
配制50 mL 1% 乳化液(含Span80-CTAB(3∶7, w/w),0.8 mmol十六烷)。超声20 min,形成稳定乳化液。
将0.22 g壬基酚、0.23 g双酚A溶于5 mL氯仿,加入0.34 g MAA和4.2 g EGDMA,超声5 min,通氮气5 min,将其缓慢倒入盛有25 mL乳化液的反应器中,超声乳化20 min,加入50 mg AIBN,于80 ℃水浴中机械搅拌,通氮气反应17 h。所得聚合物离心抽滤,依次用乙醇、水洗涤多次,再用甲醇-乙酸(9∶1, V/V)溶液反复洗涤至紫外检测不到壬基酚和双酚A,最后用蒸馏水洗至中性,60 ℃真空干燥,得到分子印迹聚合物(MIP)。非印迹聚合物(NIP)的制备方法除不加入模板分子外,其余步骤同上。
2.4 吸附实验
称取30 mg MIPs 和NIPs多份,分别加入10 mL不同浓度(0.4, 0.6, 0.8, 1.0, 1.2, 1.5和1.8 g/L)BPA或NP溶液中,室温振荡2 h,离心分离,取上清液稀释后,用紫外分光光度计分别在BPA和NP的最大吸收波长处测定其对应的吸光度,根据吸附前后溶液浓度的变化,由方程Q=(c0-c)V/m计算聚合物对BPA和NP的吸附量Q(mg/g)。
称取30.0 mg MIP和NIP,分别加入10 mL 1.0 g/L BPA, NP, 3-AP和p-TBP溶液,室温振荡2 h,离心,取上清液稀释后,用紫外分光光度计测各组分的平衡浓度,计算MIP和NIP对底物的选择性系数。
2.5 样品预处理
于2012年3月在肇庆市江滨码头进行单点表层采样[18]。采集的江水过0.22 μm 纤维素滤膜,于棕色玻璃瓶4 ℃贮存。 啤酒购自本地超市。取50 mL啤酒,超声脱气20 min。为去除单宁,加50 mL 1%聚乙烯醇6000,4 ℃温育过夜, 4000 r/min离心20 min,过0.22 μm滤膜,置于棕色玻璃瓶、4 ℃贮存。
市购鲫鱼6尾,重量500 g ± 200 g。将新鲜鱼鳃和鱼肉分别置于绞肉机中绞碎、匀浆成鱼泥。称取5 g鱼泥置于50 mL离心管,加入5 mL乙腈,涡旋2 min,4000 r/min离心10 min,分离上清液,残渣用5 mL乙腈重复提取一次。合并两次上清液,60 ℃下氮气吹至2 mL,进行固相萃取。
称取200 mg MIPs,均匀装填入商品SPE柱管(500 mg, 3 mL, 美国Supelco公司),加入筛板压实, 制成MISPE柱。依次用20 mL甲醇-乙酸(9∶1, V/V)溶液、3 mL水、5 mL甲醇活化柱子。将1 mL含0.10 mg/L BPA和NP溶液上样。考察不同种类和不同用量的淋洗剂、洗脱剂对BPA、NP萃取回收率的影响,优化萃取条件。
3 结果与讨论
3.1 聚合物的FTIR光谱
3.2 吸附特性
图2分别为MIP和NIP对NP, BPA的静态吸附曲线。由图2可见,MIP对NP和BPA的吸附在1.2 g/L达到饱和, NP, BPA的饱和吸附量分别为73.3 和97.5 mg/g。而相应条件下,NIP对NP, BPA的饱和吸附量分别为27.8 和31.2 mg/g。MIP对NP, BPA的吸附量显著高于NIP,这归因于MIP分子印迹效应形成的特异性识别的多静电作用位点和空间结构的互补性。
3.3 MIP的选择识别能力
选择3-氨基酚(3-AP)和对叔丁基苯酚(p-TBP)为结构类似物,考察MIP的吸附选择性。由实验测得吸附量(Qe),根据公式(2~4)计算分配系数(Kd),选择性系数(k)、相对选择性系数(α),结果如表1。由表1可知,MIP对BPA, NP的吸附量和分配系数远大于对3-AP和p-TBP;BPA, NP在MIP上的相对选择性系数分别是NIP的2.2和1.7倍。以上结果表明, MIP对模板分子BPA和NP具有强的结合能力和高的选择性。
3.4 固相萃取条件优化
考察3 mL 0~20%(V/V)甲醇-水的淋洗效果。结果表明,当甲醇含量大于5%,随甲醇用量增大,NP和BPA的损失缓慢增大,因此选择5%甲醇-水为淋洗液。考察淋洗液用量的影响。结果发现,当淋洗液用量大于4 mL,NP和BPA有不同程度的损失。因此淋洗液用量选择4 mL。
考察甲醇-水(9∶1, V/V)、纯甲醇和甲醇-乙酸(9∶1, V/V)3种洗脱液的洗脱效果。结果表明,以甲醇-乙酸为洗脱液,NP、BPA的萃取回收率最高。这是由于乙酸能够破坏分析物与印迹位点之间的氢键。相反,以甲醇-水为洗脱剂,NP、BPA的回收率最低,这是因为分析物的水溶性差; 而以纯甲醇为洗脱剂,杂质干扰比较大。因此,选择甲醇-乙酸(9∶1, V/V)为洗脱剂。考察洗脱剂用量对萃取回收率的影响。结果表明,随洗脱剂用量的增加,NP、BPA的萃取回收率增加,6 mL时达最大,分别为98.8%和98.1%。因此,洗脱剂的用量选择6 mL。
3.5 MISPE-HPLC-FID方法的建立
在优化的条件下,分别对BPA, NP, 3-AP和p-TBP系列混合标准溶液进行萃取和HPLC分析。BPA和NP的线性范围为0.01~2.3 mg/L,3-AP和p-TBP的线性范围为0.0055~1.5 mg/L;BPA, NP, 3-AP和p-TBP线性方程分别为y= Symbolm@@ 0.12+2762.78x (R2=0.9994),y= Symbolm@@ 3.83 + 753.38x (R2=0.9987),y=19.00+10005.72x (R2=0.9992),y= Symbolm@@ 1.16 + 1207.16x (R2=0.9993),检出限(S/N=3)为0.001~0.002 mg/L。对0.02 mg/L的BPA, NP, 3-AP和p-TBP水样进行5次平行测定,相应的回收率分别为98.1%, 97.3%, 91.6%和93.3%,RSD<5%。图3为0.02 mg/L混合标准溶液的高效液相色谱图。
3.6 实际样品分析
将本方法用于江水、啤酒和鲫鱼中BPA和NP的测定。图4为江水样品的HPLC图,分析结果见表2。从图4可见,样品经MISPE萃取后,可以有效去除基质的干扰。由表2可知,江水和啤酒中未检出BPA和NP;鱼肉和鱼鳃中未检出NP,但分别检出BPA,含量分别为3.3和11.0 ng/g; 鱼鳃中BPA的含量是鱼肉的3.3倍。4种样品的加标回收率在86.4%~99.1%之间,RSD≤6.2%。
References
1 López-Darias J, Germn-Hernndez M, Pino V, Afonso A M. Talanta, 2010, 80(5): 1611-1618
2 Ding W H, Wu C Y. J. Chinese Chem. Soci., ?2000, ?47(5): 1155-1160
3 Zhao R S, Wang X, Yuan J P, Zhang L L. Microchim. Acta, ?2009, ?165(3): 443-447
4 Wu M H, Wang L, Xu G, Liu N, Tang L, Zheng J, Bu T T, Lei B L. Environ. Monit. Assess, ?2013, ?185(11): 3149-3161
5 Salgueiro-Gonzlez N, Concha-Graa E, Turnes-Carou I, Muniategui-Lorenzo S, López-Mahía P, Prada-Rodríguez D. J. Chromatogr. A, ?2012, ?1223: 1-8
6 Shao B, Han H, Li D M, Ma Y, Tu X M, Wu Y G. Food Chem., ?2007, ?105(3): ?1236-1241
7 Sun H, Ge X, Lv Y, Wang A. J.Chromatogr. A, ?2012, ?1237: 1-23
8 Vega-Morales T, Sosa-Ferrera Z, Santana-Rodríguez J J. J.Chromatogr. A, ?2012, ?1230: 66-76
9 Cao X L, Perez-Locas C, Dufresne G, Clement G, Popovic S, Beraldin F, Dabeka R W, Feeley M. Food Add. Cont., ?2011, ?28: 791-798
10 XU Jing, WANG Huan-Huang, LIU Juan, ZHU Jing-Bo. Polyvinyl Chloride, ?2010, ?38(7): 35-38
徐 靖, 汪欢晃, 刘 娟, 朱静波. 聚氯乙烯, 2010, ?38(7): 35-38
11 Du T, Cheng J, Wu M, Wang X, Zhou H, Cheng M. J.Chromatogr. B, ?2014, ?951-952: ?104-109
12 LIN Fu-Hua, HUANG Xiao-Jia, YUAN Dong-Xing, NONG Shu-Yu. Chinese J. Anal. Chem., ?2012, ?40(2): ?243-248
林福华, 黄晓佳, 袁东星, 农舒予. 分析化学, 2012, ?40(2): ?243-248
13 Wang Y X, Ding Y, Rong F, Fu D. Polym. Bull., ?2012, ?68: 1255-1270
14 ZHU Li-Li, CAO Yu-Hua, CAO Guang-Qun. ?Chinese J. Anal. Chem., ?2013, ?41(11): 1724-1728
朱丽丽, 曹玉华, 曹光群. 分析化学, 2013, ?41(11): 1724-1728
15 Dickert F, Achatz P, Halikias K. Fresen J. Anal. Chem., ?2001, ?371(1): 11-15
16 Xia X L, Lai E P C, rmeci B. Environ. Sci. Pollut. Res., ?2013, ?20: 3331-3339
17 Zhang T, Ma C, Wu M, Ye Y, Chen H X, Huang J L. Microchim Acta, ?2013, ?180: ?695-702
18 Baggiani C, Baravalle P, Giovannoli C, Anfossi L, Giraudi G. Anal. Bioanal. Chem., ?2010, ?397: 815-822
Selective Solid Phase Extraction of Nonylphenol and Bisphenol A
in Environmental and Food Samples Using Double-Molecularly
Imprinted Polymer Microsphere
WEI Shou-Lian*1, LIU Ling1, LI Jing-Hua2, WANG Hong-Wu1, LIU Yong1
1(Faculty of Chemistry and Chemical Engineering, Zhaoqing University, Zhaoqing 526061, China)
2(Blue Ribbon Beer Co. Ltd., Zhaoqing 526040, China)
Abstract Double template molecularly imprinted polymer (D-MIP) was prepared by emulsion polymerization method using the nonylphenol (NP), bisphenol A (BPA) as templates, α-methyl methacrylate(MAA) as functional monomer. Then using the D-MIP as solid phase extraction materials, a method based on double-molecularly imprinted solid phase extraction coupled with high performance liquid chromatographic fluorescence detection was developed for the determination of trace NP and BPA from environmental and food samples. The D-MIP was characterized by Fourier transform infrared spectroscopy (FT-IR) and adsorption experiments. The results showed that the saturated adsorption capacity of the D-MIP for NP and BPA was 73.3 and 97.5 mg/g, respectively, and the relative selectivity coefficient was 2.2 and 1.7, respectively. Moreover, the conditions affecting extraction efficiency, such as washing conditions and desorption conditions were optimized. Under the optimal conditions, there was a good linear correlation in the concentration range of 0.01-2.3 mg/L with correlation coefficients (R2) greater than 0.998 for NP and BPA. The detection limits (S/N=3) were 0.001 and 0.002 mg/L. The proposed method was applied to determine NP and BPA in river water, beer and crucian carp samples. The recoveries of NP and BPA were in the range of 86.4%-99.1% with the relative standard deviation less than 6.2%. This method has good selectivity and high sensitivity and shows good prospects for the application in the enrichment and separation of NP and BPA in real samples.
Keywords Double-template molecularly imprinted; Nonylphenols; Bisphenol A; Solid phase extraction; High performance liquid chromatography
(Received 4 July 2014; accepted 8 October 2014

