基于电流脉冲沉积法的硝酸根微传感器研究
李洋+孙楫舟+王晋芬+边超+佟建华+董汉鹏+张虹+夏善红

摘 要 基于微加工技术(Microfabrication technology)制备微传感电极并进行电化学表面修饰,研制出一种用于水体中NO Symbolm@@ 3浓度检测的电化学微传感器。微传感器以两电极传感芯片为信号转换部件,使用电流脉冲沉积法在铂质工作电极表面制备微观形貌呈枝簇状的铜质敏感材料,利用铜质材料对酸性溶液中NO Symbolm@@ 3的电催化还原特性,测量还原电流的大小,实现对NO Symbolm@@ 3浓度的检测。采用扫描电子显微镜(SEM)和X射线衍射分析(XRD)技术对敏感膜进行表征和监测,探索高活性铜质敏感膜的制备方法;使用微传感器对硝酸盐标准样品进行检测,在低浓度范围(12.5~200 μmol/L),响应灵敏度为0.1422 μA/(μmol/L); 高浓度范围(200~3000 μmol/L),响应灵敏度为0.0984 μA/(μmol/L), 均表现出较高的检测灵敏度;使用微传感器对北京等地的实际湖库水样进行检测,结果与专业水质检测机构采用紫外分光光度法的测试结果偏差在 Symbolm@@ 3.9%~15.4%之间,两者具有一定的相关性,表明微传感器能够用于实际水样中NO Symbolm@@ 3浓度的测量。
关键词 电化学微传感器; 铜质敏感膜; 电流脉冲沉积法; 硝酸根离子检测; 湖库水样
1 引 言
硝酸盐广泛存在于自然环境、食品、工业产品和生态系统之中。研究证明,过量NO Symbolm@@ 3会引发严重的环境和生理问题[1],摄取过量的硝酸盐会严重危害人体健康,因此世界各国对饮用水中硝酸盐的含量都有严格规定。美国环境保护局(EPA)规定的最高限量为硝酸盐氮10 mg/L(0.7 mmol/L,以N计,下同);我国《生活饮用水卫生标准(GB5749-2006)》规定饮用水中硝酸盐浓度的限量值为10 mg/L;世界卫生组织(WHO)规定饮用水中硝酸盐氮含量必须低于11 mg/L(0.8 mmol/L)。因此,建立简便、灵敏、准确的硝酸根离子检测方法是十分必要的。
目前,NO Symbolm@@ 3的检测方法主要包括分光光度法、色谱分析法、发光分析法、毛细管电泳法、电化学检测法等[1,2]。基于光学原理的检测方法大多具有检出限低、准确性好、灵敏度高等优点,但检测设备价格比较昂贵,且需要对待测水样进行精细的预处理。而基于电化学原理的NO Symbolm@@ 3检测方法具有操作简便、所需试剂量少、易与测试电路集成、仪器装置简单便携等优点,因而近几年得到研究者的青睐。
到目前为止,研究人员已经发展了多种类型的电化学传感器用于水体中NO Symbolm@@ 3的检测,根据所测量的响应信号的不同, 可分为电位型传感器和电流型传感器两大类。电位型硝酸根传感器大多以NO Symbolm@@ 3选择性电极为核心部件,当选择性电极与含有NO Symbolm@@ 3的样品接触时,敏感膜和溶液的相界面上产生与NO Symbolm@@ 3活度相关的膜电势,测量膜电势的变化即可实现NO Symbolm@@ 3浓度的检测。常见的敏感膜材料包括聚氯乙烯(PVC)[3]、聚吡咯[4]和复合型聚合物材料[5]等。这种类型的硝酸根传感器结构简单、耐用,有些还可以在恶劣环境下使用(如测量潮湿土壤中硝酸盐的含量),但是其选择性识别能力往往较弱,难以用于具有复杂背景基质的水样检测。与电位型传感器相比,电流型传感器通常具有更高的检测灵敏度和更低的检出限。目前报道的硝酸根电化学传感器主要是电流型传感器,其工作原理是以固定在工作电极表面的敏感膜为介质,将待测样品中的NO Symbolm@@ 3还原为NO Symbolm@@ 2或其它含氮物质,测量还原电流的大小,以实现对NO Symbolm@@ 3浓度的检测。常用的硝酸根敏感膜按材料性质不同可分为金属、导电聚合物以及生物酶材料等。用于NO Symbolm@@ 3检测的金属敏感材料主要有Cu[6,7]、Ag[8,9]、Pd[10,11]以及合金[12,13]等。导电聚合物敏感材料主要是掺杂的聚吡咯膜[14,15]。近年, 研究人员利用生物酶固定技术将NO Symbolm@@ 3还原酶固定在检测电极表面用于NO Symbolm@@ 3的选择性识别[16,17]。其中,聚吡咯和生物酶材料在制备和使用过程中需要严格控制环境光线和温度,导致其应用领域受限。而在金属类敏感材料中,由于铜具有廉价、易于制备、相对较稳定等特点,近年来以铜作为电极修饰材料,用于NO Symbolm@@ 3检测的探索,成为研究热点之一。
已有的文献大都使用恒定电位法在电极表面制备铜质敏感膜,研究重点集中于沉积电位的选取和沉积时间的优化[18,19]。而通过改变电沉积方式改善修饰层的微观形貌,以提高修饰铜质敏感材料对NO Symbolm@@ 3电催化还原活性的研究少有报道[20]。最近,文献[21]报道了一种新的电流脉冲沉积法制备铜材料的方法,此方法以含高浓度H+的CuSO4溶液为沉积液,采用高频脉冲电流的加电方式,能够制备出在微观上呈蜂窝状多孔结构的铜层。但是相关报道中均使用铜质的基底电极,而且制备的多孔状铜膜大多被用作贵金属催化材料(如纳米铂或纳米金等)的依附结构层[22],直接将其作为敏感层修饰材料的研究还未见报道。本研究利用类似的电流脉冲沉积法在铂质微传感电极上制备出呈多孔、枝簇状的铜质敏感层,并将其应用于不同浓度NO Symbolm@@ 3标准样品的检测,表现出较高的检测灵敏度;使用修饰后的微传感电极对实际水样进行检测,测试结果与专业水质检测机构的测试值之间具有较高的一致性。
2 实验部分
2.1 仪器与试剂
S-4800扫描电镜 (FE-SEM,日本Hitachi公司);凯美瑞Reference-600电化学分析仪(美国Gamry公司);AUW电子天平,BioSpec-nano紫外可见分光光度计(日本岛津公司);Direct-Q3UV高纯水机(美国Millipore公司);pHS-25型数显pH计(上海智光仪器仪表公司);CHI111型Ag/AgCl参比电极(上海辰华公司)。
CuSO4·5H2O,Na2SO4,NaNO3和98% H2SO4(北京化学试剂公司);硝酸盐标准试样50 mg/L(北京环境保护部标准化研究所);所用溶剂均为分析纯,实验用水均为30 MΩ·cm去离子水。采用三电极体系,参比电极为Ag/AgCl电极,工作电极和对电极为实验室自制微传感电极。
2.2 微传感电极加工制备
采用标准微加工工艺在玻璃基片上制备微传感电极[20],制备工艺流程如图1A所示,主要采用光刻、溅射、剥离等工艺制备。所制备的微传感电极照片如图1B所示。其中, 工作电极和对电极为对称式“圆-环形”结构的铂质金属膜电极,工作电极为半径约为0.56 mm、
面积为1 mm2的圆,对电极为宽度0.4 mm、面积约为1 mm2的近圆环该结构能够提高工作电极与对电极之间电场分布的对称性,改善传感电极的电化学响应性能[20]。敏感表面是主要的电化学修饰和反应界面,为提高微传感电极的一致性,使用SU-8绝缘层精确定义薄膜金属电极的几何形状,确保每一个微传感电极的敏感表面均是面积为1 mm2的标准圆形。此外,微传感电极还包括一个备用的准参比电极,后续可以在该电极上涂覆银/氯化银浆,实现集成式三电极体系。本研究为确保参比电极的稳定性,直接使用商用Ag/AgCl参比电极。
2.3 铜质敏感膜制备
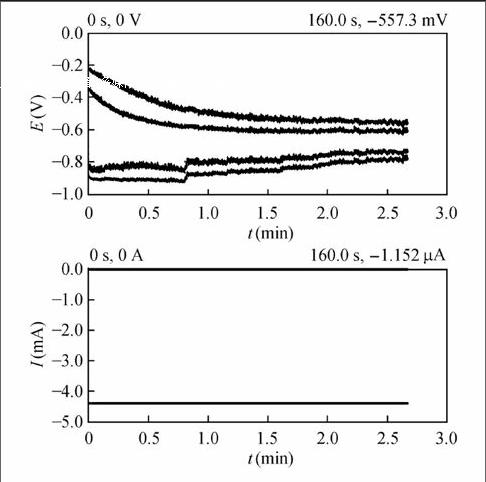
在酸化的CuSO4溶液中,采用在微传感芯片的工作电极和对电极之间施加脉冲电流信号的方式,将铜沉积在工作电极表面,制备敏感膜:首先,将微电极芯片在丙酮、乙醇、去离子水中依次超声5 min以清洁电极表面,并使用等离子氧刻蚀机进一步清洁并活化电极表面;之后,将微电极浸入含0.10 mol/L CuSO4和0.50 mol/L H2SO4的混合溶液,利用电化学分析仪中的Repeating Chronopotentionmetry扫描功能,在工作电极上施加周期性脉冲电流信号(一个完整的脉冲周期T=T1+T2,其中T1为工作阶段,加电沉积;T2为暂停阶段,停止沉积)。电流脉冲法的电化学沉积曲线如图2所示。电流脉冲沉积法修饰的工作电极,表面呈深黑色。为防止新沉积的铜在空气中被氧化,沉积完成后,用去离子水冲洗电极表面,并将电极放入去离子水中保存,4 h内使用,否则铜质敏感膜将逐渐失去活性,影响传感器的检测性能。
3 结果与讨论
3.1 参数优化
3.1.1 电流脉冲沉积法的工作机理 根据文献[21]对电流脉冲沉积的脉冲参数设置进行优化,本实验参数为:T1=0.01 s, I1= Symbolm@@ 4.4 mA; T2=0.01 s, I2=0.0 mA; 0.50 mol/L H2SO4;并对沉积时间(脉冲周期数)和沉积液中CuSO4的浓度进行优化。
当保持沉积液中CuSO4浓度为0.1 mol/L时,不同沉积时间下所制备的敏感膜的微观形貌如图3所示。发现使用电流脉冲法可以在微传感电极的工作表面制备呈多孔形态的铜质敏感膜;随着扫描周期数(沉积时间)的增加,敏感膜的微观形貌由均匀分布的“枝干”结构向密集、多孔的“树枝”状结构发展。此种微观形貌的形成机理主要与两方面因素有关[21]:(1)沉积液中含有高浓度的H+,因此,伴随Cu2+被还原的电沉积过程,工作电极表面会发生析氢现象,析出的微小气泡像模板一样附着在电极表面,影响电极表面流体动力学微环境,使铜原子无法在该区域生长,进而导致敏感膜中出现均匀分布的凹陷多孔区;(2)采用脉冲电流,使敏感膜的生长和暂停生长阶段随着脉冲周期交替进行,可以避免持续加电条件下沉积膜生长过快,易于开裂、脱落的现象。以这种方式制备的敏感层,虽然分布疏松、呈现多孔形貌,但自身结构坚实、与基底电极粘附紧密,因而是一种理想的表面催化活性材料。同时,本研究采用铂基底电极,相对于文献中通常采用的铜质基底电极,H+在铂表面更容易发生析氢反应,因而此种条件下制备的敏感层的多孔形态更加显著。
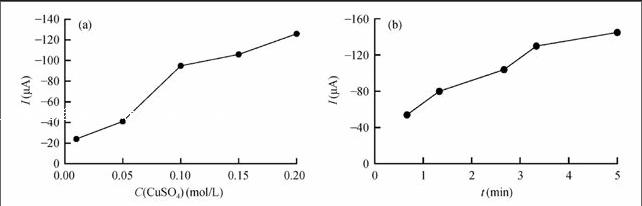
3.1.2 电流脉冲沉积法的参数优化 为考察不同沉积液浓度下,制备的敏感膜的实际性能,使用所制备的敏感膜对同一种测试液(含浓度为1 mmol/L NaNO3)做检测[20],通过线性扫描的方式,比较响应电流值的大小,结果如图4所示。当CuSO4浓度为0.15 mol/L,沉积时间为200 s时,微传感电极的响应电流值较大,且重复性最好,故后续实验均采用此条件进行表面修饰。当CuSO4浓度为0.20 mol/L或沉积时间为300 s时,修饰层厚度迅速增大,且沿工作电极表面向外径方向延伸,已超出1 mm2的敏感区域,为保证实验条件的一致,排除此沉积条件。
在优化参数下,所制备的敏感膜的微观形貌如图5所示,在铂微电极表面生成了疏松的、呈多孔性的枝簇状结构。枝簇结构分布均匀,由微米尺寸的颗粒沿着一定的空间方向、突出于电极表面形成三维的堆叠结构。
对修饰层材料进行X射线衍射分析(XRD)分析(图6),发现修饰层材料明显地表现出Cu在(111)和(200)两个取向的特征峰,说明电流脉冲法制备的敏感层是金属铜,且晶向明显,而非氧化态铜。
3.2 微传感器对NO Symbolm@@ 3的检测性能
将微传感器浸入含有不同浓度NO Symbolm@@ 3的待测液中做线性扫描测试,考察NO Symbolm@@ 3浓度与还原峰电流大小的关系(实验支持电解液均为0.1 mol/L Na2SO4溶液,pH=2.0)。
图7所示为微传感器在浓度0~3000 μmol/L硝酸盐标准品中的线性扫描响应曲线。在12.5~200 μmol/L(图7(a))和200~3000 μmol/L(图7b)浓度范围内,微传感器响应电流值与NO Symbolm@@ 3浓度具有良好的线性关系。两种浓度范围内线性拟合曲线分别为:
需要注意的是,在低浓度范围内,微传感器在不同浓度NO Symbolm@@ 3样品中的还原峰电位为 Symbolm@@ 460 mV,基本保持不变;而在高浓度范围内,随着NO Symbolm@@ 3浓度增加,其还原峰电位逐步由 Symbolm@@ 460 mV偏移至 Symbolm@@ 550 mV,且微传感器的检测灵敏度也有降低。这是由于在溶液环境中使用安培型电化学传感器时,待测物在修饰材料表面发生电化学反应会生成一些产物,随着待测物浓度的升高和测试次数的增加,反应产物会逐渐附着在修饰材料的表面,使其有效面积逐步缩减,电催化活性也随之降低,即出现电极钝化效应。当铜质敏感材料的电催化活性下降后,针对NO Symbolm@@ 3的电催化还原反应更难于发生,因此其还原峰电位随之负移至 Symbolm@@ 550 mV处,而传感器的检测灵敏度也同时减小。
经电流脉冲沉积法修饰的微传感器对NO Symbolm@@ 3进行测试时表现出较好的重复性和抗干扰性,水体中常见的离子除NO Symbolm@@ 2外,均未对测试结果产生明显的干扰[20]。微传感器对0, 14.3, 35.7, 71.4, 107.1和142.9 μmol/L 6个硝酸盐标准样品重复测试3次,其中最大相对标准偏差RSD<5%。检出限为2 μmol/L(S/N=3)。
3.3 实际水样检测
为考察微传感器对实际水样的检测性能,取实际水样,对比微传感器的测试结果以及专业水质检测机构的测试结果。在北京市某地的湖泊及河道分别取水样,标记为水样1、水样2和水样3,并对3个水样分别进行分样,所分水样一部分送至专业水质检测机构按照硝酸盐国标检测法之一的紫外分光光度法(HJ T 346-2007)进行测试,另一部分水样使用本文研制的微传感器进行测试。对于每一个水样,在实验室均使用3支微传感器进行测试,每支传感器均先以3个硝酸盐标准品(0,50,100 μmol/L)定标,
然后进行水样检测。从表1可见,微传感器的测试结果与专业机构出具的测试值偏差在3.9%~15.4%之间,具有一定的相关性。实验结果表明,微传感器可用于实际水样中NO Symbolm@@ 3浓度的检测。
4 结 论
使用电流脉冲沉积法在铂质微电极表面制备出枝簇状、多孔的铜质敏感膜,利用铜在酸性溶液中对NO Symbolm@@ 3的电催化还原特性,实现溶液中NO Symbolm@@ 3的检测,依据此种原理研制的电化学硝酸根微传感器能够用于实际水样中NO Symbolm@@ 3的检测,且测量结果与专业水质检测机构出具的结果具有一定的相关性。
References
1 Matthew J M, James D, Richard G C. Talanta, 2001, 54: 785-803
2 Radha D, Maria M V, Nathan S L, James D. Electroanal., ?2009, ?21(7): 789-796
3 Vinod K G, Lok P S, Sudeshna C. Talanta, ?2011, ?85: 970-974
4 Tatyana A B, Scott M, Yu-Chong T, Thomas C H. Sens. Actuators B, 2007, ?123: 127-134
5 Rawat A, Chandra S, Sarkar A. Sens. Lett., ?2009, ?7: 1100-1105
6 Juan C M G, Roselyn C P, Thiago R L C P, Mauro B. ?Talanta, ?2009, ?80: 581-585
7 Thiago R L C P, Juliana L C, Mauro B. Talanta, ?2007, ?71: 186-191
8 Dohyun K, Ira B G, Jack W J. Sens. Actuator B, ?2009, ?135: 618-624
9 Dohyun K, Ira B G, Jack W J. Analyst, ?2007, ?132: 350-357
10 de Vooys A C A, van Santen R A, van Veen J A R. J. Mol. Catal. A: Chem., ?2000, ?154: 203-215
11 Ying W, Jiu H Q, Hui J L. Chinese Chem. Lett., ?2006, ?17(1): 61-64
12 Alexandros A, Louise H, Brian E H. J. Catal., ?2013, ?305: 27-35
13 Kerkeni S, Lamy-Pitara E, Barbier J. Catal. Today, ?2002, ?75: 35-42
14 Shyam A, Shekhar B. Sens. Actuators B, ?2008, ?132: 623-630
15 Tatyana A B, Scott M, Tai Y C, Thomas C H. Sens. Actuator B., ?2007, ?123: 127-134
16 Silva S D, Shan D, Cosnier S. Sens. Actuators B, ?2004, ?103: 397-402
17 De Q, Jun H S, Jong D K. Anal. Chem., ?2005, ?77(14): 4467-4473
18 Ali O S, Pnar G, Ebru G, Faruk G. Microchim. Acta, ?2000, ?134: 77-82
19 Christine M W, Michael E H, Craig E B, Richard G C. Anal. Sci., ?2005, ?21: 1421-1430
20 LI Yang, SUN Ji-Zhou, BIAN Chao, TONG Jian-Hua, XIA Shan-Hong. Chinese J. Anal. Chem., ?2011, ?39(11): 1621-1628
李 洋, 孙楫舟, 边 超, 佟建华, 夏善红. 分析化学, 2011, ?39(11): 1621-1628
21 Nebojsa D N, Goran B, Konstantin I P. Mate. Chem. Phys., ?2011, ?125: 587-594
22 Yin J, Jia J B, Zhu L D. Int. J. Hydrogen Energ., ?2008, ?33: 7444-7447
A Micro Electrochemical Sensor for Nitrate Determination Based
on Square-wave Pulsating Current Deposition Process
LI Yang*, SUN Ji-Zhou, WANG Jin-Feng, BIAN Chao, TONG Jian-Hua,
DONG Han-Peng, ZHANG Hong, XIA Shan-Hong
(State Key Laboratory of Transducer Technology, Institute of Electronics, Chinese Academy of Sciences, Beijing 100190, China)
Abstract Based on microfabrication technology and electrochemical modification method, a micro electrochemical sensor for nitrate (NO Symbolm@@ 3) determination was developed. A micro sensor chip with working electrode and counter electrode was used as the signal convertor of the sensor. The area of the micro working-electrode was only 1 mm2. As an electrocatalysis sensitive material, copper was electrodeposited onto the working electrode by square-wave pulse current electrodeposition method. The morphologies and components of freshly deposited materials were examined by scanning electron microscopy (SEM) and X-ray diffraction (XRD) to explore key factors that affected the electrocatalytic ability of the deposited copper layer for reducing nitrate ions. The experimental results revealed that under the optimal conditions, the deposited copper layer was macroporous and had a larger effective surface area that could serve as a more effective electrocatalyst in facilitating nitrate reduction. Electrochemical response of the macroporous copper layer was characterized by linear sweep voltammetry in acidic supporting electrolytes (pH=2). The electroanalytical results showed that the modified microsensor had marked sensitivity for standard nitrate samples within the concentration range from 12.5 to 3000 μmol/L (in the range of 12.5-200 μmol/L yielded straight line: y1= Symbolm@@ 0.1422x-10.326, R12=0.9976, while in the range of 200-3000 μmol/L yielded straight line: y2= Symbolm@@ 0.0984x-22.144, R22=0.9927) with a detection limit of 2 μmol/L (S/N=3). The developed electrochemical microsensor was also employed for nitrate determination in water samples collected from lakes and rivers near the city of Beijing. The results were in good agreement with the data given by qualified water quality detection institute, with the deviations from 3.9% to 15.4%.
Keywords Micro electrochemical sensor; Copper sensitive material; Pulsating current electrodeposition method; Nitrate determination; Real water samples
(Received 1 July 2014; accepted 27 July 2014)
This work was supported by the National High Technology Research and Development Program of China (No.2012AA040506) and the National Natural Science Foundation of China (Nos. 61302034, 61134010)



摘 要 基于微加工技术(Microfabrication technology)制备微传感电极并进行电化学表面修饰,研制出一种用于水体中NO Symbolm@@ 3浓度检测的电化学微传感器。微传感器以两电极传感芯片为信号转换部件,使用电流脉冲沉积法在铂质工作电极表面制备微观形貌呈枝簇状的铜质敏感材料,利用铜质材料对酸性溶液中NO Symbolm@@ 3的电催化还原特性,测量还原电流的大小,实现对NO Symbolm@@ 3浓度的检测。采用扫描电子显微镜(SEM)和X射线衍射分析(XRD)技术对敏感膜进行表征和监测,探索高活性铜质敏感膜的制备方法;使用微传感器对硝酸盐标准样品进行检测,在低浓度范围(12.5~200 μmol/L),响应灵敏度为0.1422 μA/(μmol/L); 高浓度范围(200~3000 μmol/L),响应灵敏度为0.0984 μA/(μmol/L), 均表现出较高的检测灵敏度;使用微传感器对北京等地的实际湖库水样进行检测,结果与专业水质检测机构采用紫外分光光度法的测试结果偏差在 Symbolm@@ 3.9%~15.4%之间,两者具有一定的相关性,表明微传感器能够用于实际水样中NO Symbolm@@ 3浓度的测量。
关键词 电化学微传感器; 铜质敏感膜; 电流脉冲沉积法; 硝酸根离子检测; 湖库水样
1 引 言
硝酸盐广泛存在于自然环境、食品、工业产品和生态系统之中。研究证明,过量NO Symbolm@@ 3会引发严重的环境和生理问题[1],摄取过量的硝酸盐会严重危害人体健康,因此世界各国对饮用水中硝酸盐的含量都有严格规定。美国环境保护局(EPA)规定的最高限量为硝酸盐氮10 mg/L(0.7 mmol/L,以N计,下同);我国《生活饮用水卫生标准(GB5749-2006)》规定饮用水中硝酸盐浓度的限量值为10 mg/L;世界卫生组织(WHO)规定饮用水中硝酸盐氮含量必须低于11 mg/L(0.8 mmol/L)。因此,建立简便、灵敏、准确的硝酸根离子检测方法是十分必要的。
目前,NO Symbolm@@ 3的检测方法主要包括分光光度法、色谱分析法、发光分析法、毛细管电泳法、电化学检测法等[1,2]。基于光学原理的检测方法大多具有检出限低、准确性好、灵敏度高等优点,但检测设备价格比较昂贵,且需要对待测水样进行精细的预处理。而基于电化学原理的NO Symbolm@@ 3检测方法具有操作简便、所需试剂量少、易与测试电路集成、仪器装置简单便携等优点,因而近几年得到研究者的青睐。
到目前为止,研究人员已经发展了多种类型的电化学传感器用于水体中NO Symbolm@@ 3的检测,根据所测量的响应信号的不同, 可分为电位型传感器和电流型传感器两大类。电位型硝酸根传感器大多以NO Symbolm@@ 3选择性电极为核心部件,当选择性电极与含有NO Symbolm@@ 3的样品接触时,敏感膜和溶液的相界面上产生与NO Symbolm@@ 3活度相关的膜电势,测量膜电势的变化即可实现NO Symbolm@@ 3浓度的检测。常见的敏感膜材料包括聚氯乙烯(PVC)[3]、聚吡咯[4]和复合型聚合物材料[5]等。这种类型的硝酸根传感器结构简单、耐用,有些还可以在恶劣环境下使用(如测量潮湿土壤中硝酸盐的含量),但是其选择性识别能力往往较弱,难以用于具有复杂背景基质的水样检测。与电位型传感器相比,电流型传感器通常具有更高的检测灵敏度和更低的检出限。目前报道的硝酸根电化学传感器主要是电流型传感器,其工作原理是以固定在工作电极表面的敏感膜为介质,将待测样品中的NO Symbolm@@ 3还原为NO Symbolm@@ 2或其它含氮物质,测量还原电流的大小,以实现对NO Symbolm@@ 3浓度的检测。常用的硝酸根敏感膜按材料性质不同可分为金属、导电聚合物以及生物酶材料等。用于NO Symbolm@@ 3检测的金属敏感材料主要有Cu[6,7]、Ag[8,9]、Pd[10,11]以及合金[12,13]等。导电聚合物敏感材料主要是掺杂的聚吡咯膜[14,15]。近年, 研究人员利用生物酶固定技术将NO Symbolm@@ 3还原酶固定在检测电极表面用于NO Symbolm@@ 3的选择性识别[16,17]。其中,聚吡咯和生物酶材料在制备和使用过程中需要严格控制环境光线和温度,导致其应用领域受限。而在金属类敏感材料中,由于铜具有廉价、易于制备、相对较稳定等特点,近年来以铜作为电极修饰材料,用于NO Symbolm@@ 3检测的探索,成为研究热点之一。
已有的文献大都使用恒定电位法在电极表面制备铜质敏感膜,研究重点集中于沉积电位的选取和沉积时间的优化[18,19]。而通过改变电沉积方式改善修饰层的微观形貌,以提高修饰铜质敏感材料对NO Symbolm@@ 3电催化还原活性的研究少有报道[20]。最近,文献[21]报道了一种新的电流脉冲沉积法制备铜材料的方法,此方法以含高浓度H+的CuSO4溶液为沉积液,采用高频脉冲电流的加电方式,能够制备出在微观上呈蜂窝状多孔结构的铜层。但是相关报道中均使用铜质的基底电极,而且制备的多孔状铜膜大多被用作贵金属催化材料(如纳米铂或纳米金等)的依附结构层[22],直接将其作为敏感层修饰材料的研究还未见报道。本研究利用类似的电流脉冲沉积法在铂质微传感电极上制备出呈多孔、枝簇状的铜质敏感层,并将其应用于不同浓度NO Symbolm@@ 3标准样品的检测,表现出较高的检测灵敏度;使用修饰后的微传感电极对实际水样进行检测,测试结果与专业水质检测机构的测试值之间具有较高的一致性。
2 实验部分
2.1 仪器与试剂
S-4800扫描电镜 (FE-SEM,日本Hitachi公司);凯美瑞Reference-600电化学分析仪(美国Gamry公司);AUW电子天平,BioSpec-nano紫外可见分光光度计(日本岛津公司);Direct-Q3UV高纯水机(美国Millipore公司);pHS-25型数显pH计(上海智光仪器仪表公司);CHI111型Ag/AgCl参比电极(上海辰华公司)。
CuSO4·5H2O,Na2SO4,NaNO3和98% H2SO4(北京化学试剂公司);硝酸盐标准试样50 mg/L(北京环境保护部标准化研究所);所用溶剂均为分析纯,实验用水均为30 MΩ·cm去离子水。采用三电极体系,参比电极为Ag/AgCl电极,工作电极和对电极为实验室自制微传感电极。
2.2 微传感电极加工制备
采用标准微加工工艺在玻璃基片上制备微传感电极[20],制备工艺流程如图1A所示,主要采用光刻、溅射、剥离等工艺制备。所制备的微传感电极照片如图1B所示。其中, 工作电极和对电极为对称式“圆-环形”结构的铂质金属膜电极,工作电极为半径约为0.56 mm、
面积为1 mm2的圆,对电极为宽度0.4 mm、面积约为1 mm2的近圆环该结构能够提高工作电极与对电极之间电场分布的对称性,改善传感电极的电化学响应性能[20]。敏感表面是主要的电化学修饰和反应界面,为提高微传感电极的一致性,使用SU-8绝缘层精确定义薄膜金属电极的几何形状,确保每一个微传感电极的敏感表面均是面积为1 mm2的标准圆形。此外,微传感电极还包括一个备用的准参比电极,后续可以在该电极上涂覆银/氯化银浆,实现集成式三电极体系。本研究为确保参比电极的稳定性,直接使用商用Ag/AgCl参比电极。
2.3 铜质敏感膜制备
在酸化的CuSO4溶液中,采用在微传感芯片的工作电极和对电极之间施加脉冲电流信号的方式,将铜沉积在工作电极表面,制备敏感膜:首先,将微电极芯片在丙酮、乙醇、去离子水中依次超声5 min以清洁电极表面,并使用等离子氧刻蚀机进一步清洁并活化电极表面;之后,将微电极浸入含0.10 mol/L CuSO4和0.50 mol/L H2SO4的混合溶液,利用电化学分析仪中的Repeating Chronopotentionmetry扫描功能,在工作电极上施加周期性脉冲电流信号(一个完整的脉冲周期T=T1+T2,其中T1为工作阶段,加电沉积;T2为暂停阶段,停止沉积)。电流脉冲法的电化学沉积曲线如图2所示。电流脉冲沉积法修饰的工作电极,表面呈深黑色。为防止新沉积的铜在空气中被氧化,沉积完成后,用去离子水冲洗电极表面,并将电极放入去离子水中保存,4 h内使用,否则铜质敏感膜将逐渐失去活性,影响传感器的检测性能。
3 结果与讨论
3.1 参数优化
3.1.1 电流脉冲沉积法的工作机理 根据文献[21]对电流脉冲沉积的脉冲参数设置进行优化,本实验参数为:T1=0.01 s, I1= Symbolm@@ 4.4 mA; T2=0.01 s, I2=0.0 mA; 0.50 mol/L H2SO4;并对沉积时间(脉冲周期数)和沉积液中CuSO4的浓度进行优化。
当保持沉积液中CuSO4浓度为0.1 mol/L时,不同沉积时间下所制备的敏感膜的微观形貌如图3所示。发现使用电流脉冲法可以在微传感电极的工作表面制备呈多孔形态的铜质敏感膜;随着扫描周期数(沉积时间)的增加,敏感膜的微观形貌由均匀分布的“枝干”结构向密集、多孔的“树枝”状结构发展。此种微观形貌的形成机理主要与两方面因素有关[21]:(1)沉积液中含有高浓度的H+,因此,伴随Cu2+被还原的电沉积过程,工作电极表面会发生析氢现象,析出的微小气泡像模板一样附着在电极表面,影响电极表面流体动力学微环境,使铜原子无法在该区域生长,进而导致敏感膜中出现均匀分布的凹陷多孔区;(2)采用脉冲电流,使敏感膜的生长和暂停生长阶段随着脉冲周期交替进行,可以避免持续加电条件下沉积膜生长过快,易于开裂、脱落的现象。以这种方式制备的敏感层,虽然分布疏松、呈现多孔形貌,但自身结构坚实、与基底电极粘附紧密,因而是一种理想的表面催化活性材料。同时,本研究采用铂基底电极,相对于文献中通常采用的铜质基底电极,H+在铂表面更容易发生析氢反应,因而此种条件下制备的敏感层的多孔形态更加显著。
3.1.2 电流脉冲沉积法的参数优化 为考察不同沉积液浓度下,制备的敏感膜的实际性能,使用所制备的敏感膜对同一种测试液(含浓度为1 mmol/L NaNO3)做检测[20],通过线性扫描的方式,比较响应电流值的大小,结果如图4所示。当CuSO4浓度为0.15 mol/L,沉积时间为200 s时,微传感电极的响应电流值较大,且重复性最好,故后续实验均采用此条件进行表面修饰。当CuSO4浓度为0.20 mol/L或沉积时间为300 s时,修饰层厚度迅速增大,且沿工作电极表面向外径方向延伸,已超出1 mm2的敏感区域,为保证实验条件的一致,排除此沉积条件。
在优化参数下,所制备的敏感膜的微观形貌如图5所示,在铂微电极表面生成了疏松的、呈多孔性的枝簇状结构。枝簇结构分布均匀,由微米尺寸的颗粒沿着一定的空间方向、突出于电极表面形成三维的堆叠结构。
对修饰层材料进行X射线衍射分析(XRD)分析(图6),发现修饰层材料明显地表现出Cu在(111)和(200)两个取向的特征峰,说明电流脉冲法制备的敏感层是金属铜,且晶向明显,而非氧化态铜。
3.2 微传感器对NO Symbolm@@ 3的检测性能
将微传感器浸入含有不同浓度NO Symbolm@@ 3的待测液中做线性扫描测试,考察NO Symbolm@@ 3浓度与还原峰电流大小的关系(实验支持电解液均为0.1 mol/L Na2SO4溶液,pH=2.0)。
图7所示为微传感器在浓度0~3000 μmol/L硝酸盐标准品中的线性扫描响应曲线。在12.5~200 μmol/L(图7(a))和200~3000 μmol/L(图7b)浓度范围内,微传感器响应电流值与NO Symbolm@@ 3浓度具有良好的线性关系。两种浓度范围内线性拟合曲线分别为:
需要注意的是,在低浓度范围内,微传感器在不同浓度NO Symbolm@@ 3样品中的还原峰电位为 Symbolm@@ 460 mV,基本保持不变;而在高浓度范围内,随着NO Symbolm@@ 3浓度增加,其还原峰电位逐步由 Symbolm@@ 460 mV偏移至 Symbolm@@ 550 mV,且微传感器的检测灵敏度也有降低。这是由于在溶液环境中使用安培型电化学传感器时,待测物在修饰材料表面发生电化学反应会生成一些产物,随着待测物浓度的升高和测试次数的增加,反应产物会逐渐附着在修饰材料的表面,使其有效面积逐步缩减,电催化活性也随之降低,即出现电极钝化效应。当铜质敏感材料的电催化活性下降后,针对NO Symbolm@@ 3的电催化还原反应更难于发生,因此其还原峰电位随之负移至 Symbolm@@ 550 mV处,而传感器的检测灵敏度也同时减小。
经电流脉冲沉积法修饰的微传感器对NO Symbolm@@ 3进行测试时表现出较好的重复性和抗干扰性,水体中常见的离子除NO Symbolm@@ 2外,均未对测试结果产生明显的干扰[20]。微传感器对0, 14.3, 35.7, 71.4, 107.1和142.9 μmol/L 6个硝酸盐标准样品重复测试3次,其中最大相对标准偏差RSD<5%。检出限为2 μmol/L(S/N=3)。
3.3 实际水样检测
为考察微传感器对实际水样的检测性能,取实际水样,对比微传感器的测试结果以及专业水质检测机构的测试结果。在北京市某地的湖泊及河道分别取水样,标记为水样1、水样2和水样3,并对3个水样分别进行分样,所分水样一部分送至专业水质检测机构按照硝酸盐国标检测法之一的紫外分光光度法(HJ T 346-2007)进行测试,另一部分水样使用本文研制的微传感器进行测试。对于每一个水样,在实验室均使用3支微传感器进行测试,每支传感器均先以3个硝酸盐标准品(0,50,100 μmol/L)定标,
然后进行水样检测。从表1可见,微传感器的测试结果与专业机构出具的测试值偏差在3.9%~15.4%之间,具有一定的相关性。实验结果表明,微传感器可用于实际水样中NO Symbolm@@ 3浓度的检测。
4 结 论
使用电流脉冲沉积法在铂质微电极表面制备出枝簇状、多孔的铜质敏感膜,利用铜在酸性溶液中对NO Symbolm@@ 3的电催化还原特性,实现溶液中NO Symbolm@@ 3的检测,依据此种原理研制的电化学硝酸根微传感器能够用于实际水样中NO Symbolm@@ 3的检测,且测量结果与专业水质检测机构出具的结果具有一定的相关性。
References
1 Matthew J M, James D, Richard G C. Talanta, 2001, 54: 785-803
2 Radha D, Maria M V, Nathan S L, James D. Electroanal., ?2009, ?21(7): 789-796
3 Vinod K G, Lok P S, Sudeshna C. Talanta, ?2011, ?85: 970-974
4 Tatyana A B, Scott M, Yu-Chong T, Thomas C H. Sens. Actuators B, 2007, ?123: 127-134
5 Rawat A, Chandra S, Sarkar A. Sens. Lett., ?2009, ?7: 1100-1105
6 Juan C M G, Roselyn C P, Thiago R L C P, Mauro B. ?Talanta, ?2009, ?80: 581-585
7 Thiago R L C P, Juliana L C, Mauro B. Talanta, ?2007, ?71: 186-191
8 Dohyun K, Ira B G, Jack W J. Sens. Actuator B, ?2009, ?135: 618-624
9 Dohyun K, Ira B G, Jack W J. Analyst, ?2007, ?132: 350-357
10 de Vooys A C A, van Santen R A, van Veen J A R. J. Mol. Catal. A: Chem., ?2000, ?154: 203-215
11 Ying W, Jiu H Q, Hui J L. Chinese Chem. Lett., ?2006, ?17(1): 61-64
12 Alexandros A, Louise H, Brian E H. J. Catal., ?2013, ?305: 27-35
13 Kerkeni S, Lamy-Pitara E, Barbier J. Catal. Today, ?2002, ?75: 35-42
14 Shyam A, Shekhar B. Sens. Actuators B, ?2008, ?132: 623-630
15 Tatyana A B, Scott M, Tai Y C, Thomas C H. Sens. Actuator B., ?2007, ?123: 127-134
16 Silva S D, Shan D, Cosnier S. Sens. Actuators B, ?2004, ?103: 397-402
17 De Q, Jun H S, Jong D K. Anal. Chem., ?2005, ?77(14): 4467-4473
18 Ali O S, Pnar G, Ebru G, Faruk G. Microchim. Acta, ?2000, ?134: 77-82
19 Christine M W, Michael E H, Craig E B, Richard G C. Anal. Sci., ?2005, ?21: 1421-1430
20 LI Yang, SUN Ji-Zhou, BIAN Chao, TONG Jian-Hua, XIA Shan-Hong. Chinese J. Anal. Chem., ?2011, ?39(11): 1621-1628
李 洋, 孙楫舟, 边 超, 佟建华, 夏善红. 分析化学, 2011, ?39(11): 1621-1628
21 Nebojsa D N, Goran B, Konstantin I P. Mate. Chem. Phys., ?2011, ?125: 587-594
22 Yin J, Jia J B, Zhu L D. Int. J. Hydrogen Energ., ?2008, ?33: 7444-7447
A Micro Electrochemical Sensor for Nitrate Determination Based
on Square-wave Pulsating Current Deposition Process
LI Yang*, SUN Ji-Zhou, WANG Jin-Feng, BIAN Chao, TONG Jian-Hua,
DONG Han-Peng, ZHANG Hong, XIA Shan-Hong
(State Key Laboratory of Transducer Technology, Institute of Electronics, Chinese Academy of Sciences, Beijing 100190, China)
Abstract Based on microfabrication technology and electrochemical modification method, a micro electrochemical sensor for nitrate (NO Symbolm@@ 3) determination was developed. A micro sensor chip with working electrode and counter electrode was used as the signal convertor of the sensor. The area of the micro working-electrode was only 1 mm2. As an electrocatalysis sensitive material, copper was electrodeposited onto the working electrode by square-wave pulse current electrodeposition method. The morphologies and components of freshly deposited materials were examined by scanning electron microscopy (SEM) and X-ray diffraction (XRD) to explore key factors that affected the electrocatalytic ability of the deposited copper layer for reducing nitrate ions. The experimental results revealed that under the optimal conditions, the deposited copper layer was macroporous and had a larger effective surface area that could serve as a more effective electrocatalyst in facilitating nitrate reduction. Electrochemical response of the macroporous copper layer was characterized by linear sweep voltammetry in acidic supporting electrolytes (pH=2). The electroanalytical results showed that the modified microsensor had marked sensitivity for standard nitrate samples within the concentration range from 12.5 to 3000 μmol/L (in the range of 12.5-200 μmol/L yielded straight line: y1= Symbolm@@ 0.1422x-10.326, R12=0.9976, while in the range of 200-3000 μmol/L yielded straight line: y2= Symbolm@@ 0.0984x-22.144, R22=0.9927) with a detection limit of 2 μmol/L (S/N=3). The developed electrochemical microsensor was also employed for nitrate determination in water samples collected from lakes and rivers near the city of Beijing. The results were in good agreement with the data given by qualified water quality detection institute, with the deviations from 3.9% to 15.4%.
Keywords Micro electrochemical sensor; Copper sensitive material; Pulsating current electrodeposition method; Nitrate determination; Real water samples
(Received 1 July 2014; accepted 27 July 2014)
This work was supported by the National High Technology Research and Development Program of China (No.2012AA040506) and the National Natural Science Foundation of China (Nos. 61302034, 61134010)

