基于学科观念的初中化学“量问题”教学思考
成桂荣
摘要:“量问题”是义务教育沪教版化学教材中涉及到数据、含量、量大小关系的课程内容。以学生“量问题”学习的缺位表征为起点,例谈“量问题”学习的教学价值,寻绎基于化学学科观念的“量问题”学习路径,彰显学科的本质,促成学生的发展。
关键词:学科观念;量问题;教学思考
文章编号:1008-0546(2018)11-0026-03 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2018.11.008
在义务教育沪教版化学教材中,涉及到数据、含量、量大小关系等有关的课程内容,笔者把这一类与“量”有关的课程内容称为“量问题”,如空气中氧气体积分数的测定、相对原子质量、化学式、溶解度、依据化学方程式进行简单计算等。《义务教育化学课程标准》指出:化学学科应通过具体化学知识和概念的学习,促进学生形成化学学科思想和基本观念,逐步使学生从单一的定性与定量的物质认识过程,过渡到定性与定量相结合的物质认识过程。笔者在初中化学“量问题”教学实践中发现,初三学生存在“量问题”学习缺失现象,没有理解化学学科的本质,没有获得真正意义上的发展。
一、“量问题”学习的缺失表征
“量问题”在初中化学教材中有多处“踪迹”,是初中化学学科的本质问题。案例研究表明,化学“量问题”学习存在着如下的两种典型缺失表征。
1.自主建构的缺失
《基础教育课程改革纲要》指出:教师在教学中应与学生积极互动、共同发展,培养学生的独立性和自主性,引导学生质疑、调查、探究,促进学生主动地、富有个性地学习。然而,在“空气中氧气体积分数的测定实验”这一“量问题”教学时,某位教师自问自答,直接说出实验现象和实验结论,又直接讲解实验操作细节造成的实验误差。这位化学教师的“量问题”教学既没有引导学生观察实验现象、分析现象成因,又没有引导学生自主推理实验数据,更没有实现学生自主建构“空气中氧气的体积含量”。建构主义认为,学习不是由教师向学生传递知识的过程,而是学生自己建构知识的过程,学生不是信息的接受者,而是意义的主动建构者。化学课堂教学应预设启发性问题,留给学生质疑思考的时间,彰显学生的主体地位,真正实施生成性课堂教学,促成学生的自主发展。
2.观念建构的缺失
譬如,在中考复习阶段常常遇到“确定物质的组成”的量问题学习,学生能把握反应前后元素的种类不变来确定所求物质的组成元素,但不会运用物质所含元素的质量来确定元素的原子个数比关系,其根本就是学生还不能从“量”的角度来认识和分析化学反应中的物质质量守恒或元素质量守恒,没有建构“元素守恒”的学科观念。德国物理学家劳厄有句名言:“重要的不是获得知识,而是发展思维能力。教育无非是一切已学过的东西都被遗忘掉的时候所剩下的东西。”在化学课堂学习中,我们学生不仅要学习具体的化学知识,更要学会将所学的化学知识进行提炼和升华,即形成基于化学视角来认识事物和解决问题的基本观念。
二、“量问题”的教学价值
宋心琦教授曾精辟地指出:“学生能否牢固地、准确地、哪怕只是定性地建立起来基本的化学观念,应当是中学化学教学的第一目标。”化学基本观念是超越化学知识的总观性认识,是对化学学科的本质、规律及价值的理性认识,是化学学习的价值所在。“量问题”是化学学习的重要问题,利于学生从定性与定量角度认识物质组成及其变化过程,深入理解化学概念与化学原理,培养化学学科的基本观念,提高学生的科学素养。
1.培养学生的分类观
以沪教版“身边的物质——空气”为例,从“铁生锈实验”到“空气中氧气体积分数的测定实验”的“量问题”学习,不是孤立的,而是相互关联的、逐步渗透的;学生对空气的组成从无数据意识到有数据认识,对物质的组成从单一的组成认识到多种混合的组成认识、再到组成成分的含量认识;学生自主生成“纯净物和混合物”及其相互之间的组成关系,自主建构物质组成认识的分类观,为后续教材建构“元素化合物”的知识体系埋下伏笔。分类观是认识事物的一种重要手段,更是一种科学的思维方法。引导学生探究身边的化学物质,从物质的组成、性质、结构等角度分类研究物质,把握物质的本质属性和内在关系,理解化学学科的本质。
2.培养學生的元素守恒观
化学变化是化学学科研究的核心内容。沪教版“质量守恒定律”内容是定量认识和分析化学变化的基础,是化学变化的“量”的体现,是化学变化中“量问题”的核心知识,其核心内容是物质质量守恒和元素质量守恒。物质通过化学变化进行相互转化,但其组成元素的种类和质量在化学反应前后是不变的,即元素守恒。引导学生建构物质组成及其变化中“元素守恒观”,学生不仅能自觉地从元素组成的角度去辨别“点石成金、水变油等”的真伪,而且能自觉地抓住化学变化的始态和终态,对某种元素或特定恒量进行分析,进而确定物质的化学式或相关含量。
三、化学变化中“量问题”的教学思考
化学变化中“量问题”是涉及数据信息的课程内容,典型类型就是化学变化中的化学计算。初中化学计算的重点是根据化学方程式进行简单计算以及相关的综合计算,学生能从定性和定量两方面理解化学概念和基本原理,从而掌握物质的性质及其变化的规律。
1.化学变化中“量问题”的学习类型
基于化学方程式计算的考点,列表梳理化学变化中“量问题”的学习类型(表1)。
2.化学变化中“量问题”的学习障碍
依据化学方程式进行简单计算是化学变化中“量问题”的典型类型。在这一“量问题”学习中,学生常常存在以下的学习障碍:不能审清题意、不能明确化学原理及思想在计算中的运用、不能建立质量守恒或元素守恒关系、不能找寻或整合数据信息。这些学习障碍的存在,都源于教师对学生的解题思路缺少全局的预设和理性的引导,从而使课堂教学凸现学习主体和意义建构的缺失。
3.化学变化中“量问题”的学习路径
结合化学变化中“量问题”的考查类型,从建立守恒关系和整合数据信息两个维度,寻找基于元素守恒观的“量问题”学习路径。
(1)从“元素守恒观”的维度建构
沪教版“质量守恒定律”的核心内容就是物质质量守恒和元素质量守恒。辨析化学反应原理之间的物质质量关系或元素质量关系,建构化学学科的“元素守恒观”。
类型一:单个反应中“量问题”
这类“量问题”是基于单个化学反应原理的纯净物所表达的数据信息,可直接运用已知数据或者数据组合确定化学式的未知系数或相关物质的含量。
例如:(2018年扬州中考第25题,节选):测定晶体CaCl2·xH2O的组成:
a.称取14.7000g CaCl2晶体于锥形瓶内,加入适量蒸馏水,使其全部溶解。
b.再向其中加入足量的Na2CO3溶液,静置。
c.过滤、洗涤、干燥、称重,得到10.000g固体。通过计算,确定x的值(写出计算过程)。
该题是化学变化中“量问题”的典型题型,只涉及一个反应原理,但存在两个纯净物所表达的数据信息。解题时,先建立基于反应原理的物质关系,再建立基于钙元素守恒的关系式,即CaCl2·xH2O~CaCO3,再寻找CaCl2·xH2O和CaCO3的质量比关系,代入两者的质量数据,即可确定x的值。不论是“量问题”的新授课教学,还是“量问题”的复习课教学,都应帮助学生完成从依据化学方程式进行计算到基于化学原理分析、建立元素守恒关系的学习飞跃,实现建构化学学科的“元素守恒观”。
类型二:多个反应中“量问题”
这类“量问题”是基于多个化学反应原理、多个物质所表达的数据信息。学生甚至不能顺利地写出相关的化学方程式,或者不能顺利地辨别数据信息所对应的物质关系,这类问题需要学生提炼资料信息、辨别化学原理、建立物质守恒或元素守恒关系,代入可计算的纯净物数据,进而确定混合物中某物质的含量等。
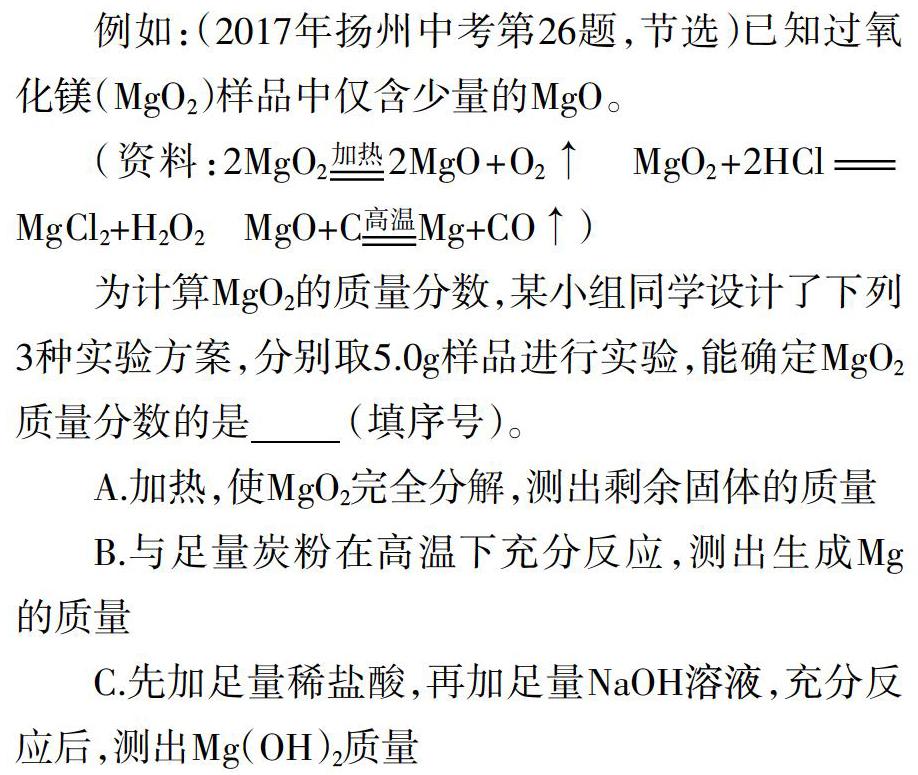
例如:(2017年扬州中考第26题,节选)已知过氧化镁(MgO2)样品中仅含少量的MgO。
(资料:2MgO2[加热]2MgO+O2↑ MgO2+2HCl[=]MgCl2+H2O2 MgO+C[高温]Mg+CO↑)
为计算MgO2的质量分数,某小组同学设计了下列3种实验方案,分别取5.0g样品进行实验,能确定MgO2质量分数的是 (填序号)。
A.加热,使MgO2完全分解,测出剩余固体的质量
B.与足量炭粉在高温下充分反应,测出生成Mg的质量
C.先加足量稀盐酸,再加足量NaOH溶液,充分反应后,测出Mg(OH)2质量
该“量问题”涉及多个反应原理,需结合资料信息判断化学反应的生成物、转化数据信息,运用质量守恒定律解题。如选项A:先判断剩余固体是MgO,再根据质量守恒判断出固体减少的质量,即氧气质量,进而求解MgO2质量;选项B:先判断发生了MgO2高温分解反应及MgO与炭粉高温反应,利用Mg的质量求解MgO质量,再根据质量守恒判断出固体减少的质量,即氧气质量,进而求解MgO2质量;或者抓住始态物质与终态物质,利用Mg元素守恒关系,假设MgO2质量未知数,列出基于镁元素质量守恒的一元一次方程式进行解题。选项C:先根据Mg(OH)2质量求出Mg元素的质量,再利用始态物质与终态物质中Mg元素的守恒关系,假设MgO2质量未知数,列出基于镁元素质量守恒的一元一次方程式进行解题。
通过以上化学变化中“量问题”的典例学习,学生学会了从分析单个化学原理、明确物质质量守恒关系,也学会了分析多个化学原理、多个物质间的质量守恒或元素守恒关系,也学会了分析复杂情境的化学原理、提炼和转化信息,运用物质质量守恒或元素质量守恒的关系解答“量问题”的学习思路。遴选由浅入深、由简单到复杂、由现象到本质的“量问题”典型题例,培养学生的“元素守恒观”,理解“量问题”学习的化学本质。
(2)从“数据整合”的维度建构
明确化学变化中的反应原理,培养学生的“元素守恒观”,是化学变化中“量問题”学习的关键路径。然而,化学变化中的“量问题”是以数学运算为载体的,要准确把握化学变化中的“量问题”,还需学会以下几种数据整合方法:数据的扩大与缩小、数据的差和、数据的均值、单位的换算、约数的取舍、偏差的讨论等。譬如,解答某“量问题”时,求得CO2质量为1.964g/L×0.0224L=0.0439936g,需要结合CO2的相对分子质量为44,采用四舍五入法将0.0439936g巧妙地取舍为0.044g,方可顺利地进行数据的计算。
四、结语
“量问题”是初中化学学习的重要知识,更是化学学科的本质问题。学生积极质疑、亲身体验,转变学习方式,实现化学程序性知识的价值引导和主动建构的统一,教师真正实施化学学科观念建构的“量问题”教学。
教育活动的本质是什么?是一种唤醒、一种点燃、一种提升。唯有播种学科观念统观的化学教学,才能启迪学生的思维,理解化学的本质,提高学生的科学素养。这就是化学教学的本源和价值所在。
参考文献
[1] 中华人民共和国教育部.义务教育化学课程标准(2011年版)[M].北京:北京师范大学出版社,2012,1
[2] 赵华.化学教学设计应立足智慧的文本解读[J].化学教学,2017(3):12-16
[3] 杨玉琴.化学计算的学科本质及其教学[J].化学教学,2013(10):8-11
[4] 毕华林,杜明成.基于化学基本观念建构教科书设计[J].化学教育,2007(10):11-13

摘要:“量问题”是义务教育沪教版化学教材中涉及到数据、含量、量大小关系的课程内容。以学生“量问题”学习的缺位表征为起点,例谈“量问题”学习的教学价值,寻绎基于化学学科观念的“量问题”学习路径,彰显学科的本质,促成学生的发展。
关键词:学科观念;量问题;教学思考
文章编号:1008-0546(2018)11-0026-03 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2018.11.008
在义务教育沪教版化学教材中,涉及到数据、含量、量大小关系等有关的课程内容,笔者把这一类与“量”有关的课程内容称为“量问题”,如空气中氧气体积分数的测定、相对原子质量、化学式、溶解度、依据化学方程式进行简单计算等。《义务教育化学课程标准》指出:化学学科应通过具体化学知识和概念的学习,促进学生形成化学学科思想和基本观念,逐步使学生从单一的定性与定量的物质认识过程,过渡到定性与定量相结合的物质认识过程。笔者在初中化学“量问题”教学实践中发现,初三学生存在“量问题”学习缺失现象,没有理解化学学科的本质,没有获得真正意义上的发展。
一、“量问题”学习的缺失表征
“量问题”在初中化学教材中有多处“踪迹”,是初中化学学科的本质问题。案例研究表明,化学“量问题”学习存在着如下的两种典型缺失表征。
1.自主建构的缺失
《基础教育课程改革纲要》指出:教师在教学中应与学生积极互动、共同发展,培养学生的独立性和自主性,引导学生质疑、调查、探究,促进学生主动地、富有个性地学习。然而,在“空气中氧气体积分数的测定实验”这一“量问题”教学时,某位教师自问自答,直接说出实验现象和实验结论,又直接讲解实验操作细节造成的实验误差。这位化学教师的“量问题”教学既没有引导学生观察实验现象、分析现象成因,又没有引导学生自主推理实验数据,更没有实现学生自主建构“空气中氧气的体积含量”。建构主义认为,学习不是由教师向学生传递知识的过程,而是学生自己建构知识的过程,学生不是信息的接受者,而是意义的主动建构者。化学课堂教学应预设启发性问题,留给学生质疑思考的时间,彰显学生的主体地位,真正实施生成性课堂教学,促成学生的自主发展。
2.观念建构的缺失
譬如,在中考复习阶段常常遇到“确定物质的组成”的量问题学习,学生能把握反应前后元素的种类不变来确定所求物质的组成元素,但不会运用物质所含元素的质量来确定元素的原子个数比关系,其根本就是学生还不能从“量”的角度来认识和分析化学反应中的物质质量守恒或元素质量守恒,没有建构“元素守恒”的学科观念。德国物理学家劳厄有句名言:“重要的不是获得知识,而是发展思维能力。教育无非是一切已学过的东西都被遗忘掉的时候所剩下的东西。”在化学课堂学习中,我们学生不仅要学习具体的化学知识,更要学会将所学的化学知识进行提炼和升华,即形成基于化学视角来认识事物和解决问题的基本观念。
二、“量问题”的教学价值
宋心琦教授曾精辟地指出:“学生能否牢固地、准确地、哪怕只是定性地建立起来基本的化学观念,应当是中学化学教学的第一目标。”化学基本观念是超越化学知识的总观性认识,是对化学学科的本质、规律及价值的理性认识,是化学学习的价值所在。“量问题”是化学学习的重要问题,利于学生从定性与定量角度认识物质组成及其变化过程,深入理解化学概念与化学原理,培养化学学科的基本观念,提高学生的科学素养。
1.培养学生的分类观
以沪教版“身边的物质——空气”为例,从“铁生锈实验”到“空气中氧气体积分数的测定实验”的“量问题”学习,不是孤立的,而是相互关联的、逐步渗透的;学生对空气的组成从无数据意识到有数据认识,对物质的组成从单一的组成认识到多种混合的组成认识、再到组成成分的含量认识;学生自主生成“纯净物和混合物”及其相互之间的组成关系,自主建构物质组成认识的分类观,为后续教材建构“元素化合物”的知识体系埋下伏笔。分类观是认识事物的一种重要手段,更是一种科学的思维方法。引导学生探究身边的化学物质,从物质的组成、性质、结构等角度分类研究物质,把握物质的本质属性和内在关系,理解化学学科的本质。
2.培养學生的元素守恒观
化学变化是化学学科研究的核心内容。沪教版“质量守恒定律”内容是定量认识和分析化学变化的基础,是化学变化的“量”的体现,是化学变化中“量问题”的核心知识,其核心内容是物质质量守恒和元素质量守恒。物质通过化学变化进行相互转化,但其组成元素的种类和质量在化学反应前后是不变的,即元素守恒。引导学生建构物质组成及其变化中“元素守恒观”,学生不仅能自觉地从元素组成的角度去辨别“点石成金、水变油等”的真伪,而且能自觉地抓住化学变化的始态和终态,对某种元素或特定恒量进行分析,进而确定物质的化学式或相关含量。
三、化学变化中“量问题”的教学思考
化学变化中“量问题”是涉及数据信息的课程内容,典型类型就是化学变化中的化学计算。初中化学计算的重点是根据化学方程式进行简单计算以及相关的综合计算,学生能从定性和定量两方面理解化学概念和基本原理,从而掌握物质的性质及其变化的规律。
1.化学变化中“量问题”的学习类型
基于化学方程式计算的考点,列表梳理化学变化中“量问题”的学习类型(表1)。
2.化学变化中“量问题”的学习障碍
依据化学方程式进行简单计算是化学变化中“量问题”的典型类型。在这一“量问题”学习中,学生常常存在以下的学习障碍:不能审清题意、不能明确化学原理及思想在计算中的运用、不能建立质量守恒或元素守恒关系、不能找寻或整合数据信息。这些学习障碍的存在,都源于教师对学生的解题思路缺少全局的预设和理性的引导,从而使课堂教学凸现学习主体和意义建构的缺失。
3.化学变化中“量问题”的学习路径
结合化学变化中“量问题”的考查类型,从建立守恒关系和整合数据信息两个维度,寻找基于元素守恒观的“量问题”学习路径。
(1)从“元素守恒观”的维度建构
沪教版“质量守恒定律”的核心内容就是物质质量守恒和元素质量守恒。辨析化学反应原理之间的物质质量关系或元素质量关系,建构化学学科的“元素守恒观”。
类型一:单个反应中“量问题”
这类“量问题”是基于单个化学反应原理的纯净物所表达的数据信息,可直接运用已知数据或者数据组合确定化学式的未知系数或相关物质的含量。
例如:(2018年扬州中考第25题,节选):测定晶体CaCl2·xH2O的组成:
a.称取14.7000g CaCl2晶体于锥形瓶内,加入适量蒸馏水,使其全部溶解。
b.再向其中加入足量的Na2CO3溶液,静置。
c.过滤、洗涤、干燥、称重,得到10.000g固体。通过计算,确定x的值(写出计算过程)。
该题是化学变化中“量问题”的典型题型,只涉及一个反应原理,但存在两个纯净物所表达的数据信息。解题时,先建立基于反应原理的物质关系,再建立基于钙元素守恒的关系式,即CaCl2·xH2O~CaCO3,再寻找CaCl2·xH2O和CaCO3的质量比关系,代入两者的质量数据,即可确定x的值。不论是“量问题”的新授课教学,还是“量问题”的复习课教学,都应帮助学生完成从依据化学方程式进行计算到基于化学原理分析、建立元素守恒关系的学习飞跃,实现建构化学学科的“元素守恒观”。
类型二:多个反应中“量问题”
这类“量问题”是基于多个化学反应原理、多个物质所表达的数据信息。学生甚至不能顺利地写出相关的化学方程式,或者不能顺利地辨别数据信息所对应的物质关系,这类问题需要学生提炼资料信息、辨别化学原理、建立物质守恒或元素守恒关系,代入可计算的纯净物数据,进而确定混合物中某物质的含量等。
例如:(2017年扬州中考第26题,节选)已知过氧化镁(MgO2)样品中仅含少量的MgO。
(资料:2MgO2[加热]2MgO+O2↑ MgO2+2HCl[=]MgCl2+H2O2 MgO+C[高温]Mg+CO↑)
为计算MgO2的质量分数,某小组同学设计了下列3种实验方案,分别取5.0g样品进行实验,能确定MgO2质量分数的是 (填序号)。
A.加热,使MgO2完全分解,测出剩余固体的质量
B.与足量炭粉在高温下充分反应,测出生成Mg的质量
C.先加足量稀盐酸,再加足量NaOH溶液,充分反应后,测出Mg(OH)2质量
该“量问题”涉及多个反应原理,需结合资料信息判断化学反应的生成物、转化数据信息,运用质量守恒定律解题。如选项A:先判断剩余固体是MgO,再根据质量守恒判断出固体减少的质量,即氧气质量,进而求解MgO2质量;选项B:先判断发生了MgO2高温分解反应及MgO与炭粉高温反应,利用Mg的质量求解MgO质量,再根据质量守恒判断出固体减少的质量,即氧气质量,进而求解MgO2质量;或者抓住始态物质与终态物质,利用Mg元素守恒关系,假设MgO2质量未知数,列出基于镁元素质量守恒的一元一次方程式进行解题。选项C:先根据Mg(OH)2质量求出Mg元素的质量,再利用始态物质与终态物质中Mg元素的守恒关系,假设MgO2质量未知数,列出基于镁元素质量守恒的一元一次方程式进行解题。
通过以上化学变化中“量问题”的典例学习,学生学会了从分析单个化学原理、明确物质质量守恒关系,也学会了分析多个化学原理、多个物质间的质量守恒或元素守恒关系,也学会了分析复杂情境的化学原理、提炼和转化信息,运用物质质量守恒或元素质量守恒的关系解答“量问题”的学习思路。遴选由浅入深、由简单到复杂、由现象到本质的“量问题”典型题例,培养学生的“元素守恒观”,理解“量问题”学习的化学本质。
(2)从“数据整合”的维度建构
明确化学变化中的反应原理,培养学生的“元素守恒观”,是化学变化中“量問题”学习的关键路径。然而,化学变化中的“量问题”是以数学运算为载体的,要准确把握化学变化中的“量问题”,还需学会以下几种数据整合方法:数据的扩大与缩小、数据的差和、数据的均值、单位的换算、约数的取舍、偏差的讨论等。譬如,解答某“量问题”时,求得CO2质量为1.964g/L×0.0224L=0.0439936g,需要结合CO2的相对分子质量为44,采用四舍五入法将0.0439936g巧妙地取舍为0.044g,方可顺利地进行数据的计算。
四、结语
“量问题”是初中化学学习的重要知识,更是化学学科的本质问题。学生积极质疑、亲身体验,转变学习方式,实现化学程序性知识的价值引导和主动建构的统一,教师真正实施化学学科观念建构的“量问题”教学。
教育活动的本质是什么?是一种唤醒、一种点燃、一种提升。唯有播种学科观念统观的化学教学,才能启迪学生的思维,理解化学的本质,提高学生的科学素养。这就是化学教学的本源和价值所在。
参考文献
[1] 中华人民共和国教育部.义务教育化学课程标准(2011年版)[M].北京:北京师范大学出版社,2012,1
[2] 赵华.化学教学设计应立足智慧的文本解读[J].化学教学,2017(3):12-16
[3] 杨玉琴.化学计算的学科本质及其教学[J].化学教学,2013(10):8-11
[4] 毕华林,杜明成.基于化学基本观念建构教科书设计[J].化学教育,2007(10):11-13

