表征沉淀溶解平衡的新方法
张婷 奚润心 谢天宇


摘要:选取常见难溶电解质Mg(OH)2和CaCO3,测定其在溶于水后溶液pH或电导率变化,表征沉淀的溶解过程;向其上层清液中滴加相应的沉淀剂,测定该过程中溶液浑浊度变化,表征沉淀的析出过程;帮助学生建构沉淀溶解平衡的概念。
关键词:难溶电解质;沉淀溶解平衡;数字化实验
文章编号:1008-0546(2018)10-0090-02 中图分类号:G633.8 文献标识码:B
一、前言
19世纪时期,工业迅猛发展,为了解决燃料的利用以及生产过程中能量的转化问题,促使化学家们研究物质发生化学反应的原因、反应进行的方向和程度。霍斯特曼第一个利用热力学基本定律解释化学过程,范霍夫将化学平衡常数K代入克拉佩隆方程并由此提出化学反应的动态平衡原理,勒夏特列研究了各种因素对化学平衡的影响,提出了更有普遍规律性的化学平衡移动原理川。吉布斯利用大量实验数据进行系统的理论研究,提出了吉布斯方程……科学家们的努力探索,使得今天的人们终于从本质上辨明了化学反应发生的内在实质。
化学反应具有方向性和一定的限度,化学平衡状态是在一定条件下可逆反应进行的最大限度。高中阶段,学生学习的化学平衡知识包含四部分:化学反应平衡、电离平衡、水解平衡和沉淀溶解平衡。学生在此之前已认识了几类平衡体系,掌握了化学平衡的概念和特征,因此将平衡理论应用于沉淀溶解平衡的教学需解决的一个前提是,如何让学生认识到沉淀的溶解是个平衡过程。
苏教版《化学反应原理》教材中设计实验,取PbI2(难溶于水)的上层清液加入AgNO3溶液[2],观察到黄色沉淀,证明上层清液中含I-,PbI2在水中会溶解。有老师对此实验进行改进,向PbI2的上层清液加入KI溶液,观察到PbI2沉淀生成,不仅证明了上层清液中含Pb2+,而且增大I-浓度,使得PbI2析出,表明该体系是一平衡体系。PbI2是学生较为陌生的难溶电解质,为什么不用CaCO3、Mg(OH)2这些学生熟悉的物质做实验呢?我们对此进行了实验尝试,向CaCO3的上层清液中滴加饱和Na2CO3溶液,发现没有明显沉淀析出。肉眼看不到沉淀,就代表溶液中没有CaCO3生成吗?如何看到这些微观的粒子?数字化实验能够拓宽人体的感知范围,因此我们借助传感器技术设计实验,利用具体的实验数据和图像,帮助学生建立沉淀溶解平衡的概念。
二、实验与结果
1.实验仪器与试剂
实验仪器:100mL烧杯、玻璃棒、试管、胶头滴管、浊度传感器(配套玻璃瓶)、电导率传感器、数据采集器。
实验试剂:Mg(OH)2固体、去离子水、酚酞、饱和NaOH溶液、CaCO3固体、饱和NaCO3溶液。
2.表征Mg(OH)2的沉淀-溶解平衡
取0.1gmg(OH)2样品于烧杯中,加入60mL去离子水,搅拌后静置。取上层清液2mL于试管1中,滴入酚酞,发现酚酞变红,表明Mg(OH)2溶解,产生了OH-。
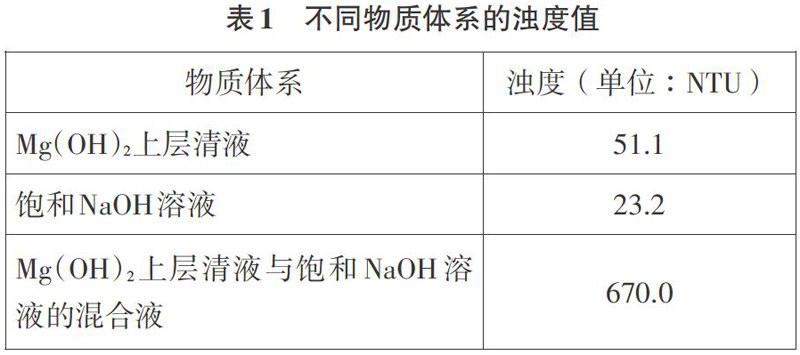
将浊度传感器,按照图1与数据采集器相连,用标准液进行校准。取Mg(OH)2饱和溶液的上层清液于玻璃瓶(浊度传感器配套)中,测定并记录其浊度值。将玻璃瓶中的溶液倒出1/2体积,向其中加入1/2体积的饱和NaOH溶液,立即放入浊度传感器中,测定其浊度值的变化。实验数据见表1。实验发现,加入饱和NaOH溶液后,体系的浊度明显增大,表明溶液中有Mg(OH)2沉淀生成,Mg(on)2溶解過程是可逆的。
3.表征CaCO3的沉淀一溶解平衡
将电导率传感器,按照图2与实验装置组合,再与数据采集器相连。取60mL去离子水烧杯中,打开磁力搅拌器,开始数据采集,向其中加入0.1gCaCO3样品,发现溶液电导率缓慢上升(实验结果见图3),表明CaCO3溶解,使得溶液中离子浓度上升。测定结束后将溶液静置。
取上层清液于玻璃瓶中,利用浊度传感器测定其浊度值;将玻璃瓶中溶液倒出1/2体积,向其中加入1/2体积的饱和Na2CO3溶液,立即放入浊度传感器中,测定其浊度值的变化。实验数据见表2。实验发现,加人饱和Na2CO3溶掖后,体系的浊度明显增大,表明溶液中有CaCO3沉淀生成,证明CaCO3的溶解过程是可逆的。
三、总结
实验选取了常见难溶电解质Mg(OH)2和CaCO3,首先测定其在溶于水后溶液pH或电导率变化,从而表征出沉淀的溶解过程,即:Mg(OH)2=20H-+Mg2+,CaCO3=CO32-+Ca2+。其次分别向其土层清液中滴加相应的沉淀剂,测定该过程中溶液浊度变化,成功让学生“看到”沉淀的析出过程,即:20H-+Mg2+=Mg(OH)2,CO32-+Ca3+=CaCO3。利用数字化实验采集的定量数据和图像进行对比分析,帮助学生认识到沉淀的溶解是可逆的,即:Mg(OH)220H-+Mg2+,CaCO3CO32-+Ca2+,一定条件下,当沉淀的溶解速率等于沉淀的析出速率时,达到平衡状态,这就是沉淀溶解平衡。
高中阶段,学生接触的大部分难溶电解质是白色固体,并且其溶解过程和沉淀生成过程根难通过肉眼观测到相关变化。本实验结合传统实验和数字化实验,设计思路适用于表征大多数难溶电解质的沉淀溶解平衡,可为沉淀溶解平衡的相关教学设计和实验探究活动提供参考。
参考文献
[1]白锦会,戴志松.化学热力学的历史发展[J].华中师范大学学报(自然科学版),1991(2):245
[2]王祖浩.化学反应原理[M].南京:江苏风凰教育出版社,2014:87



摘要:选取常见难溶电解质Mg(OH)2和CaCO3,测定其在溶于水后溶液pH或电导率变化,表征沉淀的溶解过程;向其上层清液中滴加相应的沉淀剂,测定该过程中溶液浑浊度变化,表征沉淀的析出过程;帮助学生建构沉淀溶解平衡的概念。
关键词:难溶电解质;沉淀溶解平衡;数字化实验
文章编号:1008-0546(2018)10-0090-02 中图分类号:G633.8 文献标识码:B
一、前言
19世纪时期,工业迅猛发展,为了解决燃料的利用以及生产过程中能量的转化问题,促使化学家们研究物质发生化学反应的原因、反应进行的方向和程度。霍斯特曼第一个利用热力学基本定律解释化学过程,范霍夫将化学平衡常数K代入克拉佩隆方程并由此提出化学反应的动态平衡原理,勒夏特列研究了各种因素对化学平衡的影响,提出了更有普遍规律性的化学平衡移动原理川。吉布斯利用大量实验数据进行系统的理论研究,提出了吉布斯方程……科学家们的努力探索,使得今天的人们终于从本质上辨明了化学反应发生的内在实质。
化学反应具有方向性和一定的限度,化学平衡状态是在一定条件下可逆反应进行的最大限度。高中阶段,学生学习的化学平衡知识包含四部分:化学反应平衡、电离平衡、水解平衡和沉淀溶解平衡。学生在此之前已认识了几类平衡体系,掌握了化学平衡的概念和特征,因此将平衡理论应用于沉淀溶解平衡的教学需解决的一个前提是,如何让学生认识到沉淀的溶解是个平衡过程。
苏教版《化学反应原理》教材中设计实验,取PbI2(难溶于水)的上层清液加入AgNO3溶液[2],观察到黄色沉淀,证明上层清液中含I-,PbI2在水中会溶解。有老师对此实验进行改进,向PbI2的上层清液加入KI溶液,观察到PbI2沉淀生成,不仅证明了上层清液中含Pb2+,而且增大I-浓度,使得PbI2析出,表明该体系是一平衡体系。PbI2是学生较为陌生的难溶电解质,为什么不用CaCO3、Mg(OH)2这些学生熟悉的物质做实验呢?我们对此进行了实验尝试,向CaCO3的上层清液中滴加饱和Na2CO3溶液,发现没有明显沉淀析出。肉眼看不到沉淀,就代表溶液中没有CaCO3生成吗?如何看到这些微观的粒子?数字化实验能够拓宽人体的感知范围,因此我们借助传感器技术设计实验,利用具体的实验数据和图像,帮助学生建立沉淀溶解平衡的概念。
二、实验与结果
1.实验仪器与试剂
实验仪器:100mL烧杯、玻璃棒、试管、胶头滴管、浊度传感器(配套玻璃瓶)、电导率传感器、数据采集器。
实验试剂:Mg(OH)2固体、去离子水、酚酞、饱和NaOH溶液、CaCO3固体、饱和NaCO3溶液。
2.表征Mg(OH)2的沉淀-溶解平衡
取0.1gmg(OH)2样品于烧杯中,加入60mL去离子水,搅拌后静置。取上层清液2mL于试管1中,滴入酚酞,发现酚酞变红,表明Mg(OH)2溶解,产生了OH-。
将浊度传感器,按照图1与数据采集器相连,用标准液进行校准。取Mg(OH)2饱和溶液的上层清液于玻璃瓶(浊度传感器配套)中,测定并记录其浊度值。将玻璃瓶中的溶液倒出1/2体积,向其中加入1/2体积的饱和NaOH溶液,立即放入浊度传感器中,测定其浊度值的变化。实验数据见表1。实验发现,加入饱和NaOH溶液后,体系的浊度明显增大,表明溶液中有Mg(OH)2沉淀生成,Mg(on)2溶解過程是可逆的。
3.表征CaCO3的沉淀一溶解平衡
将电导率传感器,按照图2与实验装置组合,再与数据采集器相连。取60mL去离子水烧杯中,打开磁力搅拌器,开始数据采集,向其中加入0.1gCaCO3样品,发现溶液电导率缓慢上升(实验结果见图3),表明CaCO3溶解,使得溶液中离子浓度上升。测定结束后将溶液静置。
取上层清液于玻璃瓶中,利用浊度传感器测定其浊度值;将玻璃瓶中溶液倒出1/2体积,向其中加入1/2体积的饱和Na2CO3溶液,立即放入浊度传感器中,测定其浊度值的变化。实验数据见表2。实验发现,加人饱和Na2CO3溶掖后,体系的浊度明显增大,表明溶液中有CaCO3沉淀生成,证明CaCO3的溶解过程是可逆的。
三、总结
实验选取了常见难溶电解质Mg(OH)2和CaCO3,首先测定其在溶于水后溶液pH或电导率变化,从而表征出沉淀的溶解过程,即:Mg(OH)2=20H-+Mg2+,CaCO3=CO32-+Ca2+。其次分别向其土层清液中滴加相应的沉淀剂,测定该过程中溶液浊度变化,成功让学生“看到”沉淀的析出过程,即:20H-+Mg2+=Mg(OH)2,CO32-+Ca3+=CaCO3。利用数字化实验采集的定量数据和图像进行对比分析,帮助学生认识到沉淀的溶解是可逆的,即:Mg(OH)220H-+Mg2+,CaCO3CO32-+Ca2+,一定条件下,当沉淀的溶解速率等于沉淀的析出速率时,达到平衡状态,这就是沉淀溶解平衡。
高中阶段,学生接触的大部分难溶电解质是白色固体,并且其溶解过程和沉淀生成过程根难通过肉眼观测到相关变化。本实验结合传统实验和数字化实验,设计思路适用于表征大多数难溶电解质的沉淀溶解平衡,可为沉淀溶解平衡的相关教学设计和实验探究活动提供参考。
参考文献
[1]白锦会,戴志松.化学热力学的历史发展[J].华中师范大学学报(自然科学版),1991(2):245
[2]王祖浩.化学反应原理[M].南京:江苏风凰教育出版社,2014:87

