朱雅琳 聂晶 帕丽达·阿布利孜

[摘要]目的:从分子生物学水平探讨强脉冲光和长脉宽1 064nm Nd:YAG激光治疗血管瘤的机制。方法:使用不同能量强脉冲光和长脉宽1 064nm Nd:YAG激光对婴儿血管瘤血管内皮细胞进行体外照射,照射后测量不同时间点细胞OD值,并进行比较。结果:强脉冲光组照射后,在同一时间点能量越高,体外培养血管瘤内皮细胞OD值越低,表明照射后存活细胞数减少,差异具有统计学意义(P<0.05),在所有测试时间点均呈现相同的改变趋势。Nd:YAG组照射后,在同一时间点,不同能量显示相同的变化趋势。在同一能量组,不同时间点的变化趋势有所不同。结论:强脉冲光和Nd:YAG激光对于血管瘤的抑制作用除了“选择性光热作用”外,还通过影响血管瘤内皮细胞的生长发挥抑制作用,并且影响程度在一定范围内受到能量和时间的影响。
[关键词]强脉冲光;Nd:YAG激光;婴儿血管瘤;内皮细胞;体外培养;生长曲线
[中图分类号]R732.2? ? [文献标志码]A? ? [文章编号]1008-6455(2019)09-0096-06
1983年Anderson和Parish提出了“选择性光热作用”理论[1-2],对激光的临床应用起到革命性的作用。此后激光成功用于血管瘤的治疗中,并取得明显成效。激光将血液加热到70℃左右导致血管的不可逆性破坏,从而达到治疗目的。强脉冲光源是由高能量的闪光灯激发出波长515~1 200nm的非相干光,也通过“选择性光热作用原理”对血管瘤发挥治疗作用,可变脉宽1 064nm Nd:YAG激光在婴儿血管瘤的治疗中也取得较好的临床应用[3]。前期研究发现普萘洛尔对体外培养的婴儿血管瘤内皮细胞的生长有明显抑制作用,同时对相关生长因子、β-肾上腺素受体及细胞凋亡均有影响[4-10],那么强脉冲光和激光除了通过“选择性光热作用原理”起到治疗婴儿浅表血管瘤的作用外,是否通过影响血管内皮细胞生长活性而起到治疗作用,还有待研究。本研究拟通过对体外培养的血管瘤内皮细胞进行强脉冲光和长脉宽1 064nm Nd:YAG激光照射,分别观察照射前后血管瘤内皮生长曲线及形态学的变化,从分子生物学水平探讨强脉冲光和长脉宽1 064nm Nd:YAG激光治疗血管瘤的机制。
1? 材料和方法
1.1 实验材料:婴儿血管瘤内皮细胞来源于前期实验原代培养的婴儿血管瘤内皮细胞,实验经过新疆医科大学第一附属医院伦理委员会的伦理审查,并且体外培养的婴儿血管瘤内皮细胞经过免疫组化进行鉴定,进行了纯度测定(为75%)。
1.2 主要试剂:胎牛血清(FBS)(美国Life technologies公司,16000044);EGM-2(CC-4176,Lonza);0.25%胰酶(Trypsin-EDTA)(25200-056,Gibco);PBS磷酸盐缓冲液粉剂(ZLI-9062,北京中杉金桥生物);青霉素-链霉素双抗(10000U)(SC30010,Gibco);CCK-8试剂(FC101-03,北京全式金生物)
1.3 方法
1.3.1 试剂配制:2%血清EGM-2完全培养基:500ml的EGM-2培养基中含10ml胎牛血清、0.2ml醋酸氢化可的松、hFGF-b 2ml、VEGF 2ml、R3-IGF-1 0.5ml、抗坏血酸0.5ml、hEGF 0.5ml、GA-1000 0.5ml、肝素0.5ml,添加1ml的青-链霉素双抗溶液。10% DMSO细胞冻存液:0.1ml的DMSO溶液加入0.9ml的完全培養基中。10% CCK-8溶液配制:按照CCK-8与完全培养基1:9比例配制10% CCK-8检测溶液。
1.3.2 细胞准备:从液氮中取出冻存的前期实验进行原代培养并鉴定的血管瘤内皮细胞,进行复苏及传代。当培养瓶(25cm2)中细胞贴壁融合达80%时,即可进行细胞的传代。取生长状态良好的细胞,完全培养基制备成0.2~1×105 cells/ml单细胞悬液,每隔24h接种至96孔板中(100μl/孔,6个复孔,即0.2~1×104个细胞/孔)。8d后小心吸干净细胞培养基,加入配置好的10% CCK-8溶液,置于37℃培养箱中孵育,1~4h后酶标仪450nm波长检测OD值。(取合适的检测时间OD值进行计算,一般选取OD值为1~2的值进行计算)。绘制生长曲线,确定细胞株的对数生长期,用于后续实验。
1.3.3 不同能量激光照射体外培养血管瘤内皮细胞:共分为七组。
1.3.3.1 激光分组照射情况:空白对照组:不照射,只使用2%血清EGM-2完全培养基培养。强脉冲光照射组(intense pulsed light):照射波长为560nm,双脉冲,脉宽3.5ms,脉冲间隔20ms,其中A组照射能量为23J/cm2,B组为24J/cm2,C组为25J/cm2。激光照射组(l 064nm Nd:YAG激光):照射波长1 064nm,单脉冲,脉冲持续时间11.5ms,其中A组能量为90J/cm2,B组为100J/cm2,C组为110J/cm2。
1.3.3.2 细胞培养:取生长状态良好的细胞,用完全培养基制备成0.2~1×105 cells/ml单细胞悬液,接种至96孔板中(100μl/孔,5个复孔,即0.2~1×104个细胞/孔)。2种照射方式、每组7个检测时间段、每个时间段5个重复,共加7个96孔板,标记好光照能量和检测时间段,将96孔板放入37℃、5% CO2培养箱中培养。24h后将96孔板按1.3.3.1中的激光能量分组照射,空白对照组不进行照射。照射后将96孔板放入培养箱中继续培养。
1.3.4 CCK-8法检测细胞活力:照射后第1、2、3、4、7、14、21天用CCK-8法检测细胞活力。小心吸干净对应时间段小孔中的细胞培养基,每孔加入配置好的100μl 10% CCK-8溶液,置于培养箱中37℃孵育1~4h,450nm波长检测OD值。以时间为横坐标,平均OD值为纵坐标绘制细胞生长曲线。
2? 结果
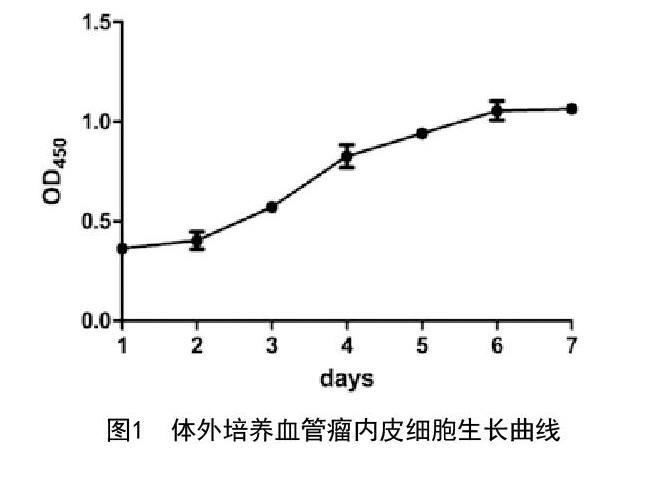
2.1 细胞生长曲线绘制结果:结果显示第1~2天细胞吸光度平均值增长缓慢,第2~4天迅速增长,第5天轻度下降,第6~7天达到平台期。与文献报道一致[3]。见图1。
2.2 CCK-8检测结果:不同能量强脉冲光及l 064nm Nd:YAG照射体外培养血管瘤内皮细胞后,不同时间点使用CCK-8法测定细胞OD值。
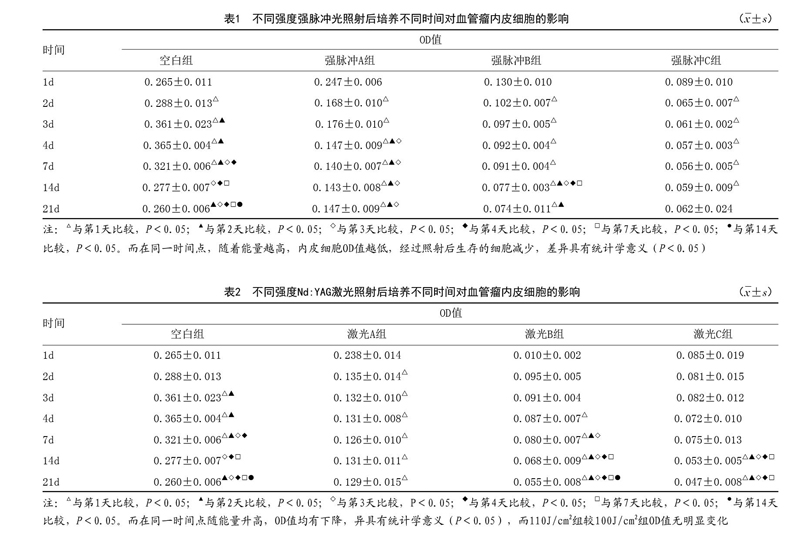
2.2.1 强脉冲光照射:强脉冲光560nm,双脉冲,脉宽3.5ms,脉冲间隔20ms,能量分别为23、24、25J/cm2进行照射,照射后第1、2、3、4、7、14、21d用CCK-8法检测每组细胞OD值发现,在同一时间点,能量越高,体外培养血管瘤内皮细胞OD值越低,提示经过照射后生存的细胞减少,差异具有统计学意义(P<0.05);并且在所有的测试时间点均呈现相同的改变趋势。而在同一能量组,空白组的变化与体外培养血管瘤内皮细胞的生长曲线吻合,而23J/cm2照射组照射后第2~3天较第1天OD值有明显变化,第4、7、21天OD值明显下降,较第2、3天均下降,但4、7、21d间并无差异;24J/cm2照射组则有所不同,在照射第2、3、4、7天的OD值变化不大,第14、21天OD值明显下降。25J/cm2照射组照射后OD值随时间变化不大(P>0.05)。多因素方差分析后显示激光能量及时间均是细胞OD值的影响因素(P<0.05)。见表1。
2.2.2 不同Nd:YAG激光照射:在同一时间点,不同能量显示相同的变化趋势,90J/cm2照射组较空白组OD值有所变化,100J/cm2较空白组和90J/cm2照射组的OD值均有下降,而110J/cm2组较100J/cm2组OD值没有明显变化。在同一能量组,不同时间点的变化趋势有所不同,90J/cm2组照射后第2、3、4、7、14、21天的OD值较第1天均有变化,但随时间变化,OD值变化不大,在100J/cm2组OD值较空白组的OD值是下降的,随时间延长细胞的OD值也是逐渐下降的。见表2。
2.3 细胞形态学变化
2.3.1 空白组:血管瘤内皮细胞经传代24h后观察,细胞逐渐贴壁,呈类圆形至多角形。生长2~3d后,数量逐渐增多。4~5d细胞逐渐融合,呈多角形,随后细胞逐渐成梭形及条索行,部分可见有类似血管结构形成。见图2。
2.3.2 照射后细胞形态变化情况:体外培养的血管瘤内皮细胞经不同激光照射后,细胞形态较前有所改变,细胞形态较前纤细,细胞间距增大,细胞变稀疏,见图3~4。
3? 讨论
目前多认为激光治疗婴儿血管瘤的机制为“选择性光热作用原理”[1],但随着婴幼儿血管瘤发病机制研究的深入,尤其是前期研究发现血管内皮细胞生长因子等的变化在血管瘤发生发展的过程中起重要作用[4-6,11-15],因此猜想激光治疗婴儿血管瘤的机制并不局限于“选择性光热作用原理”,激光同时对血管瘤内皮细胞生长的细胞因子有着重要的影响作用。
本研究发现强脉冲光(560nm,双脉冲,脉宽3.5ms,脉冲间隔20ms)和1 064nm激光对体外培养的血管瘤内皮细胞的生长是有影响的。在不同能量组,不同时间点体外培养的血管瘤内皮细胞形态学有所改变,随着照射时间的延长,细胞间距增大,变稀疏,说明细胞生长繁殖受到抑制。其次,对细胞的OD值进行检测发现,两种激光干预均可降低细胞的OD值,并且在一定能量范围内随着能量的升高,OD值降低越明显,说明对细胞的抑制作用越明显,并且随着治疗时间的延长,OD值在进一步下降。
强脉冲光照射各能量组在第21天时OD值较第14天变化不大(P>0.05),在25J/cm2照射组,随着时间的变化,细胞OD值较其他能量组变化不大,而其他各组随着能量增加以及治療时间的延长,OD值均降低,提示强脉冲光照射后血管瘤内皮细胞的数量减少,生长被抑制,因此考虑强脉冲光对体外培养的婴儿血管瘤内皮细胞有抑制作用,其对血管瘤的治疗作用不仅仅是通过“选择性光热作用原理”,也通过抑制细胞的生长而发挥作用。并且在一定范围内(<25J/cm2)能量越高,抑制作用越强,治疗后一定时间内(21d),血管瘤内皮细胞呈现持续被抑制的现象,因此推测激光治疗后,除了血红蛋白吸收激光能量,加热血管,使血管闭锁破坏,同时强脉冲光在治疗一段时间内对血管瘤内皮细胞有持续抑制作用,但是强脉冲光抑制细胞生长的具体机制还有待进一步研究。但此结论提示在临床治疗中,为达到更好的临床疗效,在一定范围内可提高治疗能量,但不能无限制提高,否则副作用出现增多,且并不能提高疗效,其次治疗一段时间后,激光对细胞的抑制作用减弱,可再次进行治疗,本实验发现21d后,强脉冲光组细胞OD值下降不明显,因此可以将此时间作为治疗间隔的参考时间。
Nd:YAG照射组(波长1 064nm,单脉冲,脉冲持续时间11.5ms):随着照射后时间的延长,镜下观察发现 细胞间距增大,变稀疏,说明细胞生长繁殖受到抑制。在不同能量组间90~100J/cm2较空白组的OD值变化明显,说明细胞的生长受到抑制,而更高能量组(110J/cm2)则并没有显示出更大的抑制作用,而同一能量组在21d之内,随着时间延长,在110J/cm2组,细胞的生长呈下降趋势,而其他组则没有明显的变化趋势,但通过多因素方差分析后,时间和能量均是细胞活性的影响因素(P<0.05)。
综上所述,强脉冲光和长脉宽Nd:YAG激光对于体外培养婴儿血管瘤内皮细胞的生长是有影响的,这说明强脉冲光和Nd:YAG激光对于血管瘤的抑制作用除了“选择性光热作用”之外,还通过影响血管瘤内皮细胞的生长起到抑制作用,并且影响程度在一定范围内受到能量和时间的影响。因此提示在临床治疗过程中,在一定范围内可适当加大治疗剂量以提高疗效,也应避免过高能量引起不良反应。其次,激光治疗后一定时间内细胞呈持续抑制作用,但在一段时间后(21d),抑制作用呈减弱趋势,提示治疗可在一定时间内重复进行,但临床使用还需要进一步观察研究。例如治疗需要间隔,给予血管瘤内皮细胞生长恢复的时间。强脉冲光和Nd:YAG激光的这一作用机制目前尚不清楚,根据目前文献报道及研究考虑与细胞生长因子,信号通路有关,这还需要进一步的研究。婴儿血管瘤的发病机制研究并不透彻,但目前的研究显示,血管瘤发病机制是多环节,多靶点的,因此提示婴儿血管瘤的治疗除目前的治疗方法外,可尝试多环节多靶点的治疗,并可考虑综合治疗,以提高血管瘤的治疗疗效。
[参考文献]
[1]Mulliken JB.Vascular birthmarks,hemangiomas and malformations[M].Philadelphia,WB Saunders,1988:24-37.
[2]仇雅骡,马刚,林晓曦.婴幼儿血管瘤发生与形成机制的研究进展[J].中华整形外科杂志,2012,28(3):233-236.
[3]朱雅琳,聂晶,李建华,等.可变脉宽1 064nm Nd:YAG激光联合强脉冲光治疗鲜红斑痣疗效评价[J].中国麻风皮肤病杂志,2014,30(6):355-357.
[4]Zhu Y,Tuerxun A,Hui Y,et al.Effects of propranolol and isoproterenol on infantile hemangioma endothelial cells in vitro[J].Exp Ther Med,2014,8(2):647-651.DOI:10.3892/etm.2014.1780.
[5]朱雅琳,侯巍,帕丽达·阿布利孜.普萘洛尔及异丙肾上腺素对体外培养婴儿血管瘤内皮细胞增殖和血管内皮细胞生长因子、碱性成纤维细胞生长因子表达的影响[J].中华皮肤科杂志,2016,49(3):158-162.DOI:10.3760/cma.j.issn.0412-4030.2016.03.002
[6]朱雅琳,马龙,帕丽达.阿布力孜.普萘洛尔及异丙肾上腺素对婴儿血管瘤内皮细胞β2肾上腺素受体表达的影响.中华皮肤科杂志,2017,50(9):673-675.DOI:10.3760/cma.j.issn.0412-4030.2017.09.014.
[7]Storch CH, Hoeger PH. Propranolol for infantile haemangiomas:insights into the molecularmechanismsofaction[J].Br J Dermatol, 2010,163(2):269-274.
[8]Greenberger S,Boscolo E,Adini I,et a1.Corticosteroid suppression of VEGF-A in infantile hemangioma-derived stem cells[J].N Eng
J Med,2010,362(11):1005-1013.
[9]Chisholm KM,Chang KW,Truong MT,et al.β-Adrenergic receptor expression in vascular tumors[J].Mod? Pathol,2012,25(11):1446-1451.
[10]Schuller HM.Neurotransmitter receptor-mediated signaling pathways as modulators of carcinogenesis[J].Prog Exp Tumor Res,2007,39:45-63.
[11]Ji Y,Chen SY,Xu T,et al.The role of beta-adrenergic receptor signaling in the proliferation of hemangioma-derived endothelial cells[J].Cell Div,2013,8(1):1.
[12]Przewratil P,Sitkiewicz A,Andrzejewska E.Serum levels of basic fibroblastic growth factor(bFGF)in children with vascular anomalies:another insight into endothelial growth[J].Clin Biochem,2010,
43(10-11):863-867.
[13]Przewratil P,Sitkiewicz A,Andrzejewska E.Local serum levels of vascular endothelial growth factor in infantile hemangioma:intriguing mechanism of endothelial growth[J].Cytokine,2010,49(2):141-147.
[14]Bokoch MP,Zou Y,Rasmussen SG,et a1.Ligand-specific regulation of the extracellular surface of a G-protein--coupled receptor[J].Nature,2010,463(7277):108-112.
[15]Yang H,Deng C,Shen S,et a1.Expression and significance of Bcl-2,Bax,Fas and caspase-3 in different phases of human hemangioma[J].J Huazhong Univ Sci Technolog Med Sci,2006,26(4):402-404.
[收稿日期]2018-12-27
本文引用格式:朱雅琳,聶晶,帕丽达·阿布利孜.强脉冲光与长脉宽Nd:YAG激光对婴幼儿血管瘤内皮细胞活性的影响[J].中国美容医学,2019,28(9):96-101.
- 国内人力资源胜任力研究的定量分析
- 农村人居环境的人类学探析
- 商科类大学生人文精神培育的反思
- 充分发挥农村党支部在甘肃乡村振兴中的“四力”作用研究
- 我国职业技术教育政策研究述评
- 大学生创新创业教育现状分析
- 大学生线上/线下学习模式的满意度调查分析
- 新时代职业院校青年教师培训工作探讨
- 职业本科院校市场营销专业人才培养模式构建研究
- 基于因子分析的管理类大学生就业能力研究
- 民企与国企员工工资差异分析
- 切实提高共青团组织思想引领工作时效性的研究
- “乡村振兴”视域下广东山区乡镇劳动力回流路径研究
- 职业教育中“工匠精神”的挖掘与融入
- 浙江东阳横店: 从“文化洼地”到“文化产业制高点”
- 辽宁省全要素生产效率测算及影响因素研究
- 新时期烟草经济增长的困境及其对策研究
- 供给侧改革视角下百色铝制造业结构性问题研究
- 聚焦现代工业技术进步 推动山东省产业升级
- 2017年中国卫生总费用筹资水平和筹资结构的地域性差异分析
- 贵州新型城镇化绿色发展的问题及策略分析
- 江苏省医药制造业创新能力研究
- 公共危机审计治理问题研究
- “互联网+”时代完善高校收费管理路径探析
- 全过程工程造价咨询的各阶段关注要点分析
- nonliberal
- non-liberal
- nonlibrarian
- nonlibrarians
- nonlibraries
- nonlibrary
- nonlicensable
- nonlicensed
- nonlife
- non-life
- nonlimitation
- nonlimitations
- nonlimiting
- non-limiting
- nonlineal
- nonlinear
- nonlinearities
- nonlinearity
- nonlinkage
- nonliquefiable
- nonliquefying
- non-liquidating
- nonliquidating
- nonliquidation
- nonliquidations
- 呈味
- 呈头
- 呈头露脸
- 呈奇
- 呈奉
- 呈奏
- 呈子
- 呈寒光的月色
- 呈底
- 呈弧形的桥
- 呈强碱性反应的土壤
- 呈形
- 呈报
- 呈报的公文
- 呈拽
- 呈控
- 呈政
- 呈教
- 呈文
- 呈显
- 呈束状的光
- 呈束状的光线
- 呈样
- 呈正
- 呈残破凋零气象的山水景物