
摘要:目的 探讨解毒清肺合剂调节慢性阻塞性肺疾病模型大鼠气道黏液高分泌的作用机制。方法 采用气道滴注脂多糖联合烟熏方法建立慢性阻塞性肺疾病模型。40只清洁级Wistar大鼠随机分为空白对照组、模型组、解毒清肺组与克拉霉素组。模型组、解毒清肺组、克拉霉素组分别给予生理盐水、解毒清肺合剂、克拉霉素灌胃,空白对照组正常喂养,连续30 d。实验第31日,处死大鼠提取肺组织,每组随机选取6只,HE染色观察肺组织病理形态及黏液腺体增生,实时荧光定量PCR检测各组大鼠肺组织中性粒细胞弹性蛋白酶(NE)、黏蛋白5AC(MUC5AC)mRNA表达,免疫组化检测肺组织及气道上皮NE、MUC5AC蛋白表达。结果 与空白对照组比较,模型组气道上皮黏液腺体增生、肺组织NE及MUC5AC mRNA表达、气道上皮NE及MUC5AC蛋白表达升高(P<0.05,P<0.01);与模型组比较,解毒清肺组气道上皮黏液腺体增生显著降低(P<0.01),且作用与克拉霉素组相当;解毒清肺组肺组织NE、MUC5AC mRNA表达显著降低(P<0.01),且作用优于克拉霉素组;解毒清肺组气道上皮MUC5AC蛋白表达降低(P<0.05),且作用与克拉霉素组相当。解毒清肺组和克拉霉素组气道上皮NE蛋白表达与模型组无差异。结论 解毒清肺合剂通过NE下调MUC5AC蛋白表达,调节慢性阻塞性肺疾病气道黏液高分泌。
关键词:解毒清肺合剂;慢性阻塞性肺疾病;气道黏液高分泌;弹性蛋白酶;黏蛋白5AC;大鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)05-0073-05
Effects of Jiedu Qingfei Mixture on Expressions of NE and MUC5AC in Lung Tissue of Rats with Chronic Obstructive Pulmonary Disease CHEN Ying1, FENG Cui-ling1, LI Gen-mao2, GE Dong-yu2, WANG Jun1 (1. Dongzhimen Hosipital, Beijing University of Chinese Medicine, Beijing 100700, China; 2. Beijing University of Chinese Medicine, Beijing 100029, China)
Abstract: Objective To explore the mechanism of Jiedu Qingfei Mixture for airway mucus hypersecretion of rat models with chronic obstructive pulmonary disease (COPD). Methods Airway instilling lipopolysaccharide combining fuming method was used to establish COPD models. Forty clean level Wistar strain rats were randomly divided into blank control group, model group, Jiedu Qingfei group, and clarithromycin group. Model group, Jiedu Qingfei group, and clarithromycin group were given normal saline, Jiedu Qingfei Mixture, and clarithromycin by gavage respectively, while the blank control group was raised normally for 30 d. All rats were killed on the 31st day for taking lung tissue (6 rats from each group were chosen randomly). Pathological changes of lung tissue and mucous glands hyperplasia were observed by HE staining method. NE and MUC5AC mRNA expression on lung tissue were detected by RT-PCR method. Protein expressions of NE and MUC5AC on pulmonary tissue and airway epithelium were detected by immunohistochemical method. Results Compared with blank control group, mucous glands hyperplasia on airway epithelium, mRNA expression of NE and MUC5AC in lung tissue, and protein expressions of NE and MUCA5C on airway epithelium in the model group significantly increased (P<0.05, P<0.01). Compared with model group, mucous glands hyperplasia on airway epithelium in Jiedu Qingfei group significantly decreased (P<0.01), as same as clarithromycin group; Jiedu Qingfei group showed better effects on down-regulating NE and
MUC5AC mRNA expression in lung tissue compared with clarithromycin group. MUC5AC protein expression on airway epithelium in Jiedu Qingfei group significantly decreased (P<0.05), as same as clarithromycin group. Jiedu Qingfei group and clarithromycin group had no difference on NE protein expression in airway epithelium compared with model group. Conclusion Jiedu Qingfei group Mixture can reduce airway mucus hypersecretion of COPD by down-regulating MUC5AC expression through neutrophil elastase.
Key words: Jiedu Qingfei Mixture; chronic obstructive pulmonary disease; airway mucus hypersecretion; neutrophil elastase; MUC5AC; rats
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种严重危害人类健康的慢性呼吸系统疾病。以黏蛋白5AC(Mucin 5AC,MUC5AC)为主的气道黏液高分泌被认为是影响COPD病情和预后的独立危险因素[1],气道黏液高分泌的机制主要有病原相关分子模式、中性粒细胞弹性蛋白酶(neutrophil elastase,NE)、细胞因子[2],而NE被认为是目前已知最强促黏液分泌剂[3]。COPD属中医学“肺胀”范畴,痰、热、毒为慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)主要病理因素[4]。前期研究表明,解毒清肺合剂可减少AECOPD模型大鼠气道杯状细胞的化生,减少气道黏液高分泌[5]。为进一步探索其作用机理,我们以NE为观察靶点,探索解毒清肺合剂调节COPD气道黏液高分泌的作用机制。
1 材料与方法
1.1 动物
6~8周雄性清洁级Wistar大鼠,体质量(250±20)g,许可证号SCXK(京)2009-0007,北京华阜康生物科技股份有限公司。饲养于北京中医药大学东直门医院中医内科学教育部重点实验室动物房,SPF级常规饲养。
1.2 药物
解毒清肺合剂(炙麻黄、炒苦杏仁、生石膏、炙甘草、桔梗、黄芩、牛蒡子、僵蚕、白花蛇舌草等),北京中医药大学东直门医院院内制剂,批号11040101;克拉霉素片,丽珠集团制药厂,批号120201,0.25 g/片。
1.3 主要试剂与仪器
脂多糖(LPS,美国Sigma公司),大前门牌香烟(上海卷烟厂),Trizol RNA提取试剂(Invitrogen公司),M-MLV反转录酶(Promega公司),SYBR GreenPCR Master Mix试剂盒(BIO-RAD公司),引物由上海生工生物工程技术服务有限公司合成;一抗:NE(abcam,Ab21595,兔来源多克隆抗体),MUC5AC(abcam,Ab79082,鼠来源单克隆抗体),DAKO二抗,封闭液为10%山羊血清,阻断剂:3%H2O2。实时荧光定量PCR仪(BIO-RAD公司),自制烟熏箱、气管插管针(16号改良静脉套管针)。
1.4 分组、造模及给药
采用随机数字表法将40只Wistar大鼠随机分为空白对照组、模型组、解毒清肺组、克拉霉素组。解毒清肺合剂每日给药量为2.16 g/kg,相当于人临床用量的7倍。空白对照组正常饲养,其余3组分别给予生理盐水、解毒清肺合剂、克拉霉素(83.3 mg/kg)灌胃,每日给药量8 mL/kg,每日1次,连续30 d。采用气道滴注LPS联合烟熏方式,复制AECOPD气道黏液高分泌模型[6]。LPS气道滴注:于实验第1、14日气道内滴注浓度为1 mL/mg的LPS溶液0.2 mL。3.5%水合氯醛腹腔注射1 mL/100 mg麻醉大鼠,将麻醉大鼠仰卧位固定在鼠板上,头高尾低呈45°角放置,暴露声门,在光源下将套管针迅速插入大鼠气管内,拔出套管针钢芯,以棉丝放在塑料套管外口判断是否成功,插管成功后,先抽取空气0.3 mL后抽取LPS溶液0.2 mL,通过套管针快速注入气管,然后将大鼠固定板直立旋转,左右摇晃30次,使LPS溶液均匀分布于两肺。烟熏:实验第2~13、15~30日给予烟熏,每次10只大鼠,用8支香烟,30 min/d,气道滴注日不烟熏。
1.5 标本制备
实验第31日取材,腹主动脉放血处死动物,取右上叶肺组织,液氮保存,匀浆提取RNA;取右肺中叶,4%多聚甲醛溶液固定,常规脱水、透明、浸蜡、包埋及切片,厚度6 μm。实验过程中各组均有死亡,每组随机选取6只备检。
1.6 指标检测
1.6.1 HE染色 将肺组织切片经二甲苯Ⅲ、二甲苯Ⅱ、二甲苯Ⅰ、100%乙醇Ⅱ、100%乙醇Ⅰ、95%乙醇、90%乙醇、80%乙醇、70%乙醇、50%乙醇、蒸馏水、苏木精染液、盐酸乙醇溶液、清水、清水、氨水溶液、伊红染液、蒸馏水、50%乙醇、70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%乙醇Ⅰ、100%乙醇Ⅱ、二甲苯Ⅰ、二甲苯Ⅱ、二甲苯Ⅲ后入通风橱封片。使用Image-Pro Plus 6.0软件计算Reid指数(腺体厚度与支气管厚度之比)。
1.6.2 RT-PCR检测 前期研究表明,总RNA样品经琼脂糖凝胶电泳后,紫外灯下观察可见18 s、28 s两条清晰的条带,未被降解。紫外分光比色测定显示,所有RNA样品在260、280 nm处A值之比均在1.8~2.0之间,纯度符合要求,各目标融解曲线均为单一峰,扩增曲线均呈平行分布[7]。总RNA提取,RT-PCR扩增,引物1 μL。MUC5AC上游5'-CTGTGTCCATCT CAACCTTA-3',下游5'-GCTGCCATCTATCCAATCA-3',产物长度101 bp;NE上游5'-AATGTGACAGTGG TGACTAA-3',下游5'-GGCTGCGGATAATGGAAT-3',产物长度232 bp;β-actin基因为内参,上游5'-CCC ATCTATGAGGGTTACGC-3',下游5'-TTTAATGTCA CGCACGATTTC-3',产物长度150 bp。反应条件:94 ℃、10 min,55 ℃、10 s,72 ℃、10 s,共45个循环。CFX-96系统记录PCR反应及数据采集。
1.6.3 免疫组化检测 石蜡切片脱蜡至水,二甲苯(三缸8 min、8 min、8 min),梯度乙醇(无水、95%、75%)每缸5 min,自来水冲洗干净后,用蒸馏水冲洗1次。pH 6.0柠檬酸高温高压修复2 min,冷却至室温,转入TBS中,冲洗3次,每次5 min。3%双氧水室温20 min,TBS冲洗3次,每次5 min。10%山羊血清孵育20 min。滴加一抗(NE浓度为1∶100,MUC5AC浓度为1∶50),4 ℃过夜。第2日从4 ℃冰箱取出,复温15 min,TBS冲洗3次,每次5 min。每张切片滴加50 μL DAKO二抗,室温孵育25 min,TBS冲洗3次,每次5 min。甩去TBS,每张切片滴加50 μL新鲜配置的DAB,镜下观察。自来水冲洗,苏木素复染2 min,自来水冲洗。盐酸乙醇分化1~2 s,自来水冲洗,温水返蓝。切片放置梯度乙醇脱水干燥,二甲苯透明,中性树胶封片。应用Image-Pro Plus 6.0软件读取每个视野下阳性表达区域的平均光密度值。
1.7 统计学方法
采用SPSS17.0 统计软件进行分析。实验数据以—x±s表示,多组间均数比较采用方差分析,满足方差齐性时组间比较采用LSD法,不满足方差齐性时采用Tamhane's T2法进行两两比较。P<0.05表示差异有统计学意义。
2 结果
2.1 解毒清肺合剂对模型大鼠肺组织病理形态的影响
空白对照组大鼠气道黏膜上皮完整,纤毛无粘连、倒伏及脱落,上皮细胞极少坏死脱落,极少有杯状细胞,黏膜下腺体无增生、肥大;支气管管壁无充血、水肿,无淋巴细胞及浆细胞浸润,支气管腔内无分泌物形成,管壁平滑肌束无断裂、萎缩。模型组纤毛粘连、倒伏、脱落明显,上皮细胞增生、增厚,明显坏死脱落,杯状细胞增生,黏膜下腺体肥大;支气管壁及支气管周围淋巴细胞及浆细胞明显聚集浸润,管壁平滑肌束断裂、萎缩;肺泡间隔明显变薄并断裂,相邻肺泡广泛融合形成较大囊腔,典型肺气肿表现,肺间质充血明显。解毒清肺组纤毛粘连、脱落,上皮细胞坏死脱落较模型组及克拉霉素组减轻;支气管腔内可见少量淋巴细胞,杯状细胞增生程度较轻,支气管壁淋巴细胞浸润,管壁平滑肌束萎缩;肺泡间隔明显变薄、断裂,支气管周围相邻肺泡膈较多融合,肺间质淋巴细胞浸润,充血较模型组减轻。克拉霉素组纤毛粘连、倒伏、脱落,上皮细胞存在坏死脱落较模型组减轻,杯状细胞增生程度较模型组减轻;支气管壁淋巴细胞浸润,管壁平滑肌束萎缩;肺泡间隔明显变薄、断裂,支气管周围相邻肺泡膈融合较模型组减轻,肺间质淋巴细胞浸润,充血较模型组减轻。结果见图1。
空白对照组 模型组
2.2 解毒清肺合剂对模型大鼠气道上皮黏液腺体增生的影响
通过Reid指数评价黏液腺体增生。与空白对照组比较,模型组Reid值显著升高(P<0.01);与模型组比较,解毒清肺组、克拉霉素组Reid值均显著降低(P<0.01);与克拉霉素组比较,解毒清肺组Reid值无明显差异。结果见表1。
2.3 解毒清肺合剂对模型大鼠肺组织中性粒细胞弹性蛋白酶、黏蛋白5AC基因表达的影响
与空白对照组比较,模型组NE、MUC5A mRNA表达显著升高(P<0.05,P<0.01);与模型组比较,解毒清肺组NE、MUC5AC mRNA表达显著降低(P<0.01);克拉霉素组NE、MUC5AC mRNA表达显著降低(P<0.05);与克拉霉素组比较,解毒清肺组NE、MUC5AC mRNA表达显著降低(P<0.05)。结果见表2。
2.4 解毒清肺合剂对模型大鼠肺组织及气道上皮中性粒细胞弹性蛋白酶蛋白表达的影响
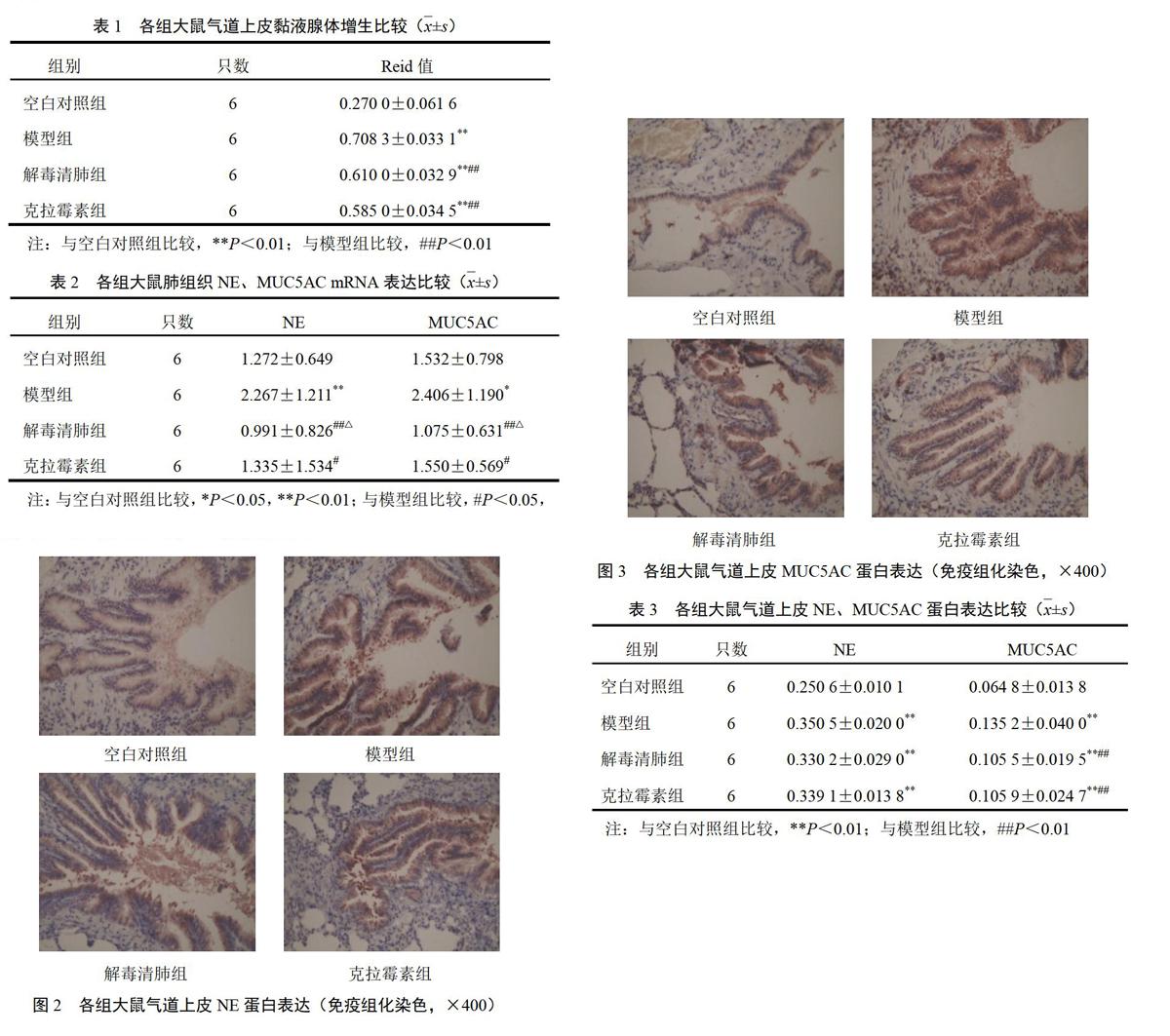
肺组织轮廓清晰,其中棕黄色区域为阳性蛋白表达(见图2),可见NE蛋白主要在肺组织小气道。与空白对照组比较,模型组大鼠气道上皮NE蛋白表达显著升高(P<0.01);与模型组比较,解毒清肺组、克拉霉素组大鼠气道上皮NE蛋白表达无明显差异;与克拉霉素组比较,解毒清肺组大鼠气道上皮NE蛋白表达无明显差异。结果见表3。
2.5 解毒清肺合剂对模型大鼠肺组织及气道上皮黏蛋白5AC蛋白表达的影响
肺组织轮廓清晰,其中棕黄色区域为阳性蛋白表达(见图3),可见MUC5AC蛋白主要在肺组织小气道。与空白对照组比较,模型组大鼠气道上皮MUC5AC蛋白表达显著升高(P<0.01);与模型组比较,解毒清肺组、克拉霉素组气道上皮MUC5AC蛋白表达显著降低(P<0.01);与克拉霉素组比较,解毒清肺组气道上皮MUC5AC蛋白表达无明显差异。结果见表3。
3 讨论
痰浊作为影响慢阻肺疾病发展进程的重要病理因素,贯穿COPD始终[8]。以往研究表明,痰热壅肺证是AECOPD最主要的证候表现[9],法随证立,因此提出清热、化痰、解毒法治疗AECOPD。
解毒清肺合剂为北京中医药大学东直门医董建华教授临床经验方清肺饮化裁而来,现为北京中医药大学东直门医院院内制剂,主要用于治疗风温肺热病痰热壅肺证,疗效显著[10]。其在麻杏石甘汤基础上,加黄芩、桔梗、牛蒡子、白花蛇舌草、白僵蚕等,具有清热解毒、宣肺化痰功效。研究表明,该方能提高呼吸道病毒感染患者自然杀伤细胞活力、增加IL-2活性[11],提高流感病毒A/PR/8/34(H1N1)感染小白鼠
血凝素抗体及神经氨酸酶抗体水平[12],降低血浆内皮素[13],提高巨噬细胞的吞噬功能[14]。方中麻黄味辛、微苦性温,入肺、膀胱经,具有发汗解表,宣肺平喘之功效;苦杏仁,苦,微温,归肺、大肠经,具有止咳平喘功效;二者配伍一宣一降,共同调节肺之气机,使痰浊易散。生石膏,辛,大寒,辛寒入肺经,善清肺经实热,与麻杏相配,为治肺热喘咳之常用配伍。黄芩,苦、寒,专入肺经,善清泻肺火及上焦实热,常用治肺热壅遏所致咳嗽痰稠。桔梗,苦、辛、平,归肺经,具有宣肺、祛痰、利咽、排脓功效。牛蒡子,辛、苦、寒,归肺、胃经,具有疏散风热、宣肺祛痰、利咽透疹、解毒消肿功效。白花蛇舌草,甘、寒,具有清热解毒,利湿通淋功效。白僵蚕,咸、辛、平,具有化痰散结功效。纵观全方,寒热配伍得当,热清使痰无助长之因,痰消使热无生长之源,麻杏一宣一降,顺应肺之宣发肃降的生理特性,使肺之气机调畅,痰热易消。
正常气道黏膜表面覆盖少许黏液(以MUC5AC为主),主要由气道上皮杯状细胞及黏膜下腺体分泌,在气道固有免疫中起着重要作用,而过度分泌的气道黏液则可引起肺功能及生活质量的下降、增加COPD急性加重的次数、频繁的住院率及高死亡率[15]。
NE是中性粒细胞分泌的丝氨酸蛋白,广泛存在于慢性气道炎症性疾病中。过多的NE可加重COPD炎症反应,诱导上皮细胞凋亡,还可通过增加MUC5AC mRNA表达的稳定性、激活活性氧簇相关信号通路、杯状细胞化生等多种途径,使其成为MUC5AC高分泌的强烈刺激因子。
NE作为COPD气道黏液高分泌的强烈刺激因子,可抑制NE活性能够显著减轻炎症反应及MUC5AC基因及蛋白表达。本研究显示,解毒清肺合剂可显著减轻COPD模型大鼠黏液腺体增生、支气管壁淋巴细胞浸润、肺泡隔融合等COPD典型病理形态学改变。另外,解毒清肺合剂还可通过抑制肺组织NE mRNA表达,降低MUC5AC mRNA及蛋白的表达,表明解毒清肺合剂可抑制COPD模型大鼠气道黏液高分泌。本研究显示,解毒清肺组大鼠气道上皮NE蛋白表达与模型组无差异。由于真核基因表达的转录和翻译发生的时间和位点存在时空间隔;在基因转录后,还有转录后加工、转录产物的降解、翻译、翻译后加工、降解及修饰很多层面,检测的时间点不同,均会使基因和蛋白水平出现不完全一致。另外,由于免疫组化在蛋白定量中检测方法的局限性,均可解释解毒清肺合剂在COPD模型大鼠NE基因及蛋白表达存在的差异性。
综上所述,解毒清肺合剂可能通过NE下调气道黏蛋白5AC表达,从而抑制COPD气道黏液高分泌,具体作用机制有待进一步深入研究。
参考文献:
[1] ROGERS D F. Physiology of airway mucus secretion and pathophysiology of hypersecretion[J]. Respir Care,2007,52(9):1134-1146.
[2] 倪圣,丁建中.气道黏液高分泌机制研究进展[J].长江大学学报(自然科学版),2013,10(9):97-101.
[3] HAUBER H P, FOLEY S C, HAMID Q, et al. Mucin overproduction in chronic inflammatory lung disease[J]. Can Respir J,2006,13(6):327-335.
[4] 孙雪松,许国磊.麻杏石甘汤加减治疗慢性阻塞性肺疾病急性发作临床观察[J].世界中医药,2015,10(2):199-205.
[5] 于会勇,王成祥,刘治坤,等.解毒清肺合剂对慢性阻塞性肺疾病急性加重期痰热蕴肺证模型大鼠气道杯状细胞的影响[J].中国中医药信息志,2012,19(8):31-33.
[6] 王骏,李春盈,刘治坤,等.慢性阻塞性肺疾病气道黏液高分泌型大鼠模型的建立[J].心肺血管病杂志,2014,33(4):592-595.
[7] 冯淬灵,司娜,王骏,等.清金化痰汤对慢性阻塞性肺疾病模型大鼠肺组织中性粒细胞弹性蛋白酶及黏蛋白基因表达的影响[J].中国中医药信息杂志,2015,22(5):76-79.
[8] 王琦,武维屏,田秀英,等.肺胀病机及益气活血化痰法的运用[J].中国医药学报,1995,10(3):29-31.
[9] 王至婉,李建生,余学庆,等.COPD急性加重期基础证及特征的临床调查研究[J].北京中医药大学学报,2010,33(10):703-708.
[10] 王成祥,杜怀棠.辨证治疗老年风温肺热病55例[J].中国中医急症, 1992,1(1):33-36.
[11] 欧敏,杜怀堂,姜良铎,等.清肺饮对风温肺热病患者NK-IFN-IL-2的调节作用[J].海军总医院学报,2001,14(4):231-233.
[12] 王成祥,王慧芳,沈杏生,等.清肺饮对流感病毒A/PR/8/34(H1N1)感染小白鼠血凝素抗体、神经氨酸酶抗体的影响[J].中国中药杂志,2004, 29(2):191-192.
[13] 欧敏,杜怀棠,段蕴铀.清肺饮对小鼠呼吸道流感病毒感染血浆内皮素的影响[J].北京中医药大学学报,2003,26(4):32-33.
[14] 王成祥,王惠芳,姜良铎,等.清肺饮对小鼠巨噬细胞吞噬功能的影响[J].中国中医药信息杂志,2003,10(10):32-33.
[15] RAMOUS F L, KRAHNKE J S, KIM V. Clinical issues of mucus accumulation in COPD[J]. Int J Chron Obstruct Pulmon Dis,2014, 9(1):139-150.
- 浅析新故事叙事对“民间讲述”艺术的调用
- 敦煌舞:渊源、特色与当代发展
- 我国饮酒环境下的DRUNKIN酒精站服务交互设计概念
- 试论传统美学思想在当前公益广告创意中的运用
- 秦岭北麓鄠邑区“紫邑溪园”乡村体验园景观规划初探
- 浅谈ACG亚文化在我国广告营销中的应用
- 网络销售市场下商用类软体沙发流行色研究
- 以盲人出行产品为例探讨产品系统设计中的需求获取
- 面向律师的个人知识管理平台设计策略
- 新时期高校传媒教育的实践与探索
- 网络游戏装备与社交账号继承问题探讨
- 基于景观视角的游客感知研究综述
- 近代日本学者中国美术考察之旅
- 探究“公园+”背景下当代城市公园转型策略
- 绘画个人语言形成的途径探究
- 关中地区唐代墓志四神纹饰研究
- 浅析融合背景下传统媒体新闻短视频的专业化生产
- 红旗越过汀江
- 文化引领下大运河“最精彩一段”苏州段建设策略研究
- 基于信息态度差异性分析的资源利用对策研究
- 红木养生家具的结构设计
- 虎头鞋纹样元素在游戏设计中的应用研究
- 办公家具的情感分析研究
- 舞乐歌风
- 浅析招贴设计中的符号学应用与研究
- sparrow
- sparrowish
- sparrowless
- sparrow-like
- sparrowlike
- sparrows
- sparry
- spars
- sparse
- sparsely
- sparseness
- sparsenesses
- sparser
- sparsest
- sparsities
- spartan
- spartanic
- spartanically
- spartanism
- spartanisms
- spartanly
- spartans
- spas
- spasm
- spasmatic,spasmatical
- 直打直
- 直打直击
- 直承顺接之辞
- 直抒
- 直抒己见
- 直抒胸次
- 直抒胸臆
- 直投
- 直投菜柜
- 直抵
- 直抹
- 直拔
- 直拔直
- 直拨
- 直拨电话
- 直拳
- 直拼杀
- 直挂
- 直挂的长的字画
- 直指
- 直指词
- 直挺
- 直挺挺
- 直捣
- 直捣巢穴