
摘要:目的 比较解毒化瘀方药物血清与药物血浆对凝血酶合并缺氧诱导PC12细胞损伤蛋白酶活化受体(PAR)-1、细胞外信号调节激酶(ERK)1/2表达的差异。方法 灌胃给药制备大鼠药物血清和药物血浆。采用三气培养箱和无糖DMEM培养液造成细胞缺氧模拟缺血,并同时加入150 U/mL凝血酶,建立体外缺氧合并凝血酶诱导的PC12细胞损伤模型。实验分为空白组、模型组、药物血清组及药物血浆组。实时荧光定量PCR检测细胞PAR-1、ERK1/2 mRNA表达,免疫荧光法检测细胞PAR-1、ERK1/2蛋白表达。结果 与空白组比较,模型组PAR-1、ERK1/2 mRNA和蛋白表达增强(P<0.05);与模型组比较,药物血清组和药物血浆组PAR-1、ERK1/2 mRNA和蛋白表达下降(P<0.05,P<0.01);药物血浆组PAR-1、ERK1/2表达较药物血清组下降(P<0.05)。结论 解毒化瘀方药物血浆抗缺氧合并凝血酶诱导PC12细胞损伤作用优于其药物血清。
关键词:解毒化瘀方;药物血浆;药物血清;PC12细胞;大鼠
DOI:10.3969/j.issn.1005-5304.2016.06.019
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2016)06-0073-04
Abstract: Objective To compare the differences between Jiedu Huayu Prescription containing serum and plasma on PAR-1, ERK1/2 expression of the PC12 cell injury model. Methods Rat serum containing and plasma models was prepared through gavage. Three gas incubators and sugar-free DMEM medium simulated ischemia caused by hypoxia were used, and 150 U/mL of thrombin was added, with a purpose to establish the thrombin-induced hypoxic PC12 cell injury model. The experiment was divided as control group, model group, serum containing group and plasma containing group. Real-time fluorescent quantitative PCR was used to detect the expression levels of PAR-1 and ERK1/2 mRNA in each group; immunofluorescence was used to detect the protein expressions of PAR-1 and ERK1/2. Results Compared with the control group, the expressions of PAR-1 and ERK1/2 mRNA and protein in model group were enhanced (P<0.05); compared with the model group, the expressions of PAR-1 and ERK1/2 mRNA and protein in serum containing group and plasma containing group decreased (P<0.05, P<0.01); the expressions of PAR-1 and ERK1/2 mRNA and protein in plasma containing group decreased more significantly than serum containing group (P<0.05). Conclusion Jiedu Huayu Prescription containing plasma was superior to its containing serum against the injury of PC12 cell induced by hypoxic and thrombin.
Key words: Jiedu Huayu Prescription; plasma containing medicine; serum containing medicine; PC12 cells; rats
中药血清药理学是指将中药或中药复方经口给动物灌服一定时间后采集动物血液、分离血清,用此含有药物成分血清进行体外实验的一种实验技术[1]。然而,近年来不少学者发现,中药复方或单味药药物血清与血浆在成分和作用上存在差异,且在大多数情况下,中药药物血浆较药物血清具有优势。
近年来,急性缺血性中风的中医病机理论取得重大突破,其中王永炎院士提出的“毒损脑络”病机假说得到了广泛的研究[2-6]。本课题组认为,缺血性中风主要病机瘀血阻滞、毒损脑络的形成与凝血酶毒性相关,化瘀解毒法是该病的有效治法。解毒化瘀方为基于“瘀毒”理论的中药复方,由黄连、黄芩、黄柏、栀子等8味中药组成。而凝血酶正是通过与蛋白酶活化受体(protease-activated receptor,PAR)结合发挥对神经细胞的毒性作用,同时,细胞外信号调节激酶(ERK)1/2系统在凝血酶诱导的脑耐受中发挥重要作用。故基于本课题组前期体外缺氧合并凝血酶诱导PC12细胞损伤模型的建立,研究该方药物血清与药物血浆对上述模型PAR-1、ERK1/2 mRNA和蛋白表达的差异,为血浆药理学方法的提出提供依据。
1 实验材料
1.1 动物
SPF级SD大鼠32只,5周龄,体质量180~200 g,雌雄各半,湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2013-0005。饲养于室温18~20 ℃、湿度65%~70%环境,自由饮水饮食。
1.2 实验细胞
PC12细胞,来源于大鼠的肾上腺嗜铬细胞瘤细胞,高分化、永生性,长沙赢润生物技术有限公司,编号2015032007。
1.3 药物及制备
解毒化瘀方(黄连9 g,黄芩6 g,黄柏6 g,栀子9 g,红花9 g,川芎12 g,赤芍12 g,地龙9 g)饮片购自湖南省中医药研究院附属医院中药房。第1次加4倍量蒸馏水,煎煮1 h,滤出煎液,第2次加2倍量蒸馏水,煎煮30 min,合并2次煎液,过滤浓缩至2 g/mL原药材药液,4 ℃冰箱保存备用。
1.4 主要试剂与仪器
DMEM高糖培养基,美国HyClone公司;胰蛋白酶,Sango公司;链霉素青霉素混合溶液(100 U/mL青霉素、100 g/L链霉素)、磷酸盐缓冲液(PBS,pH 7.2),GIBICO公司;胎牛血清,美国HyClone公司。凝血酶,中国Solarbio试剂公司;Trizol,Invitrogen公司;SYBR Green PCR试剂盒,Thermo公司,批号#K0223;反转录试剂盒,Fermentas公司,批号#K1622;一抗-蛋白酶活化受体(PAR-1),sc-13503,Santa Cruz公司;二抗-TRITC标记山羊抗小鼠IgG,CW0152,康为世纪公司;一抗-p44/42MAPK(ERK1/2),#9102,Santa Cruz公司;二抗-TRITC标记山羊抗兔IgG,CW0160,康为世纪公司。普通CO2培养箱(德国贺利氏,Heracell),三气培养箱(Thermo,3131),Real-time检测仪(ABI公司,ABI-7300),低温冷冻离心机(上海卢湘仪离心机仪器有限公司,TG-16M),电动匀浆机(FLUKO,PRO200),旋涡振荡器(青浦泸西仪器厂,K30),激光共聚焦显微镜(日本奥林巴斯,CSC6F24407)。
2 实验方法
2.1 药物血清与药物血浆制备
SD大鼠适应性饲养7 d,随机分为空白血浆组、空白血清组、药物血浆组、药物血清组,每组8只,药物血浆组和药物血清组每日给予解毒化瘀方煎液36.4 g/kg灌胃(按动物体表面积剂量换算,相当于5倍临床等效剂量),空白血浆组和空白血清组予等量蒸馏水灌胃。药液浓度为2 g/mL,每只给药体积按36.4 g/kg换算,每日1次,连续7 d。末次给药前禁食12 h,末次给药后1 h,腹腔注射10%水合氯醛(1 mL/250 g)麻醉,无菌条件下腹主动脉采血。血清组所采血液置于普通采血管,37 ℃水浴30 min,置于4 ℃冰箱过夜,凝固后3000 r/min离心15 min,取上清液为血清。血浆组所采血液置于抗凝管内(所含抗凝剂为1.5%EDTA-Na2,血液∶抗凝剂=9∶1),轻颠3次,使抗凝剂与血液充分混合,3000 r/min离心15 min,取上清液为血浆。将制备好的血清与血浆过滤除菌后分装,置于-80 ℃冰箱保存备用。
2.2 PC12细胞培养及缺氧缺血损伤模型的建立
PC12细胞用10%胎牛血清,1%100 U/mL青霉素、100 g/L链霉素混合溶液,90%DMEM高糖培养基配成的完全培养液培养于37 ℃、5%CO2及饱和湿度培养箱中,2 d换液1次,待细胞成长融合后传代培养。细胞以1×105个/mL接种于96孔培养板,每孔0.18 mL,培养24 h待细胞完全贴壁后再加终浓度为50 μg/L神经生长因子诱导分化72 h[7]弃原培养液,加入含150 U/mL凝血酶的无血清低糖培养基,置于三气培养箱中(5%CO2、1%O2、94%N2)培养模拟缺氧缺血过程,12 h后取出。
2.3 分组
取诱导分化72 h后、融合80%以上PC12细胞进行实验,随机分为空白组、模型组、药物血浆组和药物血清组。模型组、药物血浆组和药物血清组均需加入含150 U/mL凝血酶的无血清低糖培养基,置于三气培养箱中培养,空白组加入完全培养液普通培养箱培养。12 h后,弃原培养液,模型组、药物血浆组和药物血清组分别加入完全培养液、含10%药物血浆完全培养液、含10%药物血清完全培养液,空白组则加入等量完全培养液,均置于普通培养箱培养24 h后备检。 2.4 指标检测
2.4.1 实时荧光定量PCR检测细胞蛋白酶活化受体-1、细胞外信号调节激酶1/2 mRNA表达 引物合成:引物设计合成纯化均由Invitrogen Biotechnology Co.,LTD中国公司完成,所用引物见表1。细胞总RNA的提取:按照试剂盒说明提取细胞RNA,紫外分光光度计测定RNA纯度,并进行RNA定量。PCR条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃复性45 s,60 ℃延伸1 min,40个循环。PCR产物分析:取PCR产物琼脂糖凝胶中电泳,紫外灯下观察条带,数据采用仪器自带软件ABI Prism 7300 SDS Software分析。各标本重复3次,取其平均值。
2.4.2 免疫荧光法检测细胞蛋白酶活化受体-1、细胞外信号调节激酶1/2蛋白表达 取各组细胞,吸去培养基后PBS洗3次×10 min,加4%多聚甲醛固定15 min,PBS洗3次×10 min,加0.5%Triton穿孔10 min,PBS洗3次×10 min,加5%胎牛血清封闭30 min,加一抗(1∶200封闭液稀释),4 ℃过夜,PBS洗3次×10 min,加TRITC标记的抗小鼠荧光二抗(1∶50封闭液稀释),室温避光30 min,PBS洗3次×10 min,加Hoechst33258(1∶200)核染10 min,PBS洗3次×10 min后,加甘油封片,于激光共聚焦显微镜下观察,以平均荧光强度值反映蛋白的表达强度。
3 统计学方法
采用SPSS17.0统计软件进行分析。实验结果以—x±s表示。组间比较用方差分析,组间两两比较,方差齐者用LSD检验,方差不齐者用Dunnet'T3检验。P<0.05表示差异有统计学意义。
4 结果
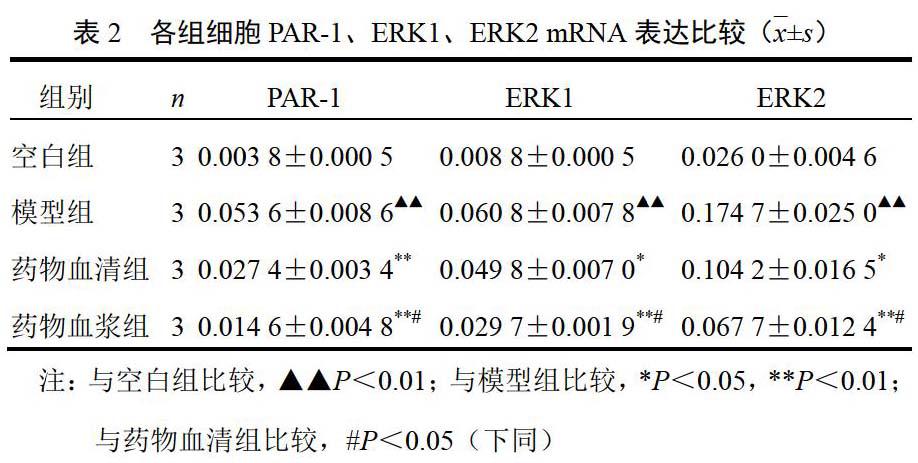
4.1 解毒化瘀方药物血清与药物血浆对模型大鼠蛋白酶活化受体-1、细胞外信号调节激酶1/2 mRNA表达的影响
与空白组比较,模型组PAR-1、ERK1、ERK2 mRNA表达增强(P<0.01);与模型组比较,药物血清组和药物血浆组PAR-1、ERK1、ERK2 mRNA表达下降(P<0.05,P<0.01);药物血浆组PAR-1、ERK1、ERK2 mRNA表达较药物血清组下降(P<0.05)。结果见表2。
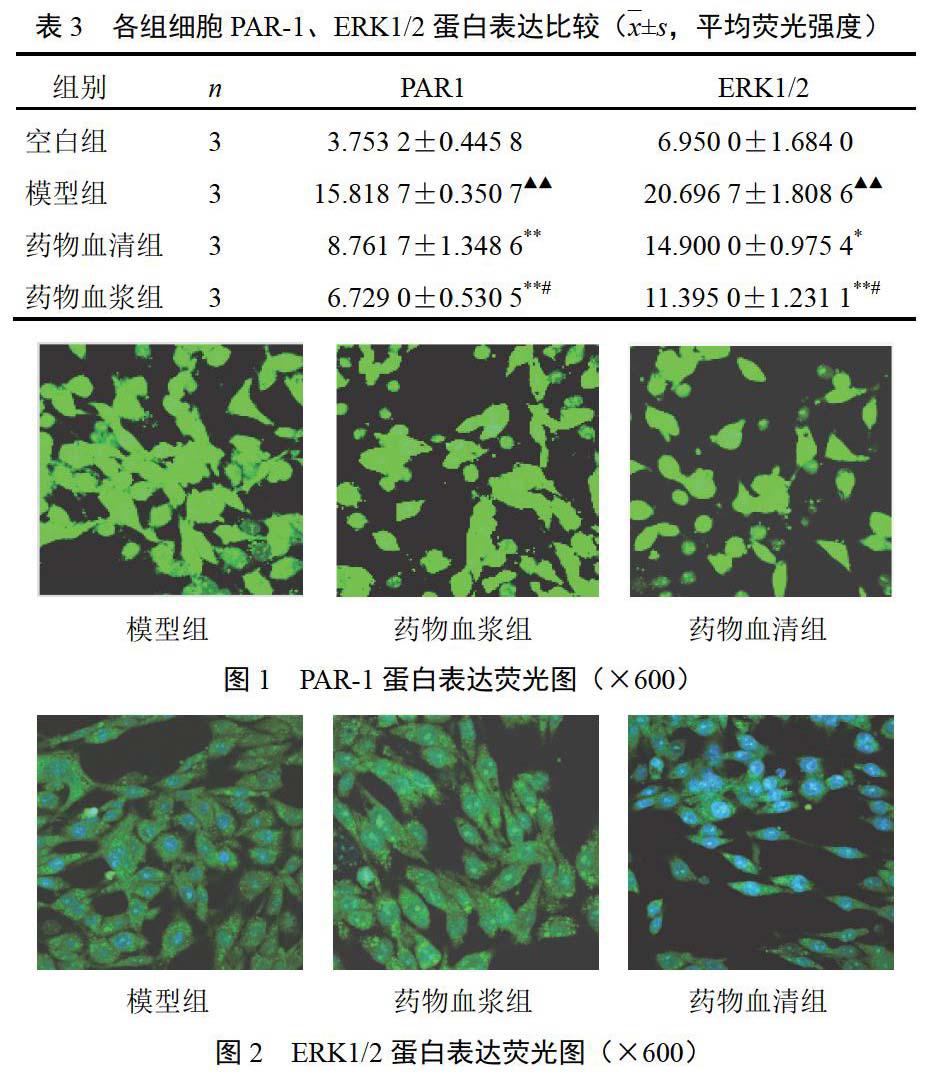
4.2 解毒化瘀方药物血清与药物血浆对模型大鼠蛋白酶活化受体-1、细胞外信号调节激酶1/2蛋白表达的影响
与空白组比较,模型组PAR-1、ERK1/2蛋白表达增强(P<0.01);与模型组比较,药物血清组和药物血浆组PAR-1、ERK1/2蛋白表达下降(P<0.05,P<0.01);其中,药物血浆组PAR-1、ERK1/2蛋白表达较药物血清组下降(P<0.05)。结果见表3、图1、图2。
5 讨论
中药血清药理学不仅具有体外实验的优点,如条件可控性强,可以进行大量的药理效应实验观察,较整体动物容易控制,并可在细胞、亚细胞水平进行超微、生化、受体、基因等方面的研究,揭示药物作用机理较为深入,重复性好,使用材料少等,而且避免了中药粗制剂直接进行体外实验的缺陷,更加接近中药经消化吸收后在体内产生的作用。然而,经消化道吸收的中药有效成分在体内进入的是血浆,而非血清。不同于血浆,血清是血液凝固后除去纤维蛋白与血细胞的液体成分,血液凝固过程及其激发的一系列生物学反应不仅明显改变了血液成分,而且对中药成分与其派生物质可能产生影响。2003年,有学者查阅我国大量发表的有关“血清药理学”的论著,发现绝大部分其实是“血浆药理学”,只有少部分是真正的血清药理学[8];同时也有学者从血液生理的角度通过实验研究认为,某些情况下血浆药理学方法能更好地再现体内环境中产生的药理效应[9]。因此,贺氏等[10]提出了“血浆药理学方法”。
近年来,凝血酶在急性缺血性中风发生发展中的作用受到了学术界的重视,凝血酶不仅是血液凝固、血栓形成的关键水解酶,而且也通过与PAR结合发挥对神经细胞的毒性作用。因此,以凝血酶为靶点来研究急性缺血性中风具有重要价值。PAR介导的凝血酶反应在脑损伤中具有双重作用,凝血酶在低浓度时诱导脑耐受性,而在高浓度时对脑细胞产生毒性效应而加重对脑组织的损害,以上过程是通过信号转导来实现的。丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPKs)是细胞内的一类丝/苏氨蛋白激酶,可将胞外刺激信号传递给胞核,导致细胞应激和损伤反应。ERK是MAPK家族的一员,属丝/苏氨酸蛋白激酶,正常定位于胞浆,当激活后转位至胞核,调节转录因子活性,产生细胞效应。ERK家族有5个亚族,包括ERK1~ERK5,其中ERK1/2系统在凝血酶诱导的脑耐受中发挥重要作用。ERK1/2磷酸化可促进神经细胞存活,但持续的磷酸化能导致细胞的凋亡。
本研究采用实时荧光定量PCR及免疫荧光法检测解毒化瘀方药物血清与药物血浆对凝血酶合并缺氧诱导PC12细胞损伤模型PAR-1、ERK1/2 mRNA和蛋白表达的影响。实验结果表明,药物血浆抗凝血酶合并缺氧诱导PC12细胞损伤作用强于药物血清。这可能是因为血液通过凝血形成血清的过程中,激活了许多酶类物质以及血小板和白细胞,这些活性物质可能会产生能降解中药有效成分的作用。同时,凝血过程中形成的纤维蛋白及其网络的血细胞很可能会吸附或结合一些中药有效成分,从而减少中药有效成分,造成效应减弱。因此,对于使用药物血浆和药物血清均可的实验,药物血浆能更真实地反映药物疗效。
参考文献:
[1] IWAMA H, AMAGAYA S, OGIHARA Y. Effect of Shosaikoto, a Japanese and Chinese Traditional Herbal Medicinal mixture,on the mitogenic activity of lipopolysaccharide:a new pharmacological testing method[J]. Journal of Ethnopharmacology,1986,21(1):45-53.
[2] 李澎涛,王永炎,黄启福.“毒损脑络”病机假说的形成及其理论与实践意义[J].北京中医药大学学报,2001,24(1):1-6.
[3] 魏江磊.中风热毒论[J].北京中医药大学学报,2003,26(1):7-8.
[4] 郑春叶,卢明,黄燕.中风从毒论治浅议[J].中国中医药信息杂志, 2007,14(8):5-6.
[5] 常富业,张允岭,王永炎.毒的临床表征与中风病毒损脑络探析[J].江苏中医药,2009,41(4):13-14.
[6] 刘爱华,魏江磊,李昊.中风热毒论研究思路探讨[J].时珍国医国药, 2009,20(3):741-742
[7] BO C, BETH F, MICHAEL A W, et al. Thrombin activity associated with neuronal damage during acute focal ischemia[J]. J Neuroscience, 2012,32(22):7622-7631.
[8] 罗焕敏.“血清药理学”与“血浆药理学”[J].中国药理学通报,2003, 19(9):1075-1076.
[9] WANG D S, CHEN F P, HE S L, et al. Comparison of plasma and serum pharmacologic methods in evaluating the effect of Dahuang Zhechong Capsule on platelet aggregation[J]. Chin J Thromb Hemost,2005,ll(1):5-8.
[10] 贺石林,葛金文,贺蓉,等.质疑血清药理学,加强多层次半体内实验研究[J].中国药理学通报,2005,21(3):277-279.
(收稿日期:2015-10-24)
(修回日期:2015-11-17;编辑:华强)
- 普惠金融视角下社区银行发展的优势、借鉴及建议
- 国外农民专业经济合作组织经验借鉴及启示
- 论美国主导下的TPP对中国的挑战
- 我国与美国环保NGO公益诉讼的发展与借鉴
- 治理高校教育政策执行性腐败新探究
- 认知抑制与理性思维新论
- 国际视域下的高校信息化部门建设探析
- 新发展理念下发展经济与收入分配的辩证思考
- 基于生态足迹的区域可持续发展研究
- 中国养老产业发展研究
- 社会保障与劳动就业相关性研究
- 人民币国际化对中国经济的影响分析
- 产权视角下资源型国有企业资产管理深化改革研究
- 地区差异、企业投资与经济增长质量研究
- 我国不同地区居民储蓄影响因素的实证分析
- 中央企业集团产贸融结合促可持续发展路径探析
- 我国民营企业投资影响因素的研究
- 保障性住房存在问题及其对策的研究综述
- 户籍制度改革研究
- 基于社会资本视角的农户信贷约束分析
- 劳动二重性原理的清源和正本研究
- 中国特色社会主义依法治国探究
- 关于我国环保NGO发展的制度建议
- 我国全民健身的政府服务及其评价分析
- 对医院会计核算的对策思考
- shut/close your eyes to
- shut down
- shutdown
- shutdowns
- shut-eye
- shut eye
- shuteye
- shut-eyes
- shut-in
- shut in
- shut-ins
- shut-in well
- shut-in wells
- shut off
- shut off/down
- shut out
- shut-out
- shuts
- shut sb in (sth) / shut yourself in (sth)
- shut sb/sth away
- shut sb/sth off (from sth)
- shut sb/sth out
- shut sb/sth up
- shut sb/sth up (in sth)
- shut sb/sth ↔ away
- 依山傍险
- 依山带水
- 依山带海
- 依山绕河,地势险要
- 依山而筑的城市
- 依山谷作遮捕禽兽的拦圈
- 依山阻水
- 依山阻江
- 依山阻海
- 依希犹记
- 依常
- 依年齿大小排列座次
- 依年龄大小排的位次
- 依序遵行
- 依底样写
- 依庭玉树
- 依弗哪
- 依归
- 依得
- 依循
- 依心
- 依心像意
- 依怙
- 依恃
- 依恃富贵