黎元元 方邦江 刘健 苗梦莉 谢雁鸣


摘要?目的:獲得悦安欣苦碟子注射液不良反应(ADR)发生率、发生特征和影响因素。方法:多中心、大样本、前瞻性医院集中监测方法,对使用悦安欣苦碟子注射液的住院患者进行监测。结果:在全国20家监测医院完成监测病例30?013例。首例入组时间为2012年10月,末例结束监测为2015年8月,共发生ADR/ADE?50例,经过三级判定方法,判定ADR?43例,发生率为1.43‰,属于偶见不良反应(发生率1‰~1%)。其中新的ADR1例,表现为结膜出血;一般ADR共42例,不良反应表现为皮肤瘙痒、皮疹、头痛为主,累及全身8个不同系统损伤;无严重ADR。ADR多发生在用药当天30?min内,不良反应影响因素分析提示:年龄段为65以上,有过敏史,高浓度,有合并用药时应重点关注不良反应的发生。结论:安全性医院集中监测是获得中药注射剂不良反应发生率的有效途径,悦安欣苦碟子注射液的安全性良好。
关键词?悦安欣苦碟子注射液;安全性评价;医院集中监测;不良反应;皮疹;皮肤瘙痒;注册登记研究;安全性证据体
Safety?Report?of?30?013?Yueanxin?Kudiezi?Injection?Based?on?Centralized?Hospital?Monitoring
LI?Yuanyuan1,?FANG?Bangjiang2,?LIU?Jian3,?MIAO?Mengli4,?XIE?Yanming1
(1?Institute?of?Basic?Research?in?Clinical?Medicine,?China?Academy?of?Chinese?Medical?Sciences,?Beijing?100700,?China;?2?Emergency?Department,?Longhua?Hospital?of?Shanghai?University?of?Traditional?Chinese?Medicine,?Shanghai?200032,?China;?3?The?First?Affiliated?Hospital?of?Anhui?University?of?Chinese?Medicine,?Hefei?230009,?China;?4?Renmin?University?of?China,?Beijing?100872,?China)
Abstract?Objective:To?obtain?incidence,?characteristics?and?influencing?factors?of?adverse?drug?reactions(ADR)of?Yueanxin?Kudiezi?Injection(YAX).?Methods:A?multi-center,?large-sample,?prospective?hospital?centralized?monitoring?method?was?used?to?monitor?inpatients?who?used?YAX.?Results:A?total?of?30?013?cases?were?monitored?in?20?monitoring?hospitals?nationwide.?The?first?case?was?enrolled?in?October?2012?and?the?last?case?was?monitored?in?August?2015.?ADR/ADE?occurred?in?a?total?of?50?cases.?After?a?three-level?determination?method,?43?cases?of?ADR?were?determined?with?an?incidence?rate?of?1.43?‰,?which?was?an?occasional?adverse?reaction(incidence?rate?1?‰~1%).?One?new?ADR?showed?conjunctival?hemorrhage.?There?were?42?ADR?cases?in?general.?The?adverse?reactions?were?mainly?pruritus,?rash,?and?headache,?involving?8?different?systemic?injuries?throughout?the?body.?There?was?no?serious?ADR.?ADR?mostly?occured?within?30?minutes?of?the?day?of?medication.?Analysis?of?influencing?factors?of?adverse?reactions?suggests?that?the?age?group?is?over?65,?with?a?history?of?allergies,?high?concentration,?and?should?pay?attention?to?the?occurrence?of?adverse?reactions?when?combined?medication?is?used.?Conclusion:Centralized?monitoring?in?safety?hospitals?is?an?effective?way?to?obtain?the?incidence?of?adverse?reactions?of?traditional?Chinese?medicine?injections.?The?safety?of?YAX?injection?is?good.
Keywords?Yueanxin?Kudiezi?Injection;?Safety?evaluation;?Hospital?centralized?monitoring;?Adverse?reactions;?Rash;?Itchy?skin;?Registration?research;?Safety?evidence?body
中图分类号:R259文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.01.006
悦安欣苦碟子注射液是从抱茎苦荬菜中提取总黄酮和腺苷制成的中药注射剂,具有活血止痛、清热祛瘀的功效,目前广泛应用于治疗冠心病心绞痛、缺血性中风[1-3]。关于悦安欣苦碟子注射液的安全性问题,既往诸多学者进行了安全性文献分析、医院信息系统数据回顾性分析等[4-7],其局限性在于来源于多个文献的数据质量参差不齐,无法获得较为准确的不良反应(Adverse?Reaction,ADR)数据,也无法计算ADR发生率。因此,本研究依据国家法规及国家食品药品监督管理总局2010年发布的中药注射剂安全性再评价等7个技术指导原则要求[8],基于多中心、大样本的医院集中监测设计方法,在全国20家医疗机构进行悦安欣苦碟子注射液医院集中监测研究,以期获得ADR发生率和发生特征,为其安全合理用药提供科学依据。
1?资料与方法
1.1?研究设计?采用前瞻性、多中心、大样本注册登记式医院集中监测方法[9]。
1.2?监测对象?2012年10月至2015年8月期间,在监测机构使用悦安欣苦碟子注射液的住院患者。
1.3?样本量?根据国际通用“三例原则”,监测前确定样本量是3万例。
1.4?监测周期?用药期间全程观察。
1.5?监测形式及内容?本监测的形式分为2种,一是由临床医师观察,并由临床医师填写监测表;二是由临床医师观察,继而将观察结果上报药师,由药师填写监测表。监测表分为A,B表。A表包括一般信息、诊断信息、用药信息、联合用药信息,所有病例均需填写;B表是不良事件相关信息,仅登记发生不良事件/反应。A,B表具体内容是:1)一般信息:包括性别、年龄、生命体征、个人过敏史、家族过敏史等;2)诊断信息:包括西医诊断、中医诊断、合并疾病;3)用药信息:包括使用方式、用药天数、药物剂量、溶媒、溶媒用量、注射室温、配液放置时间、注射持续时间、滴速;4)联合用药信息:合并用药名称、注射前使用的注射剂名称、注射期间使用的注射剂名称、注射后使用的注射剂名称、注射前后是否冲管、注射前后是否更换输液器;5)不良反应/事件信息:不良反应/事件名称、发生时间、症状、体征、临床检验,不良反应/事件结果、转归、预后,怀疑药品、溶媒、输液器、并用药品的名称、批准文号、通用名、生产厂家、批号、用法用量、室温等,关联性评价结果等。
1.6?监测机构
本研究在全国共设有20家监测机构,其中,上海中医药大学龙华医院和安徽中医药大学第一医院作为牵头负责单位,其余18家为参加单位。
1.7?伦理及临床注册
本监测为观察性研究,对被监测者姓名、性别、家庭住址、联系方式等隐私信息保密。监测所用方案和观察表等研究相关资料已通过中国中医科学院中医临床基础医学研究所伦理委员会批准(伦理号2012No14)。2013年1月30日通过“Clinicaltrial.gov”国际注册并获得注册号(NO.NCT01781676)[10]。
1.8?數据录入
采用网上平台录入系统的方式,采用双人双录入、差异校验的方式,通过中药上市后临床再评价公共服务平台(http://www.crpcm.com/),将监测表数据录入到“悦安欣苦碟子注射液安全性监测数据管理系统”。
1.9?质量控制措施
制定监查及质量控制标准操作规范,采用参加医院一级检查、牵头单位二级监查、高层专家三级稽查的三级监查制度,进行数据质量控制[11]。
1.10?数据标准化
西医诊断疾病分类编码参照国际疾病分类(ICD10)[12],中医病名及辨证参照《中华人民共和国国家标准-中医病证分类与代码》(1995版)[13],药品分类参照《中华人民共和国药典》[14],ADR编码参考WHO?ART术语[15]。
1.11?统计学方法
采用SAS?9.2统计软件编程计算。统计学检验均采用双侧检验(Two-side?Test),P值小于或等于0.05将被认为所检验的差别有统计意义。并利用Excel?2007辅助作图。
2?结果
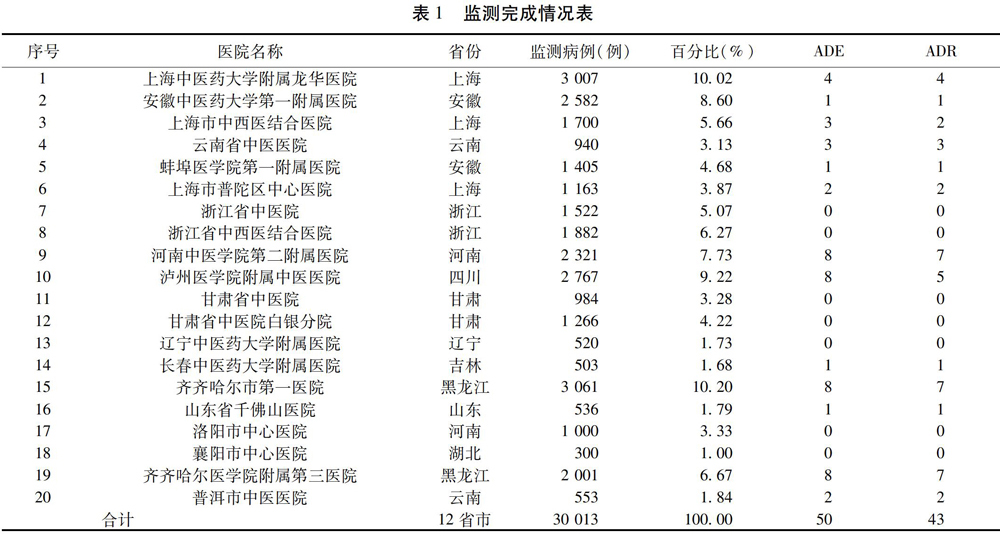
2.1?监测完成情况?首例入组时间为2012年10月5日,末例结束监测为2015年8月18日,时间跨度34个月,在全国20家监测医院,完成监测病例30?013例,发生50例ADR/ADE。根据2011年5月卫生部颁布的《药品不良反应报告和监测管理办法》(卫生部令第81号)[16],采取临床一线医生报告、监测中心药品不良反应/事件监测专家委员会评判、组织国内高层专家判读的不良反应三级判定方法,判定ADR共43例。见表1。
2.2?ADR发生率?ADR发生率为1.43‰(95%CI=1.005‰~1.861‰),根据2005年国际医学科学组织委员会(CIOMS)推荐标准[17],属于偶见不良反应(发生率1‰~1%)。其中一般ADR共42例,以皮肤瘙痒、皮疹、头痛为主;新的ADR1例,表现为结膜出血;无严重ADR。
2.3?ADR累及系统及症状体征?43例ADR中,不良反应表现为皮肤瘙痒、皮疹、头痛、呕吐、胸闷、心悸、头晕、腹痛、腰背痛、发热、视觉异常、结膜出血、腹泻、骨痛、寒战、恶心、潮红、红斑疹、四肢麻木和面部潮红,累及全身8个不同系统损伤。
2.4?ADR患者基本信息
2.4.1?性别年龄分布?43例ADR患者中男16例,女27例,男女比例为1∶1.69。年龄最小42岁,最大者92岁。年龄分布见表3。
2.4.2?过敏史?2例患者有药物过敏史,过敏药物为青霉素、链霉素、左氧氟沙星;其余41例患者无过敏史。
2.4.3?西医诊断?西医诊断最多为脑梗死、其次为冠心病,符合说明书适应证占50%。
2.5?ADR发生特征
2.5.1?ADR出现距用药时间间隔?43例ADR中,发生时间最早为2?min,最晚为96?h后。半小时内发生最多占39.53%。见表5。
2.5.2?ADR的处理与转归?43例ADR中未见严重不良反应,处理以停药与对症治疗为主。有33例停药观察未处理,10例停药并使用处理药品,其中使用非那根4例,葡萄糖酸钙注射液2例,VitC2例,西替利嗪2例,柴胡注射液、氧氟沙星滴眼液、英太青、异丙嗪各1例。转归为痊愈24例,好转19例。
2.5.3?停药或减量后是否减轻?43例ADR中,停药或减量后痊愈或好转的40例,未停药的3例。
2.5.4?再次使用后是否出现ADR?再次使用悦安欣后的结果分为出现ADR、未出现ADR、不明、未再次使用。本监测的43例ADR中,未再次使用的38例,再次使用未出现ADR的2例,不明的3例。
2.6?与ADR相关的药品使用信息
2.6.1?用法用量?43例ADR均为静脉点注给药。用量20?mL的9例,30?mL的3例,40?mL的30例,只有1例为50?mL超出说明书剂量范围。
2.6.2?溶媒及浓度?溶媒为0.9%氯化钠注射液32例占74.42%,5%葡萄糖注射液9例,葡萄糖氯化钾注射液2例。将悦安欣剂量与溶媒剂量比值换算成浓度,取说明书最大剂量与溶媒最小剂量的比值作为正常浓度高限,结果39例为正常浓度,4例为超正常浓度,其中1例超过正常浓度范围2倍以上。
2.6.3?用药天数?43例ADR中,用药1~2?d的24例,3~7?d的17例,8~14?d的2例。
2.6.4?合并用药?43例ADR中,有合并用药的共41例,只有2例无合并用药。41例ADR患者共计35种合并用药,其中合并西药23种,合并中药9种。主要合并用药及分类见表6。
2.6.5?药品批号?43例ADR涉及了30个药品批号。药品批号为140410的有6例占13.95%最多;药品批号为131220的有4例占9.30%;其余批号均只有1~2例发生。
2.6.6?不良反应影响因素分析
2.6.6.1?交叉列联分析
采用影响因素(年龄、过敏史、合并用药、剂量、浓度、溶媒、合并用药)两两交叉列联分析,结果显示年龄段为60以上,特别是年龄>80岁;有过敏史;剂量>40?mL或者浓度>正常范围;溶媒为5%葡萄糖氯化钾注射液的患者容易发生ADR。
2.6.6.2?LASSO法对不良反应影响因素分析
先使用SMOTE抽样方法,再将各个自变量和反应变量(是否出现不良反应)纳入到LASSO模型中,找出影响较大的变量(使用R中的grpreg包),抽样100次,进行强分层主效应分析和交互效应分析。结果显示:年齡分段65~79,高浓度,有过敏史,合并用药泮托拉唑钠注射液、天麻素注射液的时候,发生ADR的可能性大。
3?讨论
药物上市后的安全性研究中,包括大样本的医院集中监测研究,基于国家药品不良反应监测中心SRS数据的ADR信号发现,基于医院信息系统数据的安全性研究、文献分析、个案分析等。其中,大样本、前瞻性的医院集中监测的数据来源于真实世界,能观察到不良反应/事件的发生和发生率,得出结论是药物安全性研究中证据级别最高的[18],也是目前较好的药物安全性研究方法。悦安欣苦碟子注射液临床安全性医院集中监测是一项前瞻性、大规模、多中心、的观察性研究,纳入20个研究中心、30?013例住院患者。研究结果表明,悦安欣苦碟子注射液不良反应发生率为1.43‰,属于偶见不良反应,不良反应多发生在用药当天30?min内,主要表现为皮肤瘙痒、皮疹、头痛、呕吐、胸闷、心悸、头晕、腹痛、腰背痛、发冷、视觉异常、结膜出血、腹泻、骨痛、寒战、恶心、潮红、红斑疹、四肢麻木和面红等;患者有过敏史,浓度较高,有合并用药(合用脑苷肌肽注射液等),可能是ADR的影响因素。尤其当出现“头痛”“头晕”等预警信号时,临床尤应重视,以使用药风险控制到最小,为临床安全用药提供警示。
在不良事件和不良反应的观察方面,本研究可能存在一定的低估的可能性:1)本研究为药师主导的研究,在不良事件/反应的观察方面,可能不如医师直接,可能会出现漏报的情况;2)研究涉及的实验室指标相对较少,且临床实际工作中,对于大多数的患者仅进行了一次实验室检查,有可能会低估实验室检查异常值方面的不良事件/反应。
药品安全性既关系到百姓用药安全,关系到企业生存,关系到中医药产业的发展方向。药品作为维护公众健康的重要工具,药品安全性作为建立基本医疗卫生制度的一项重要内容,一直被视为关系民生的重大问题之一。2007年12月以来,国家相继颁布《关于印发中药注射剂安全性再评价生产工艺评价》等7个技术指导原則等通知,可见重视。悦安欣苦碟子注射液临床安全性评价结论为临床安全用药提供警示,有利于指导临床安全合理用药,使临床用药风险最小化,为药品生产企业制定药品风险控制计划,完善药品说明书中不良反应等安全性内容提供依据;也为药品监管部门相关监管执法、风险防控、审核验收提供依据。
参考文献
[1]刘雪梅,陶冶,王凤丽,等.从“脑心同治”探讨苦碟子注射液对急性脑缺血后心肌血管活性物质的影响[J].北京中医药,2016,35(7):619-624,713.
[2]方丽萍,肖展翅,柯红艳.苦碟子注射液对脑梗死恢复期患者血液流变学的影响研究[J].实用心脑肺血管病杂志,2016,24(3):93-94,97.
[3]张孔雁,曹俊杰,王义围,等.苦碟子注射液联合磷酸肌酸钠治疗老年冠心病心力衰竭患者的临床随机对照研究[J].世界中医药,2018,13(11):2758-2761.
[4]崔瑞昭,谢雁鸣,廖星,等.苦碟子注射液用药安全性的系统评价[J].中国中药杂志,2017,42(12):2380-2390.
[5]常艳鹏,谢雁鸣.基于文献的苦碟子注射液(悦安欣)安全性分析[J].中国中药杂志,2012,37(18):2800-2802.
[6]张兆康,杨薇,刘峘,等.基于倾向性评分的苦碟子注射液对肾功能影响的临床实效研究[J].中国中药杂志,2015,40(13):2661-2667.
[7]徐子琦,谢雁鸣,王连心,等.采用倾向性评分法分析真实世界苦碟子注射液对患者ALT和AST影响[J].中华中医药杂志,2016,31(3):1064-1067.
[8]国家食品药品监督管理局.关于印发中药注射剂安全性再评价生产工艺评价等7个技术指导原则的通知[J].药物不良反应杂志,2010,12(5):341-342.
[9]杨薇,谢雁鸣,王永炎.中医药临床实效研究——中药注射剂注册登记式医院集中监测方案解读[J].中国中药杂志,2012,37(17):2683.
[10]黎元元,李志强,谢雁鸣.基于循证药学的悦安欣苦碟子注射液上市后安全性研究[J].世界中医药,2014,9(9):1120-1124.
[11]姜俊杰,谢雁鸣.中药注射剂医院集中监测质量控制方案的优化[J].中医杂志,2014,55(17):1506-1508.
[12]董景五.疾病和有关健康问题的国际统计分类:第十次修订本[M].北京:人民卫生出版社,2008:62-67.
[13]陈佑邦,潘筱秦,金棣生,等.中医病证分类与代码[M].北京:中国标准出版社,1995:18-22.
[14]国家药典委员会.中华人民共和国药典二部(2010年版)[M].北京:中国医药科技出版,2010:493-495.
[15]世界卫生组织国际药物检测合作中心.WHO药品不良反应术语集[M].北京:中国医药科技出版社,2003:263-268.
[16]《药品不良反应报告和监测管理办法》(卫生部令第81号)[EB/OL].[2011-5-4].http://www.sda.gov.cn/WS01/CL0053/62621.html.
[17]广东省药品不良反应监测中心.药品不良反应知识[J].广东药学,2010,14(1):42-44.
[18]廖星,谢雁鸣,王永炎,等.药品安全性证据分级分类探索研究——构建中药上市后安全性证据体[J].中国中药杂志,2015,40(24):4723-4725.
(2019-12-10收稿?责任编辑:徐颖)
基金项目:国家重点研发计划项目(2018YFC1707400,2018YFC1707410);中央级公益性科研院所基本业务费项目(Z0439)作者简介:黎元元(1976.02—),女,博士,副研究员,研究方向:中药上市后临床安全性评价,Tel:(010)64093205,E-mail:chibjyy@163.com通信作者:谢雁鸣(1959.11—),女,首席研究员,博士研究生导师,研究方向:中医临床评价,E-mail:datamining5288@163.com
- 新财务会计制度对医院会计核算的影响
- 基于财务共享的业财融合模式构建与实施探析
- 创业园区的财务管理运行机制思考
- 财务视角下乐视创新盈利模式有效性研究
- 石油企业资金管理与控制措施探讨
- “一带一路”倡议下中国企业跨文化组织管理研究
- 小微型企业核心骨干员工流失分析
- 独立董事特征与盈余质量信息研究述评
- 企业并购的财务风险识别及并购后的财务整合探讨
- 试析制造企业的成本核算与管控
- 房地产企业成本管控研究
- 关于加强制造业企业资产管理的思考
- 制造企业成本管理研究
- 中国企业海外市场发展现状、问题及对策
- “互联网+”背景下辽宁省公路货站企业发展模式探讨
- 企业社会责任与财务管理变革
- 生产制造业会计核算存在的问题和完善措施
- 论我国国家公园旅游产品的供给与价格
- 制造业财务成本精细化管理对策研究
- 全球化背景下城市文化与时尚经济相关性研究
- 特色小镇在乡村振兴战略中的积极作用
- 新型烟草制品发展状态及预测
- 生物行业类企业内控建设与风险防范
- 东北大豆、玉米临时收储政策改革对期货市场和农民收入的影响:传导机制与实证检验
- 企业化管理的事业单位财务管理问题研究
- immigrating
- immigration
- immigrational
- immigrations
- immigrators
- immigratory
- imminence
- imminent
- imminently
- imminentness
- imminentnesses
- immiscibilities
- immiscibility
- immiscible
- immiscibly
- immobile
- immobilise
- immobilised
- immobiliser
- immobilises
- immobilising
- immobilities
- immobility
- immobilization
- immobilizations
- 没有边际
- 没有达到目的或目标
- 没有达标,不值一提
- 没有过不去的坎
- 没有过不去的山
- 没有过不去的河,没有爬不上的坡
- 没有过不去的火焰山
- 没有近枝,没有远蔓
- 没有这么大的牌子
- 没有这样的事
- 没有进步
- 没有远大的志向
- 没有追不回的脱缰马
- 没有退路,决一死战
- 没有选上
- 没有造成重大损失
- 没有遇见
- 没有遮挡
- 没有遮盖的
- 没有那一出
- 没有那一套
- 没有那一牵(谦)
- 没有那么大的脚,就不穿那么大的鞋
- 没有那胆量
- 没有配偶的人