颜翔鹏 吕艳丽 穆为民 李毅


【摘要】 目的:探討乳腺癌激素受体表达与新辅助化疗(neoadjuvant chemotherapy,NCT)后病理完全缓解(pathologic complete response,pCR)的关系,指导筛选对化疗敏感的个体。方法:选取笔者所在医院2015年1月-2019年9月收治的102例接受NCT的激素受体阳性的乳腺癌患者作为研究对象,使用免疫组化方法检测NCT前乳腺癌患者的ER、PR表达情况,NCT结束后对手术标本采用Miller-Payne病理评价,分析激素受体的表达与pCR关系。结果:ER<50%组的乳腺癌患者pCR率为66.7%,明显高于ER≥50%组的28.7%,差异有统计学意义(字2=8.165,P=0.004)。ER<50%且PR<50%组患者pCR率为69.2%,明显高于其他组,差异有统计学意义(P<0.05)。PR<50%组的乳腺癌患者pCR率为36.6%,PR≥50%组乳腺癌患者pCR率为32.8%,两组比较差异无统计学意义(P>0.05)。结论:激素受体阳性型乳腺癌pCR与ER表达情况有关,与PR表达情况无关。
【关键词】 乳腺癌 激素受体 新辅助化疗 pCR
doi:10.14033/j.cnki.cfmr.2020.23.024 文献标识码 B 文章编号 1674-6805(2020)23-00-03
Relationship between Hormone Receptor Expression in Breast Cancer and Pathologic Complete Response after Neoadjuvant Chemotherapy/YAN Xiangpeng, LYU Yanli, MU Weimin, LI Yi. //Chinese and Foreign Medical Research, 2020, 18(23): -66
[Abstract] Objective: To explore the relationship between hormone receptor expression in breast cancer and pathologic complete response (pCR) after neoadjuvant chemotherapy (NCT), and to guide the screening of individuals sensitive to chemotherapy. Method: A total of 102 patients with hormone receptor positive breast cancer who received NCT in our hospital from January 2015 to September 2019 were selected as the research objects. Immunohistochemical method was used to detect the expression of ER and PR in breast cancer patients before NCT. After the end of NCT, Miller-Payne pathological evaluation was performed on the surgical specimens. The relationship between the expression of hormone receptor and pCR was analyzed. Result: The pCR rate of breast cancer patients in the ER<50% group was 66.7%, which was significantly higher than 28.7% in the ER≥50% group, and the difference was statistically significant (字2=8.165, P=0.004). The pCR rate of patients in the ER<50% and PR<50% group was 69.2%, which was significantly higher than that of other groups, and the difference was statistically significant (P<0.05). The pCR rate of breast cancer patients in the PR<50% group was 36.6%, and the pCR rate of breast cancer patients in the PR≥50% group was 32.8%, and there was no statistically significant difference between the two groups (P>0.05). Conclusion: The pCR of hormone receptor positive breast cancer is related to ER expression and not to PR expression.
[Key words] Breast cancer Hormone receptor Neoadjuvant chemotherapy pCR
First-authors address: Beijing Shunyi District Maternal and Child Health Hospital, Beijing 101300, China
《2018年全球癌症统计数据》显示,2018年全世界约有210万女性乳腺癌新发病例,其发病率位居女性恶性肿瘤首位[1],乳腺癌的防治成为女性肿瘤研究重点。自Fisher提出乳腺癌是全身性疾病的概念开始,乳腺癌的系统治疗越来越被重视,作为乳腺癌家族中主要成员的激素受体阳性型乳腺癌,包括雌激素受体(estrogen receptor,ER)阳性和/或孕激素受体(progesterone receptor,PR)阳性,对内分泌治疗效果较好,但对化療相对不敏感。新辅助化疗(neoadjuvant chemotherapy,NCT)作为一种术前治疗方案,能充分了解肿瘤对化疗药物的敏感性,筛选出对化疗敏感的个体,若能达到病理完全缓解(pathologic complete response,pCR)则预示着患者有更好的预后。激素受体表达情况与pCR的关系尚不明确,因此本研究特探讨了激素受体表达与pCR的关系,对避免无效化疗具有重大意义,现报道如下。
1 资料与方法
1.1 一般资料
收集2015年1月-2019年9月笔者所在医院乳腺外科收治的接受过NCT的原发性激素受体阳性乳腺癌患者102例,均为女性单侧乳腺癌患者,乳房均有临床可评价原发病灶,随访资料齐全;临床分期Ⅱ~Ⅲ期,或临床I期,有降期保乳意愿及适应证者;年龄29~70岁;所有患者的原发病灶在化疗前均经空芯针穿刺活检病理证实为激素受体阳性浸润性非特殊类型乳腺癌。排除标准:(1)不能耐受全麻手术;(2)不适合标准剂量化疗;(3)合并其他恶性肿瘤;(4)Kamofsky评分≤70分;(5)已有远处转移;(6)已行肿瘤相关治疗。年龄≤40岁17例,>40岁且<60岁63例,≥60岁22例,中位年龄50岁。
1.2 免疫组化测定ER、PR表达
石蜡包埋组织常规切成厚度4 μm的薄片,一抗浓度为1∶100,以SP法行免疫组化染色,二抗浓度严格按照试剂盒说明(试剂盒来源北京中杉金桥生物技术有限公司)。抗原修复采用髙压热修复法,每次实验均设阳性对照和阴性对照,以PBS代替一抗作为阴性对照。以已知的阳性片作阳性对照。
1.3 结果判定
免疫组化染色结果由2位病理医师进行双盲法阅片,对结果进行评估。依据《乳腺癌雌、孕激素受体免疫组织化学检测指南》判定ER、PR染色结果:整张切片中≥1%的肿瘤细胞核染色呈现不同程度着色时即为阳性,并计数阳性染色细胞占所有肿瘤细胞的百分比[2]。
1.4 治疗方案
化疗方案均首选含紫杉醇的单周方案(紫杉醇80 mg/m2,每7天1次,21 d 为1周期),对HER-2阳性患者加用曲妥珠单抗(首次4 mg/kg,后2 mg/kg,每7天1次);患者在治疗前、每2个化疗周期后及术前进行MRI检查同时进行疗效评价,若临床评定为疾病进展(PD)或4化疗周期后评价为疾病稳定(SD)则更换方案,对HER-2阴性患者更换为EC(吡柔比星45 mg/m2+环磷酰胺600 mg/m2,每21天1次),对HER-2阳性患者更换为方案含有TH(多西他赛75 mg/m2+曲妥珠单抗6 mg/kg,每21天1次),完成4~8个周期后根据具体情况(患者意愿及化疗后肿瘤大小、肿瘤与乳腺体积比)行全乳切除或保乳手术;对腋窝淋巴穿刺或前哨淋巴结活检有癌转移(包括宏转移、微转移、孤立细胞团)或治疗期间出现进展的患者,新辅助治疗后行腋窝淋巴结清扫;若前哨淋巴结活检未见癌转移且新辅助治疗期间未出现进展则免除腋窝清扫。术后行病理组织学检查及疗效评价。若术前未完成既定化疗周期数术后予以补充,并根据NCCN给予系统治疗。
1.5 疗效评价标准
临床疗效评价:本研究统一采用核磁测量法,依据RECIST1.1标准进行评价。完全缓解(CR):所有靶病灶消失,任何病理性淋巴结(无论是否为目标病灶)的短轴值必须<10 mm;部分缓解(PR):以基线为参照,所有目标病灶最大径的总和至少减小30%;疾病稳定(SD):既达不到缓减标准、也达不到进展标准者;疾病进展(PD):以靶病灶的总和最小值为参照(包括最小值等于临界值的情况),所有目标病灶总和至少增加20%,且增加的绝对值必须大于5 mm(注:出现新的病灶也可认为是进展);其中CR+PR评价为有效,PD+SD为无效[3]。
病理学疗效评价:病理标本常规制作石蜡切片,镜下测量肿瘤最大径线。采用Miller-Payne病理评价系统评价化疗反应。pCR定义为乳腺及腋窝均未见浸润性癌细胞,其余为非pCR[4]。
1.6 观察指标
分析激素受体的表达与pCR的关系。
1.7 统计学处理
本研究数据采用SPSS 18.0统计学软件进行分析和处理,计数资料以率(%)表示,ER、PR的表达水平与临床病理特征、pCR的关系采用Pearson卡方检验Fisher精确概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 ER及PR表达情况
根据ER表达情况分ER<50%组及ER≥50%组,其中ER<50%组15例(14.7%),ER≥50%组87例(85.3%);根据PR表达情况分为PR<50%组及PR≥50%组,其中PR<50%组41例(40.2%),PR≥50%组61例(59.8%)。
2.2 ER表达与pCR的关系
ER<50%组的乳腺癌患者pCR率为66.7%,明显高于ER≥50%组的28.7%,差异有统计学意义(P<0.05),见表1。
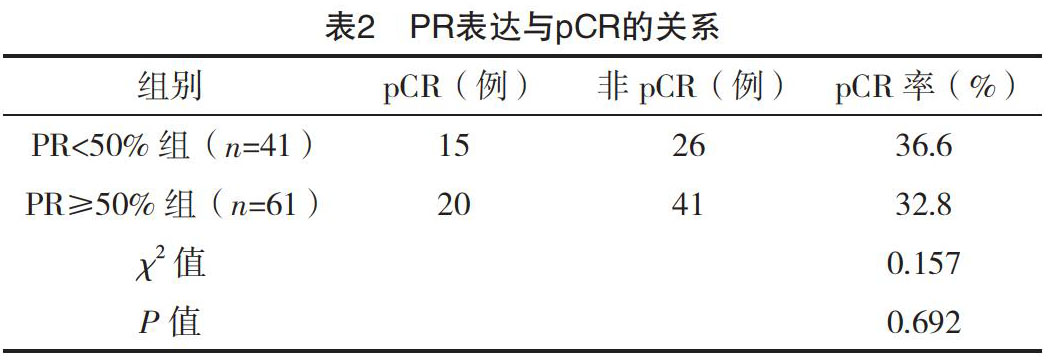
2.3 PR表达与pCR的关系
PR<50%组的乳腺癌患者pCR率为36.6%,PR≥50%组的乳腺癌患者pCR率为32.8%,两组比较差异无统计学意义(P>0.05),见表1。
2.4 ER、PR表达与pCR的关系
ER<50%且PR<50%组的乳腺癌患者pCR率为69.2%;ER<50%、PR≥50%组患者pCR率为50.0%;ER≥50%、PR<50%组患者pCR率为21.4%;ER≥50%且PR≥50%组患者pCR率为32.2%,差异有统计学意义(P<0.05)。ER<50%且PR<50%组患者pCR率为69.2%,明显高于其他组,差异有统计学意义(P<0.05),见表3。
3 讨论
乳腺癌NCT作为全身治疗的一部分,目前应用越来越广,比较一致的观点认为:NCT可降低乳腺癌患者的肿瘤分期,使不可手术转化为可手术,提高患者保乳率,而且可以在NCT结束后依据病理缓解的相关信息评估患者预后。
一些大型的临床研究如NSABP B-18[5]及NSABP B-27[6]显示,NCT达到pCR的患者较未达到pCR的患者无病生存时间及总生存时间显著改善,pCR已逐渐成为临床判断预后的重要指标[5-6]。EORTC 109994/BIG 1-00显示对于不同类型乳腺癌,NCT pCR率不一样,其中三阴型pCR率31%和H型乳腺癌pCR率36%,明显高于Luminal A型的7.5%、Luminal B(HER-2阴性)的15%、Luminal B(HER-2阳性)的22%[7];基于此,目前国际上对于乳腺癌NCT的大型研究,如NOAH研究[8]、NeoALTTO研究[9]针对HER-2阳性型乳腺癌,而GeparSixto研究[10]、CALGB 40603研究[11]针对三阴型乳腺癌,对于激素受体阳性型的研究少见。
激素受体阳性型乳腺癌是所有类型乳腺癌的主要组成部分,目前臨床上对于肿瘤大于2 cm、淋巴结转移、HER-2阳性、组织学分级为3级、Ki-67高表达的激素受体阳性型乳腺癌患者均考虑化疗[12];然而大部分的激素受体阳性型乳腺癌患者对化疗不甚敏感,甚至无效。笔者所在乳腺中心长期观察发现,对于激素受体表达不同的乳腺癌患者,其NCT后pCR不同。本研究显示102例原发性激素受体阳性型乳腺癌患者,经紫杉醇为基础的化疗方案治疗后达到pCR者35例,pCR率为34.3%,明显高于许多其他研究,可能与给药方案、给药周期、精准的临床评价有关;当ER与PR设定为50%时,ER<50%组pCR率显著高于ER≥50%组;联合分析中显示对于ER<50%且PR<50%组患者其pCR率明显高于其他组,这可能是因为乳腺癌激素受体表达影响肿瘤增殖机制,从而影响化疗效果。
综上所述,ER表达情况与激素受体阳性型乳腺癌NCT后pCR相关,ER<50%患者pCR率高;而PR表达情况与pCR无关。本研究属于回顾性研究,对于ER<50%患者的入组患者人数较少,可能因为样本量少导致试验结果偏差,期待大样本、前瞻性、随机和多中心研究进一步明确激素受体表达水平对pCR的影响,以及通过长期随访明确对远期获益的影响。
参考文献
[1] Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[2]杨文涛,步宏.乳腺癌雌、孕激素受体免疫组织化学检测指南[J].中华病理学杂志,2015,44(4):237-239.
[3] Eisenhauer E A,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
[4] Ogston K N,Miller I D,Payne S,et al.A new histological grading system assess response of breast cancers to primary chemotherapy:prognostic significance and survival[J].Breast,2003,12(5):320-327.
[5] Fisher B,Brown A,Mamounas E,et al.Effect of Preoperative Chemotherapy on Local-Regional Disease in Women With Operable Breast Cancer:Findings From National Surgical Adjuvant Breast and Bowel Project B-18[J].Clin Oncol,1997,15(7):2483-2493.
[6] Rastogi P,Anderson S J,Bear H D,et al.Preoperative Chemotherapy:Updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27[J].Clin Oncol,2008,26(5):778.
[7] Bonnefoi H,Litière S,Piccart M,et al.Pathological complete response after neoadjuvant chemotherapy is an independent predictive factor irrespective of simplified breast cancer intrinsic subtypes:a landmark and two-step approach analyses from the EORTC 10994/BIG 1-00 phase Ⅲ trial[J].Ann Oncol,2014,25(6):1128-1136.
[8] Gianni L,Eiermann W,Semiglazov V,et al.Neoadjuvant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH):follow-up of a randomised controlled superiority trial with a parallel HER2-negative cohort[J].Lancet Oncol,2014,15(6):640-647.
[9] De Azambuja E,Holmes A P,Piccart-Gebhart M,et al.Lapatinib with trastuzumab for HER2-positive early breast cancer (NeoALTTO):survival outcomes of a randomised,open-label,multicentre,phase 3 trial and their association with pathological complete response[J].Lancet Oncol,2014,15(10):1137-1146.
[10] von Minckwitz G,Schneeweiss A,Loibl S,et al.Neoadjuvant carboplatin in patients with triple-negative and HER2-positive early breast cancer (GeparSixto;GBG 66):a randomised phase 2 trial[J].Lancet Oncol,2014,15(7):747-756.
[11] Sikov W M,Berry D A,Perou C M,et al.Impact of the addition of carboplatin and/or bevacizumab to neoadjuvant once-per-week paclitaxel followed by dose-dense doxorubicin and cyclophosphamide on pathologic complete response rates in stage Ⅱ to Ⅲ triple-negative breast cancer:CALGB 40603 (Alliance)[J].Clin Oncol,2015,33(1):13-21.
[12]中國抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2019年版)[J].中国癌症杂志,2019,29(8):609-680.
(收稿日期:2020-06-24) (本文编辑:桑茹南)
- 新时代特困人员供养服务设施探析
- 新型社区居家养老服务的影响因素分析
- 可持续发展视角下农村最低生活保障制度问题及对策研究
- 农村公共文化服务供给研究综述
- 新生代农民工返乡创业的制约因素与发展策略
- 乡村振兴进程中农村弱势群体获得感现状测度与提升机制研究
- 旅游与酒店专业酒店顶岗实习的问题与对策研究
- 控股股东股权质押导致的控制权转移风险研究
- 信用卡客户分类与营销策略研究
- 技术创新与装备制造业升级关系的研究综述
- 全面二胎政策实施背景下泸州市房地产市场供给侧改革研究
- 从双因素理论中激励因素的视角看酒店对实习生满意度的提升策略
- 临港石化企业安全评价
- 高职院校贫困生就业竞争力培养模式探索分析
- 生计资本异质视角下农户环境友好型技术采纳行为研究
- 中国传统农业的“地力常新壮”思想探析
- 畜禽养殖粪污还田对土壤和地下水的影响
- 绿色发展理念下中国财税政策应重点倾斜的方向
- 乡村振兴背景下农村金融存在的问题及对策
- 互联网金融对证券业的影响及对策研究
- 中国农村金融存在的问题及对策分析
- 用社会资本投资农业农村以减缓新冠疫情影响
- 农村财务会计管理体制研究
- 农村金融发展存在的问题及其对策
- 外出务工经历对农村家庭金融市场参与的影响研究
- retail cooperative
- retailcooperative
- retaildeposits
- retail deposits
- retail distribution
- retaildistribution
- retailed
- retailer
- retailercooperative
- retailer cooperative
- retailers
- retailing
- retailinvestment
- retail investment
- retail investor
- retailmedia
- retail media
- retailment
- retail outlet
- retail park
- retailpark
- retail price
- retailprice
- retail price index
- retailpriceindex
- 黄带
- 黄帽
- 黄帽子
- 黄帽邮筒
- 黄幄
- 黄干干
- 黄干黑瘦
- 黄序
- 黄庭
- 黄庭初拓
- 黄庭坚
- 黄庭客
- 黄庭换鹅
- 黄庭教
- 黄庭经
- 黄引子
- 黄彝
- 黄彩
- 黄御史集
- 黄心树
- 黄忠
- 黄忠七十不服老
- 黄忠上阵
- 黄忠上阵(八十老翁比干劲)——老当益壮
- 黄忠交朋友——人老心不老