董张雷 王欣 李军 王本福 连庆泉 吴彬彬
[摘要] 目的 通過静脉自身给药方法建立大鼠丙泊酚复吸模型(环境线索诱导),探讨腺苷受体在丙泊酚复吸行为中的作用机制,并探讨其复吸机制。 方法 (1)清洁级雄性SD大鼠24只(14~16周),采用固定比率FR1程序训练大鼠形成稳定的自身给药模型,戒断14 d后重返原来的训练笼进行环境线索诱导的丙泊酚复吸行为测试,测试前15 min分别腹腔注射等量溶剂和腺苷A2AR拮抗剂KW6002(0.3、1.0、3.0 mg/kg),观察其对大鼠丙泊酚复吸行为的影响,并检测大鼠伏隔核内D2R的表达;(2)另取24只大鼠采用FR1程序进行自身给予蔗糖颗粒训练成功后,同样戒断14 d后进行蔗糖复吸行为测试,在测试前15 min同样腹腔注射等量溶剂和KW6002(0.3、1.0、3.0 mg/kg),观察其对大鼠蔗糖复吸行为的影响;(3)准备24只自发活动测试箱,分别放入24只雄性SD大鼠,适应环境1 h后,腹腔注射腺苷A2AR拮抗剂KW6002(0.3、1.0、3.0 mg/kg)和等量溶剂作为对照,15 min后放回箱底,测试并记录大鼠3 h内的自发活动度。 结果 与对照组相比,腺苷A2AR拮抗剂KW6002可以剂量依赖性地增强环境线索诱导的大鼠丙泊酚复吸行为(P<0.01),并增加伏隔核区D2R表达(P<0.01)。与对照组相比,KW6002对大鼠蔗糖觅药行为及自发活动度均无影响(P>0.05)。 结论 腺苷受体参与调节大鼠丙泊酚复吸行为,可能是通过调节伏隔核区多巴胺受体实现。
[关键词] 丙泊酚;复吸;腺苷;自身给药
[中图分类号] R964? ? ? ? ? [文献标识码] A? ? ? ? ? [文章编号] 1673-9701(2020)32-0035-05
[Abstract] Objective By establishing a rat propofol relapse model(induced by environmental cues) through intravenous self-administration, to explore the mechanism of action of adenosine receptors in propofol relapse behavior and its relapse mechanism. Methods (1)24 clean-grade male SD rats(14-16 weeks). The rats were trained to form a stable self-administration model using a fixed ratio FR1 program. After 14 days of withdrawal, they were reintroduced to training-chambers for propofol relapse testing induced by environmental cues. 15 minutes before the test, the same amount of solvent and adenosine A2AR antagonist KW6002(0.3, 1.0, 3.0 mg/kg) were injected into the abdominal cavity respectively, and its effect on propofol relapse behavior of rats was observed, and the expression of D2R in the rat nucleus accumbens was tested; (2)Another 24 rats were successfully trained with self-administration of sucrose pellets by using the FR1 program. After 14 days of withdrawal, they were also given a sucrose relapse behavior test. 15 minutes before the test, the same amount of solvent and KW6002(0.3, 1.0, 3.0 mg/kg) were injected intraperitoneally) to observe its effect on the relapse behavior of sucrose in rats; (3)Prepare 24 spontaneous activity test boxes and put 24 male SD rats into them. After adapting to the environment for 1 hour, intraperitoneally inject adenosine A2AR antagonist KW6002(0.3, 1.0, 3.0 mg/kg) and the same amount of solvent as a control for 15 minutes. Then put it back to the bottom of the box, test and record the rat's spontaneous activity within 3 h. Results Compared with the control group, the adenosine A2AR antagonist KW6002 can enhance the propofol relapse behavior induced by environmental cues in a dose-dependent manner(P<0.01) and increase the expression of D2R in the nucleus accumbens(P<0.01). Compared with the control group, KW6002 had no effect on the sucrose drug-seeking behavior and spontaneous activity of rats(P>0.05). Conclusion Adenosine receptors are involved in the regulation of propofol relapse behavior in rats, which may be achieved by regulating dopamine receptors in the nucleus accumbens.
[Key words] Propofol; Relapse; Adenosine; Self-administration
环境线索诱发的药物渴望和复发行为是药物滥用的主要特征之一,是非常有挑战性的临床问题,也是成瘾药物戒断的主要障碍。研究表明,丙泊酚具有成瘾性,且停药后使用者有再次用药的渴求[1-2]。动物实验同样证明,丙泊酚停药后具有复吸特性[3]。但目前丙泊酚的复吸机制仍未明确,深入研究机制对丙泊酚滥用患者的治疗和戒断具有指导意义。伏隔核(NAc)多巴胺系统是中脑边缘系统重要组成部分,参与众多药物成瘾过程。研究发现,腺苷通过腺苷受体可以调控多种神经递质如多巴胺、谷氨酸和GABA等,在药物的成瘾过程中发挥作用[4-5]。故本研究采用静脉自身给药方式,建立大鼠丙泊酚复吸模型(环境线索诱导),腹腔注射腺苷A2AR,并检测伏隔核内D2R的表达,探讨腺苷受体介导丙泊酚复吸行为的生物学机制,现报道如下。
1 动物与方法
1.1 实验动物
72只雄性SD大鼠,周龄14~16周,体重250~280 g。购买于上海斯莱克实验动物中心。分笼饲养于清洁级动物房内,24 h昼夜节律(9am~9pm),每日食物控制在20 g左右,自由进水。环境温度控制在22~24℃,相对湿度为50%~70%。动物许可证号:SYXK(浙)2010-0150。通过温州医科大学伦理委员会批准,实验过程中遵守《关于善待实验动物的指导性意见》原则(国家科技部2006年颁发)。
1.2 试剂及配置
KW6002(美国sigma)溶于10%DMSO+90%ddH2O。丙泊酚(意大利阿斯利康公司,批号NK317),大鼠自发反应操作笼(购于宁波生物科技研究所),电子天平(购于德国赛多利斯),Western blot电泳仪(购于Bio-Rad)。
1.3 大鼠丙泊酚复吸模型建立
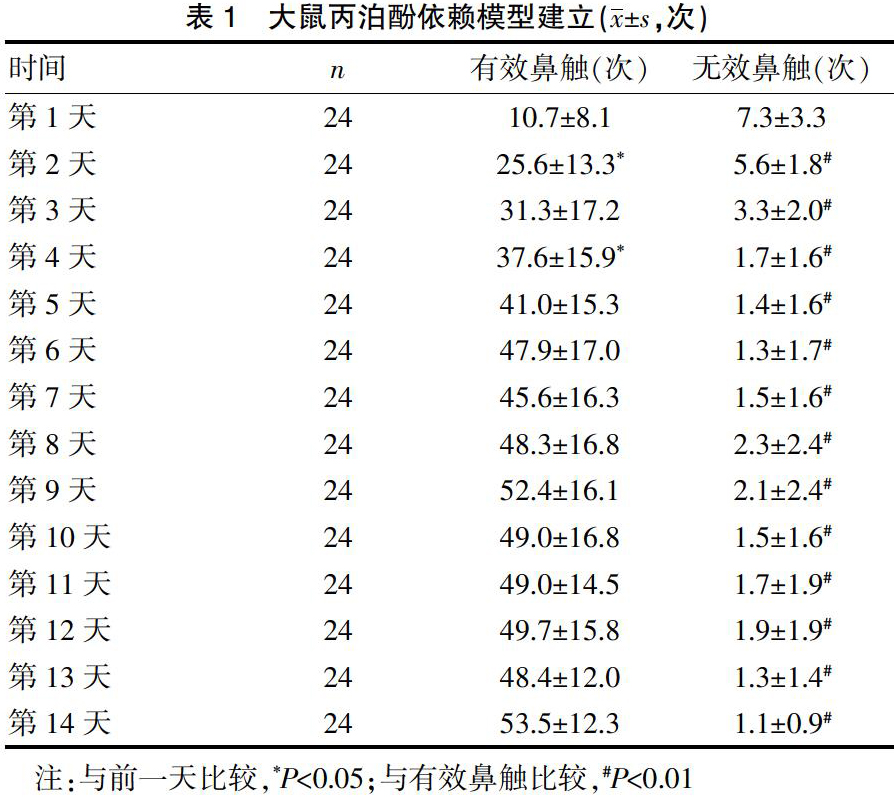
大鼠颈外静脉插管恢复7 d后开始自身给药训练,训练方式如以往研究[2]。用FR1程序,每天训练3 h。大鼠碰触1次有效鼻触得到1次1.7 mg/kg的丙泊酚注射,给药结束后进入30 s不应期:此时大鼠碰触有效鼻触无丙泊酚注射。不应期结束后进入下一个循环,大鼠碰触无效鼻触时无丙泊酚注射,仅记录鼻触反应次数。约14 d建立稳定的自身给药模型,然后进入戒断期。戒断期间大鼠自由饮水,每日控制饮食30 g。戒断期(14 d)结束后,大鼠重新返回原来的训练笼进行复吸行为测试。大鼠丙泊酚复吸训练开始前15 min,分别给予等量溶剂或KW6002,复吸训练期间大鼠碰触有效鼻触1次可获得1次条件性刺激(即有效鼻触探头内小黄灯亮,同时伴随注射泵转动声音),但无丙泊酚注射。有效鼻触次数明显高于无效鼻触次数,表明环境线索诱导的丙泊酚复吸模型建立成功。
1.4 大鼠蔗糖复吸实验
将24只准备好的大鼠随机放入实验训练笼内,同样采用FR1程序,每日训练30 min,连续7 d。同样在大鼠蔗糖觅食行为稳定后戒断14 d,在第15天训练开始前15 min,将大鼠随机分为四组(n=6),分别腹腔注射等量溶剂或KW6002(0.1、0.3、1.0 mg/kg),记录KW6002对大鼠自身给予蔗糖复吸行为的影响。
1.5 Western-blot检测
大鼠丙泊酚复吸行为测试结束后立即将大鼠处死,将分离出的脑组织放入匀浆器内,加入蛋白酶抑制剂和裂解液,充分捣碎。将匀浆液转移至1.5 mL离心管内,超声破碎,离心机离心。制胶,上样,电泳转膜,Western封闭液室温封闭2 h。加用一抗,4℃摇床过夜,二抗常温孵育2 h。内参物为GAPDH。最后暗室曝光,Image J 2.0软件分析结果。
1.6 自发活动检测
分别将24只大鼠随机放入检测箱中,适应环境1 h后,腹腔注射KW6002(0.1、0.3、1.0 mg/kg)或等量对照溶剂,15 min后将大鼠重新放回测试箱,计算机自动测试并记录大鼠3 h内的自发活动度。
1.7 观察指标
(1)大鼠丙泊酚戒断14 d后,与自身给药时比较,有效鼻触次数、无效鼻触次数变化,判断复吸模型是否建立,KW6002给药后大鼠有效鼻触、无效鼻触次数变化及NAc区D2R的表达水平。(2)大鼠蔗糖觅药行为戒断14 d后,有效鼻触次数、无效鼻触次数变化,KW6002给药后对有效鼻触、无效鼻触次数的改变。(3)大鼠自发活动度检测:大鼠3 h内的水平活动距离。
1.8 统计学方法
采用SPSS26.0统计学软件分析数据,Graphpad 8.0软件作图。计量资料以均数±标准差(x±s)表示,重复测量数据采用重复测量方差分析,腹腔注射给药后各组大鼠行为学对比及Western blot检测结果采用单因素方差分析(one-way ANOVA),Levene法检验方差齐性,两两比较采用LSD方法,P<0.05为差异有统计学意义。
2 結果
2.1 大鼠丙泊酚复吸模型建立
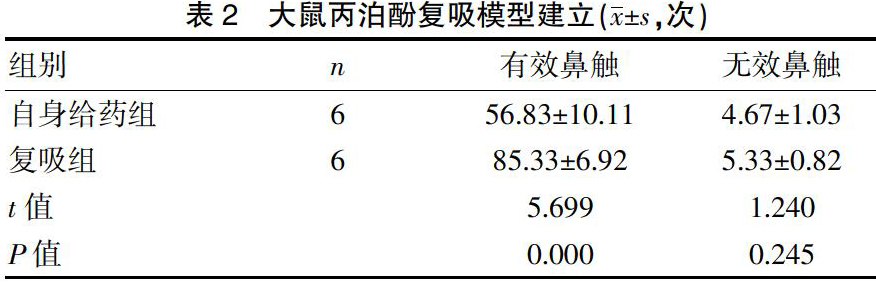
随着训练时间延长,大鼠的有效鼻触次数逐渐增加,并趋于稳定,而无效鼻触次数一直无增加,且明显低于有效鼻触次数,差异有统计学意义(P<0.01),表明大鼠丙泊酚依赖模型建立。戒断14 d后,与丙泊酚自身给药组相比,复吸组大鼠的丙泊酚有效鼻触次数显著增加,差异有统计学意义(P<0.01),而无效鼻触次数无明显改变(P>0.05),环境线索诱导的大鼠丙泊酚复吸模型建立。见表1~2。
2.2 大鼠蔗糖复吸行为模型建立
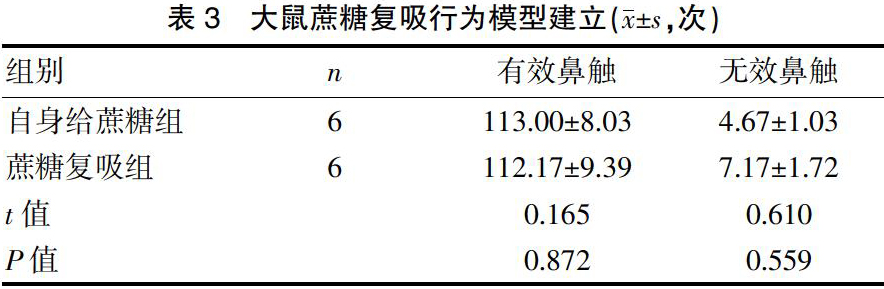
大鼠蔗糖行为训练7 d左右,蔗糖颗粒摄入次数保持在100次左右水平,模型成功建立。戒断14 d后,检测大鼠蔗糖复吸行为即有效鼻触次数保持在较高水平。与蔗糖自身给药组相比,大鼠有效鼻触次数和无效鼻触次数比较,差异均无统计学意义(P>0.05)。见表3。
2.3 腹腔注射KW6002对环境线索诱导的大鼠丙泊酚复吸行为的影响
大鼠复吸行为测试前15 min分别腹腔注射对照溶剂或A2AR拮抗剂KW6002(0.3、1.0、3.0 mg/kg),观察其对大鼠丙泊酚复吸行为的影响。与对照组相比,各组大鼠2 h内的有效鼻触次数明显增加,差异有统计学意义(P<0.01),而无效鼻触次数比较,差异无统计学意义(P>0.05)。见表4。
2.4 Western blot法检测腹腔注射KW6002对NAc内多巴胺D2R表达水平的影响
大鼠丙泊酚复吸行为测试结束后,立即将其处死,Western blot法检测四组大鼠NAc内D2R蛋白表达的变化。与溶剂组比,腹腔注射KW6002(1.0、3.0 mg/kg)后,NAc内多巴胺D2R蛋白表达明显增加,差异有统计学意义(P<0.01)。见表5、图1。
2.5 腹腔注射KW6002对环境线索诱导的大鼠自身给予蔗糖复吸行为的影响
大鼠蔗糖复吸开始前15 min,分别腹腔注射对照溶剂和不同剂量KW6002(0.1、0.3、1.0 mg/kg),与溶剂组比,大鼠蔗糖顆粒摄入数、无效鼻触数、有效鼻触数未见明显改变(P>0.05)。见表6。
2.6 腹腔注射KW6002对大鼠活动度的影响
实验前15 min分别腹腔注射给予KW6002(0.1、0.3、1.0 mg/kg)或对照溶剂。观察KW6002给药对大鼠自发活动度的影响。与对照组相比,KW6002不同剂量组对自发活动度没有影响(P>0.05)。见表7。
3 讨论
研究发现腹腔注射腺苷A2AR拮抗剂KW6002可增强环境线索诱导的大鼠丙泊酚复吸行为,且明显增加大鼠NAc区多巴胺D2R表达,而同剂量的KW6002对大鼠自发活动度和蔗糖复吸行为无明显影响。因此,推测腺苷受体参与介导大鼠丙泊酚复吸行为。
腺苷作为一种内源性嘌呤核苷,根据与腺苷的亲和力不同,分为4个不同的亚型,分别是A1、A2A、A2B和A3受体,在睡眠调节、帕金森病治疗、药物成瘾机制等方面发挥重要作用[6]。研究发现,长期使用吗啡增加大鼠对NAc区的腺苷敏感性,其机制可能是通过抑制腺苷重吸收,通过负反馈作用刺激腺苷释放。而且长期使用吗啡引起纹状体内腺苷转运蛋白表达增加[7-8]。大鼠NAc区的腺苷代谢物水平在阿片类药物戒断期间增加[9]。大鼠腹腔或NAc注射腺苷A2AR阻滞剂DMPX抑制海洛因的摄入[10]。阿片类依赖小鼠敲除A2AR后加重戒断症状[11]。本研究通过腹腔注射KW6002证明其参与大鼠丙泊酚复吸行为,且对大鼠蔗糖复吸行为没有影响,说明其具有特异性。
腺苷主要通过腺苷受体影响脑内神经递质如多巴胺、谷氨酸(Glu)、γ-氨基丁酸(GABA)等的释放,在药物成瘾过程中起调节作用。已知伏隔核多巴胺系统在药物成瘾过程中发挥重要作用。而伏隔核主要通过中型棘突GABA能神经元的直接通路和间接通路兴奋多巴胺受体。其中A2AR大量分布在脑部纹状体区域,该区域主要参与情绪、学习的调节。研究表明,腺苷A2AR可与A1R、D2R、CB1R和mGlu5形成共聚体而相互作用[12-13]。其中以A2AR-D2R共聚体与药物成瘾关系最密切。A2AR-D2R在纹状体苍白球间接通路上形成异二聚体,两者在分子、神经化学和行为学水平上相互拮抗[14-15]。激活NAc内D2R可以通过间接降低GABA。而兴奋A2AR可以恢复D2R引起的腹侧苍白球内的GABA下降。同时A2AR活化可以刺激腺苷酸环化酶,进而激活cAMP-PKA信号通路[16];通过激活D2R可以偶联Gi/o蛋白,从而抑制A2AR介导的cAMP-PKA信号通路[17]。同时,激活A2AR可减弱D2R与多巴胺的结合,进而影响神经元的兴奋性和神经递质的释放[18]。前期研究发现,多巴胺受体、GABA系统均参与大鼠丙泊酚的成瘾过程[2,19-20]。本研究结果显示,腹腔注射KW6002大鼠伏隔核区多巴胺D2R表达增加,从而引起大鼠复吸行为增强。这也符合前期研究结果:腹腔注射D2R减弱环境线索诱导的大鼠丙泊酚复吸行为[21]。根据A2AR-D2R之间相互拮抗的原理,推测阻断A2AR可能激活了D2R介导的信号通路。且本研究结果与前人的研究也一致:腹腔或者NAc内注射腺苷A2AR激动剂CGS21680可减弱大鼠药物环境线索诱导的复吸行为[22-23]。
综上所述,本研究发现腹腔注射KW6002可以增加环境线索诱导的大鼠丙泊酚复吸行为及脑区D2R表达增加,说明腺苷受体参与介导大鼠丙泊酚复吸行为,可能是通过影响伏隔核内多巴胺受体水平起作用。
[参考文献]
[1] Brechmann T,Maier C,Kaisler M,et al. Propofol sedation during gastrointestinal endoscopy arouses euphoria in a large subset of patients[J].United European Gastroenterology Journal,2017,6(4):536-546.
[2] Lian Q,Wang B,Zhou W,et al. Self-administration of propofol is mediated by dopamine D1 receptors in nucleus accumbens in rats[J]. Neuroscience,2013,231(12):373-383.
[3] Wang B,Yang X,Sun A,et al. Extracellular signal-regulated kinase in nucleus accumbens mediates propofol self-administration in rats[J].Neurosci Bull,2016,32(6):531-537.
[4] Seeman P,Tallerico T,Ko F,et al. Amphetamine-sensitized animals show a marked increase in dopamine D2 high receptors occupied by endogenous dopamine,even in the absence of acute challenges[J]. Synapse,2002,46(4):235-239.
[5] Quarta D,Ferré S,Solinas M,et al. Opposite modulatory roles for adenosine A1 and A2A receptors on glutamate and dopamine release in the shell of the nucleus accumbens. Effects of chronic caffeine exposure[J]. Journal of Neurochemistry,2004,88(5):1151-1158.
[6] Ribeiro JA,Sebastiao AM,de Mendonca A. Adenosine receptors in the nervous system: Pathophysiological implications[J]. Prog Neurobiol,2002,68(6):377-392.
[7] Brundege JM,Williams JT. Increase in adenosine sensitivity in the nucleus accumbens following chronic morphine treatment[J]. Journal of Neurophysiology,2002,87(3):1369-1375.
[8] Sandner-Kiesling A,Li Xand Eisenach JC. Morphine-induced spinal release of adenosine is reduced in neuropathic rats[J]. Anesthesiology,2001,95(6):1455-1459.
[9] Salem A,Hope W. Effect of adenosine receptor agonists and antagonists on the expression of opiate withdrawal in rats[J]. Pharmacology Biochemistry and Behavior,1997,57(4):671-679.
[10] Brown RM,Short JL. Adenosine A2A receptors and their role in drug addiction[J]. Journal of Pharmacy and Pharmacology,2008,60(11):1409-1430.
[11] Bailey A,Davis L,Lesscher H,et al. Enhanced morphine withdrawal and μ-opioid receptor G-protein coupling in A2A adenosine receptor knockout mice[J]. Journal of Neurochemistry,2004,88(4):827-834.
[12] Fuxe K,Marcellino D,Borroto-Escuela DO,et al. The changing world of G protein-coupled receptors:From monomers to dimers and receptor mosaics with allosteric receptor-receptor interactions[J]. J Recept Signal Transduct Res,2010,30(5):272-283.
[13] Borroto-Escuela DO,Miguel PDLM,Paul M,et al. Brain dopamine transmission in health and parkinson's disease:Modulation of synaptic transmission and plasticity through volume transmission and dopamine heteroreceptors[J]. Frontiers in Synaptic Neuroscience,2018,10(2):20.
[14] Ferré S,Diamond I,Goldberg SR,et al. Adenosine A2A receptors in ventral striatum,hypothalamus and nociceptive circuitry implications for drug addiction,sleep and pain[J]. Prog Neurobiol,2007,83(5):332-347.
[15] Fuxe K,Marcellino D,Guidolin D,et al. Heterodimers and receptor mosaics of different types of G-protein-coupled receptors[J]. Physiology,2008,23(10):322-332.
[16] Ferré S,Borycz J,Goldberg SR,et al. Role of adenosine in the control of homosynaptic plasticity in striatal excitatory synapses[J]. J Integr Neurosci,2005,4(4):445-464.
[17] Lee KW,Hong JH,Choi IY,et al. Impaired D2 dopamine receptor function in mice lacking type 5 adenylyl cyclase[J].J Neurosci,2002,22(18):7931-7940.
[18] Dasgupta S,Ferre S,Kull B,et al. Adenosine A2A receptors modulate the binding characteristics of dopamine D2 receptors in stably cotransfected fibroblast cells[J]. Eur J Pharmacol,1996,316(2-3):325-331.
[19] Wang B,Lv K,Liu H,et al. Contribution of the α5 GABAA receptor to the discriminative stimulus effects of propofol in rat[J]. Neuroreport,2018,29(5):347-352.
[20] Wu B,Liang Y,Dong Z,et al. Glucocorticoid receptor mediated the propofol self-administration by dopamine D1 receptor in nucleus accumbens[J]. Neuroscience,2016, 328(7):184-193.
[21] Wang S,Wang X,Lin W,et al. Dopamine D1 receptor within basolateral amygdala is involved in propofol relapse behavior induced by cues[J]. Neurochemical Research,2018,43(12):2393-2403.
[22] Bachtell RK,Self DW. Effects of adenosine A(2A) receptor stimulation on cocaine-seeking behavior in rats[J]. Psychopharmacology(Berl),2009,206(3):469-478.
[23] O'Neill CE,Le Tendre ML,Bachtell RK. Adenosine A2A receptors in the nucleus accumbens bi-directionally alter cocaine seeking in rats[J]. Neuropsychopharmacology,2012, 37(5):1245-1256.
(收稿日期:2020-07-20)
- 支架理论指导下农村中学的英语听说教学研究
- 小学英语教学中核心素养的培养策略探析
- 案例教学法在商务英语教学中的应用
- 如何提高学生对课文背诵及运用的能力
- 叶县古城明清街简介英译评析
- 论如何开展初中历史教学中学生问题意识的培养
- 通信专业实验室建设与实验教学改革研究
- 翻转课堂教学法在中职计算机教学中的实践研究
- 《利用全自动录播系统进行校本优质教学课例开发建设的实践研究》研究方案
- 让动漫教育在信息技术的基础上走得更远
- 《确定位置》教学设计
- 优化初中信息技术课堂教学方法的实现途径
- 浅谈一年级学生的写字训练
- 浅析信息技术在高中地理课程改革教学中的应用
- 精彩的课堂评价,让课堂更精彩
- 高中数学在物理现象中的应用研究
- 统计学实验教学改革及其对学生创新能力培养的探索
- 浅谈初中道德与法治教学方法策略研究
- 基于核心素养培养的高中历史教学探究
- 找准教学突破口,提高课堂实效性
- 浅谈小学科学课堂教学有效性探究
- 探究小学美术课堂导入的策略
- 自研教学软件在课程实践化训练的教学研究
- 情境教学在初中物理有效课堂的应用
- 高中教学感悟
- overgreasinesses
- overgreasy
- overgreatly
- overgreatness
- overgreatnesses
- overgreedily
- overgreediness
- overgreedinesses
- overgreedy
- overgreen
- overgrieve
- overgrieved
- overgrieves
- overgrieving
- overgrievous
- overgrievously
- overgrievousness
- overgrievousnesses
- overgross
- overgrossly
- overgrossness
- overgrossnesses
- over-grossness's
- overgrown
- overguilty
- 针毡
- 针气人
- 针水
- 针治
- 针火
- 针灸
- 针灸和药剂
- 针灸和药物
- 针灸治病之术
- 针灸热
- 针灸﹑药物
- 针炙医生
- 针爷
- 针状物
- 针盘
- 针眼
- 针眼里看人——小瞧
- 针眼里瞧人——把人看小了
- 针眼里观景——一孔之见
- 针石
- 针砭
- 针砭时弊
- 针磁
- 针神
- 针穿到哪里,线引到哪里