邓江 黎相照
【摘要】 目的 探讨固定液温度对冰冻切片质量的影响。方法 选取南方医科大学南方医院冰冻新鲜肺组织20例、乳腺组织20例、肠组织20例、甲状腺组织20例和脑组织20例, 每个病例取一块组织, 每块组织连续切片4片, 分成A组、B组、C组、D组, 每组100片。A组采用室温AA固定液中固定1 min;B组采用低温恒冷AA固定液中固定1 min;C组采用低温恒冷AA固定液中固定1 min, 然后热风固定10 s;D组采用低温恒冷固定液中固定15 min;常规苏木精-伊红染色法(HE染色)进行HE切片染色, 观察四组的细胞形态差异、细胞核和胞浆的染色效果。结果 A、C组冰冻切片组织细胞轻微收缩, HE染色均匀, 细胞核染色深藍色, 核浆对比度较好;B组冰冻切片细胞轻微肿胀, 切面易发生裂隙, HE染色不均匀, 细胞核染色灰白灰蓝色, 核浆对比度较差;D组冰冻切片组织细胞局部轻微肿胀, HE染色局部不均匀, 细胞核染色深蓝色或灰蓝色, 核浆对比度较差。A组固定液染色综合评分为(93.99±0.69)分, B组固定液染色综合评分为(85.95±1.16)分, C组固定液染色综合评分为(93.61±0.62)分, D组固定液染色综合评分为(91.85±0.57)分, 四组固定液染色综合评分比较, 差异有统计学意义(P<0.05)。结论 组织冰冻切片经室温AA固定液固定后, 细胞形态自然, HE染色细胞核染色鲜艳, 核浆对比度较好。
【关键词】 组织冰冻切片;AA固定液;室温固定;低温恒冷固定
DOI:10.14163/j.cnki.11-5547/r.2020.22.091
Effect of fixation fluid temperature on the quality of frozen sections? ?DENG Jiang, LI Xiang-zhao. Department of Pathology, Second Peoples Hospital of Longgang District, Shenzhen 518112, China
【Abstract】 Objective? ?To discuss the effect of fixation fluid temperature on the quality of frozen sections. Methods? ?20 cases of frozen fresh lung tissue, 20 cases of breast tissue, 20 cases of intestinal tissue, 20 cases of liver tissue, 20 cases of thyroid tissue and 20 cases of brain tissue in Nanfang Hospital of Southern Medical University were selected. 1 piece of tissue was taken from each case, and each piece of tissue was cut into 4 pieces, which were divided into group A, group B, group C and group D, with 100 pieces in each group. Group A was fixed in room temperature AA fixation fluid for 1 min. Group B was fixed in low temperature and constant cooling AA fixation fluid for 1 min. Group C was fixed in low temperature and constant cold AA fixation fluid for 1 min, followed by hot air fixation for 10 s. Group D was fixed in low temperature and constant cooling fixation fluid for
15 min. Hematoxylin eosin staining (HE staining) was used to observe the cell morphology, nuclear and cytoplasmic staining effect of the four groups. Results? ?In group A and C, the frozen section cells contracted slightly, the HE staining was evenly, the nuclear staining was dark blue, and the contrast of nuclear plasma was good. In group B, the cells in frozen section were slightly swollen, the section was easy to crack, the HE staining was uneven, the nucleus staining was gray and gray blue, and the nucleocytoplasmic contrast was poor. In group D, the frozen section tissue cells were slightly swollen, the HE staining was uneven, and the nuclear staining was dark blue or gray blue, and the nucleocytoplasmic contrast was poor. The comprehensive score of fixation fluid staining of group A was (93.99±0.69) points, which was (85.95±1.16) points in group B, (93.61±0.62) points in group C and (91.85±0.57) points in group D. There was statistically significant difference in comprehensive score of fixation fluid staining among the four groups (P<0.05). Conclusion? ?After frozen tissue sections are fixed with room temperature AA fixation fluid, the morphology of the cells is natural, the nucleus stain with HE is stained brightly, and the nucleocytoplasmic contrast is good.
【Key words】 Frozen tissue sections; AA fixation fluid; Room temperature fixation; Low temperature and constant cooling fixation
冰冻切片是借助低温恒冷条件使组织迅速冻结达到一定硬度进行切片的一种方法, 具有快速、方便的特点, 而大范围用于临床手术中的快速病理诊断, 因此做出高质量的冰冻切片是手术中确诊病变性质、决定手术范围的最重要的环节。一张好的冰冻HE切片主要取决于切片、固定和染色, 这三方面环环相扣, 相互影响。其中由于组织固定因素影响组织细胞形态的改变, 染色效果不良, 对结果的诊断影响最大, 远比其他操作因素引起的组织细胞形态改变更难把握[1]。因此, 本实验为提高冰冻切片染色效果, 选择室温AA固定液和低温恒冷AA固定液分别对组织冰冻切片快速固定, 经HE染色后观察其染色效果。
1 材料与方法
1. 1 材料 选取南方医科大学南方医院2019年4~9月的冰冻新鲜肺组织20例、乳腺组织20例、肠组织20例、甲状腺组织20例和脑组织20例。每例组织连续切片4片, 分为A、B、C、D组, 每组100片。
1. 2 设备 冷冻切片机, 冰冻自动HE染色机。
1. 3 主要试剂 OCT冷冻包埋剂, AA液(由95%乙醇A∶乙酸A=99.75%∶0.25%组成), 新鲜Harris苏木素染液, 0.3%盐酸乙醇溶液, 0.5%氨水溶液, 0.5%水溶伊红, 75%乙醇, 85%乙醇, 95%乙醇, 无水乙醇, 二甲苯, 中性树胶。
1. 4 取材及切片制作
1. 4. 1 新鲜送检组织取材大小约为1.5 cm×1.5 cm×0.3 cm, 每个病例取一块组织, 每块组织连续切片4张, 分成4组, 每组100张, 切片厚度3~4 μm。
1. 4. 2 HE切片的制作 A组粘片后立即放入室温(20~26 ℃)AA固定液中固定1 min;B组粘片后立即放入低温恒冷AA固定液中固定1 min;C组粘片后立即放入低温恒冷AA固定液中固定1 min, 然后吹风筒低档热风加热固定10 s;D组粘片后立即放入低温恒冷AA固定液中固定15 min;固定后统一置于全自动染色机内进行HE染色。染色步骤如下:新鲜苏木素染液染色3 min, 自来水漂洗5 s, 0.3%盐酸乙醇溶液分化1 s, 自来水漂洗5 s, 0.5%氨水溶液蓝化5 s, 自来水漂洗5 s, 0.5%水溶伊红染色10 s, 自来水漂洗5 s, 75%乙醇脱水5 s, 85%乙醇脱水5 s, 95%乙醇脱水5 s, 无水乙醇Ⅰ脱水10 s, 无水乙醇Ⅱ脱水10 s, 二甲苯Ⅰ透明5 s, 二甲苯Ⅱ透明5 s, 中性树胶封片。
1. 5 染色效果及判定标准 观察各组切片染色后组织细胞形态;HE染色的均匀性、细胞核着色和核浆对比清晰度。染色效果在显微镜下依照《病理切片质量基本标准》[2]中“组织切片制备的基本要求”进行判定, 由两名高年资医师对四组冰冻切片进行观察, 各自给出判定结果, 若结果不一致邀请专家阅片或细化实验, 经协商后确定最终结果, 采用双盲打分。细胞核着色灰淡或过蓝, 减5分;红(细胞质)与蓝(细胞核)对比不清晰, 减5分。
1. 6 统计学方法 采用SPSS22.0统计学软件进行数据统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验, 组间评分比较采用One-Way ANOVA检验。P<0.05表示差异具有统计学意义。
2 结果
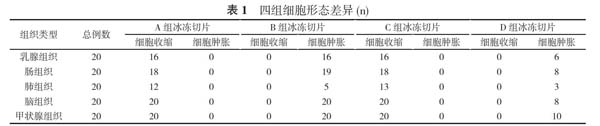
2. 1 组织细胞形态 A和C组细胞轻微收缩;B组细胞轻微肿胀, 切面易发生裂隙现象; D组局部组织细胞轻微肿胀;低温恒冷固定后的组织细胞形态有差异, 组织细胞形態改变以甲状腺组织最明显, 不同固定方式导致的组织细胞形态差异。见表1。
2. 2 组织细胞染色效果 A、C组切片染色均匀, 细胞核染色深蓝色, 细胞浆染色鲜艳, 核浆对比度较好, 综合评分分别为(93.99±0.69)分和(93.61±0.62)分, HE染色见图1和图3;B组切片染色不均匀, 细胞核染色灰蓝灰白色, 细胞浆染色较淡, 核浆对比度较差, 综合评分为(85.95±1.16)分, HE染色见图2。D组切片染色局部少许不均匀, 细胞核染色深蓝色或灰蓝色, 细胞浆染色局部较淡, 核浆对比度一般, 综合评分为(91.85±0.57)分, HE染见图4。A、B、C、D组组间固定液染色评分比较差异有统计学意义(P<0.05);经室温固定的冰冻切片HE染色结果综合评分更高, 染色效果最佳。
3 讨论
组织切片经过固定液能将蛋白质、酶、糖等沉淀或凝固成不溶性物质[3], 保持组织细胞与正常生活时的形态相似。在AA固定液中, 乙醇能迅速沉淀球蛋白和核蛋白。醋酸能沉淀核蛋白, 穿透力强, 且醋酸能使染色体的保存如同生活时一样, 并能将未分裂的细胞核染色质沉淀成为可以染色的块状体, 故细胞核染色显得清楚;同时, 醋酸有使组织膨胀的作用[4], 可以抵消乙醇所引起的组织收缩, 能较好的保持组织学形态。
在冰冻切片制片过程中, 规定20~25 min内完成制片[5], 所以固定方法非常重要。常见固定方法有室温固定和低温恒冷固定。冰冻切片在室温(20~26 ℃)环境下固定, 由于温度远高于低温恒冷切片机内, 固定液分子扩散较快, 在有限的时间内组织细胞成分固定充分, HE染色均匀, 细胞核染色深蓝色, 核浆对比度较好。冰冻切片于低温恒冷切片机内固定, 因冷冻切片机室内平均温度-20 ℃, 低温环境下分子扩散速度慢, 在有限的时间内组织细胞成分固定不充分, 导致细胞肿胀明显, HE染色不均匀, 细胞核染色灰蓝色, 核浆对比度较差。在低温恒冷条件下固定液内固定1 min后再用热风加速固定10 s, 染色效果明显改善。在低温恒冷条件下延长固定液的固定时间染色效果虽有改善, 但局部仍然欠佳, 染色效果仍不理想, 而且固定太耗时间。通过实验得出, 固定液温度对冰冻切片染色质量有影响;室温固定冰冻切片染色效果最佳;如果固定液温度低于切片温度, 冰冻切片置入低温恒冷固定液内固定易触发微冰晶效应, 引起的组织细胞内液体的肿胀, 导致核发生肿胀或核空泡, 核染色差。低温固定效应在体液丰富的组织切片中最突出, 本次实验中甲状腺组织的冰冻切片最为明显;同一切面病变组织较正常组织明显。
在实验过程中还发现, 各种人为操作也可以导致染色不均匀, 例如冷冻包埋速度过慢产生的冰晶[6, 7], 切片时用力不均匀或切片时跳刀[8], 切片后置于空气中时间过长, 还有冰冻组织因诊断需要重复切片而反复冷冻, 都可发生染色不均匀现象。但只要工作认真负责是可以避免这些人为因素的发生, 目前冰冻固定液种类繁多, 其他固定液是否发生低温固定效应还需进一步摸索。
综上所述, 采用室温AA固定液固定冰冻切片是一种较为满意和实用的固定方式, 组织形态自然, 细胞核着色更蓝, 核浆对比度好, 色彩更鲜艳。
参考文献
[1] 高美钦, 黄雄飞, 肖志芸, 等. 不同固定液对冷冻切片HE染色影响的比. 福建医科大学学报, 2001, 35(4):367.
[2] 黄柳明. 病理切片质量基本标准—组织切面完整的分析与启示. 中国当代医药, 2009, 16(14):197-200.
[3] 龚志锦, 詹容洲. 病理组织制片和染色技术. 上海:科学技术出版社, 1994:3.
[4] 董芸蓉. 不同固定液对甲状腺冷冻切片固定效果的比较. 临床与实验病理学杂志, 2016, 32(6):710-711.
[5] 杨霞. 常用冰冻固定液对冰冻制片效果的差异分析. 养生保健指南, 2018(7):238.
[6] 包翠芬, 刘霞, 穆长征, 等. 冰冻切片几种防冰晶方法的比较. 中国误诊学杂志, 2006, 6(17):3310-3311.
[7] 连爱琼. 快速冰冻切片技术在病理诊断中的应用分析. 医学理论与实践, 2016, 29(16):2251-2252.
[8] 凌启波, 梁英杰. HE制片质控要求. 临床与实验病理学杂志, 2000, 16(4):333-334.
[收稿日期:2020-02-21]
- 对规模养殖场粪污治理的对策及建议
- 羊链球菌病的鉴别与预防措施
- 无公害苹果种植技术及病虫害防治
- 保育猪伪狂犬病的防控
- 玉米栽培技术的推广及运用分析
- 仔猪腹泻的管理
- 大豆种植及病虫害防治技术初探
- 浅谈畜牧兽医动物防疫工作的重点和不足
- 试析农业技术在高产蔬菜种植中的应用
- 猪大肠杆菌病防治措施
- 探讨基层畜牧养殖管理存在问题与解决方法
- 果树种植病虫害防治策略探讨
- 探讨基层兽医在畜禽疾病防治中的重点
- 关于辣椒嫁接抗疫病效果的研究
- 浅谈中小规模猪场的疾病防控措施
- ‘野香优676’作中稻优质高产栽培技术分析
- 猪传染性胃肠炎的诊治
- 一例猪繁殖与呼吸综合征的诊断与防制
- 常见蔬菜水果农药残留检测技术概述
- “水肥一体化”技术在马铃薯栽培中的应用
- 羊常见疾病的症状及防治措施
- 论村级动物防疫员在陕西省四级动物防疫体系建设中的作用
- 油茶苗木培育技术及病虫害防治
- 畜牧兽医工作者的自身防护措施探析
- 探讨生态猪养殖技术及发展趋势
- aspiration
- aspirational brand
- aspirationalbrand
- aspirationally
- aspirations
- aspire
- aspire-after
- aspired
- aspirer
- aspirers
- aspires
- aspire to
- aspire-to
- aspirin
- aspiring
- aspiringly
- aspiringness
- aspirin's
- aspirins
- aspish
- asps
- asp's
- as-regards
- as-rule
- ass
- 固执倔强的脾气
- 固执刚直
- 固执地坚持自己的操守不变
- 固执坚持而不改变的节操
- 固执守旧﹑目光短浅的儒生
- 固执守旧,不灵活
- 固执己见
- 固执己见,不知变通
- 固执己见,嘴硬
- 固执己见,拒不接受意见或新事物
- 固执己见,死守旧有的东西不做改变
- 固执己见,自以为是
- 固执己见,自以为是,想怎么干就怎么干
- 固执己见,顽固不化
- 固执所见
- 固执拘泥
- 固执的信念
- 固执而不知变通地遵守
- 固执顽强,一点也不听别人的意见
- 固执,不知变通
- 固执,任性
- 固投
- 固持
- 固有
- 固有名词