白雪 杨冰心 赵婉君 山峰 王春朋
[摘要] 目的 探討艾司洛尔对脓毒症大鼠的心肌保护作用及对Toll样受体4(TLR4)/髓样分化蛋白88(Myd88)/核因子-κB(NF-κB)蛋白通路的调控。方法 选取雄性SD大鼠60只,采用随机数字法随机分为假手术组(Sham组)、脓毒症组(Model组)、艾司洛尔组(ES组),每组20只。Sham组实施盲肠探查术,Model组、ES组采用盲肠结扎穿孔术(CLP法)建立脓毒症模型;ES组持续微量泵入艾司洛尔稀释液1 mL/h(15 mg·kg-1·h-1),共6 h,Sham组和Model组泵入等量生理盐水。各组均于术后24 h检测血清中肌钙蛋白I(TnI)、肿瘤坏死因子α(TNF-α)、白细胞介素-1(IL-1)的表达,取左心室游离壁行苏木精-伊红染色观察心肌病理学变化,采用Western blot法检测心肌组织TLR4、Myd88及NF-κB的表达。结果 与Sham组相比,Model组心肌病理损伤明显加重,心肌损伤指标TnI水平和炎症递质TNF-α及IL-1水平明显升高;与Model组相比,ES组心肌损伤明显减轻,炎症递质水平明显降低,差异均有显著性(F=18.84~602.11,P<0.05)。Western blot检测显示,Model组心肌组织中TLR4、Myd88及NF-κB蛋白表达水平较Sham组明显升高,而ES组心肌组织中三者表达较Model组明显降低,差异均有显著性(F=17.15~95.92,P<0.05)。结论 艾司洛尔能够减轻炎症反应和心肌损伤,其作用机制可能与抑制TLR4/Myd88/NF-κB信号通路的激活有关。
[关键词] 脓毒症;肾上腺素能β受体拮抗剂;Toll样受体4;髓样分化因子88;NF-κB;大鼠
[中图分类号] R631;R971.93[文献标志码] A[文章编号] 2096-5532(2021)01-0120-05
[ABSTRACT]ObjectiveTo investigate the myocardial protective effect of esmolol in septic rats and its regulation of the Toll-like receptor 4 (TLR4)/myeloid differentiation factor 88 (Myd88)/nuclear factor-kappa B (NF-κB) pathway. MethodsSixty male SD rats were selected and randomly divided into sham-operation group (sham group), sepsis group (model group), and esmolol group (ES group), with 20 rats in each group. The sham group underwent cecum exploration, and the model group and ES group underwent cecal ligation and puncture to establish a model of sepsis. The ES group received continuous micropumping of diluted esmolol solution at 1 mL/h (15 mg·kg-1·h-1) for 6 h, while the sham group and model group received micropumping of an equal volume of normal saline. At 24 hours after operation, each group was tested for the expression of troponin I (TnI), tumor necrosis factor α (TNF-α), and interleukin-1 (IL-1) in serum; the left ventricular free wall was taken for hematoxylin and eosin staining to observe the pathological changes in the myocardium; Western blot was used to determine the expression of TLR4, Myd88, and NF-κB in the myocardial tissue. ResultsCompared with sham group, the model group had significantly more severe pathological myocardial injury, with significantly increased myocardial injury index TnI and inflammatory mediators TNF-α and IL-1. Compared with the model group, the ES group had significantly reduced myocardial injury and inflammatory mediators (F=18.84-602.11,P<0.05). Western blot showed that the protein expression levels of TLR4, Myd88, and NF-κB in the model group was significantly higher than those in the sham group, while the above indices were significantly lower in the ES group than in the model group (F=17.15-95.92,P<0.05). ConclusionEsmolol can reduce inflammatory response and myocardial injury, the mechanism of which may be associated with inhibiting activation of the TLR4/Myd88/NF-κB signaling pathway.
[KEY WORDS]sepsis; adrenergic beta-antagonists; Toll-like receptor 4; myeloid differentiation factor 88; NF-kappa B; rats
脓毒症是指机体对感染的反应失调导致的危及生命的器官功能障碍[1]。虽经多年努力,其病死率仍居高不下,最新的流行病学调查显示,脓毒症病人的病死率高达64%[2],继续寻找有效的治疗药物对降低病死率至关重要。脓毒症发病机制极其复杂,其中包括交感神经过度激活,体内儿茶酚胺大量释放,心脏是儿茶酚胺超载的主要靶器官[3],也是脓毒症发展过程中最常见的受损靶器官,肾上腺素能系统的激活可能是发生脓毒症心功能障碍的重要机制之一。因此,有研究人员试图应用β1肾上腺素受体阻滞剂拮抗肾上腺素能系统的过度激活。近年来的研究证实,β1受体阻滞剂在拮抗交感神经活性[4]、抑制炎症反应[5]、减轻高分解状态[6]、改善脓毒症病人预后[7]等方面具有显著效果,另外,β1受体阻滞剂在心肌保护方面可发挥独特作用,对于脓毒症病人具有良好的临床应用前景。β肾上腺素受体已被证实表达于外周血单个核细胞,而外周血单个核细胞上存在的Toll样受体(TLRs)炎症通路。TLRs是一种跨膜蛋白,它能够识别病原微生物相关分子模式(PAMPs),例如革兰阴性菌脂多糖(LPS),LPS与脂多糖结合蛋白(LBP)结合形成复合物,LPS/LBP复合物随即被单核细胞表面的CD14所识别并结合,然后进一步与TLR4相结合,通过髓样分化蛋白88(Myd88)依赖性信号传导通路启动细胞内信号传导,导致转录因子核因子-κB(NF-κB)的激活和易位,释放多种炎症因子。艾司洛尔作为一种高选择性β1受体阻滞剂,具有起效快、作用时间短的特点,且通过红细胞代谢,不受肝、肾功能的影响,尤其适用于危重病人。前期已有研究证实艾司洛尔可减轻心肌损伤,但其具体机制尚不清楚。因此,本实验从TLR4/Myd88/NF-κB信号通路角度,探讨艾司洛尔在脓毒症心肌保护中的作用机制,以期为脓毒症心肌损伤的治疗提供理论和实验基础。
1 材料與方法
1.1 实验动物
取雄性清洁级SD大鼠60只,体质量为330~360 g,由青岛大学动物实验中心提供,于室温18~28 ℃、相对湿度40%~60%、12 h昼夜循环的环境中适应性喂养1周。
1.2 主要药物、试剂与仪器
盐酸艾司洛尔注射液(山东齐鲁制药有限公司);肌钙蛋白I(TnI)、肿瘤坏死因子α(TNF-α)、白细胞介素-1(IL-1)试剂盒(北京索莱宝科技有限公司),TLR4抗体(北京索莱宝科技有限公司产品),Myd88抗体(英国Abcam公司),NF-κΒ p65抗体(Cell Signaling Technology公司),β-actin多克隆抗体(Elabscience公司),山羊抗兔IgG(Elabscience公司);酶标仪(美国Thermo Fisher,MK3),显影仪(法国Vilber Fusion,FX5),双目光学显微镜(日本Olympus,BX53)。
1.3 动物分组与处理
采用随机数字法将大鼠分为假手术组(Sham组)、脓毒症组(Model组)和艾司洛尔组(ES组),每组20只。所有大鼠术前12 h禁食,可自由饮水。Model组和ES组依照文献方法行盲肠结扎穿孔术(CLP法)制备脓毒症动物模型[8]:大鼠以100 g/L水合氯醛(5 mL/kg)腹腔注射麻醉,固定后沿腹前正中线切开皮肤约2 cm,沿腹白线切开,打开腹腔,探查并找到盲肠,用3-0丝线结扎盲肠远端,同时保持肠道通畅,用18号针头做两处穿刺,轻轻挤压盲肠将两滴肠内容物挤至腹腔,还纳盲肠,逐层缝合腹壁切口。Sham组探查盲肠后立即还纳关腹,不行盲肠结扎穿孔。造模成功后各组均行右侧股静脉穿刺术,ES组持续微量泵入艾司洛尔稀释液1 mL/h(15 mg·kg-1·h-1),共计6 h;Sham组、Model组持续泵入等量生理盐水。各组术后1 h内均经股静脉给予30 mL/kg生理盐水模拟液体复苏。本实验中动物处置方法符合动物伦理学标准。
1.4 检测指标
1.4.1 大鼠存活率 由3名研究人员在不知分组情况下观察所有大鼠一般状态,实验大鼠出现精神萎靡、毛发竖立、眼鼻出血、腹泻等症状,则提示脓毒症造模成功。同时,计算各组大鼠的存活率。
1.4.2 血清TnI、TNF-α和IL-1测定 所有存活大鼠均于造模后24 h再次麻醉,腹主动脉取血2 mL,静置30 min后,以3 000 r/min离心15 min,分离上清,按照试剂盒说明书,采用干式免疫荧光定量法测定TnI浓度,采用酶联免疫吸附试验方法分别测定TNF-α、IL-1浓度。
1.4.3 心肌组织病理学观察 术后24 h麻醉处死大鼠,分离大鼠心脏,取左心室游离壁,以4 ℃生理盐水洗净血污,用40 g/L多聚甲醛固定72 h以上,流水洗净甲醛,梯度脱水,二甲苯透明,石蜡包埋,5 μm厚连续切片,经摊片、烤片后进行苏木精-伊红染色,封片后在光学显微镜下观察心肌组织学变化。从心肌变性坏死、出血、间质水肿和中性粒细胞浸润等方面观察心肌病变分布情况,并采用半定量评分系统进行评分[9],组织病理评分为0~4分,分别代表病变受累率0、25%、50%、75%和100%。由3名高年资病理科医师在不知分组情况下同时进行组织病理学检查并给出分数,取平均值。
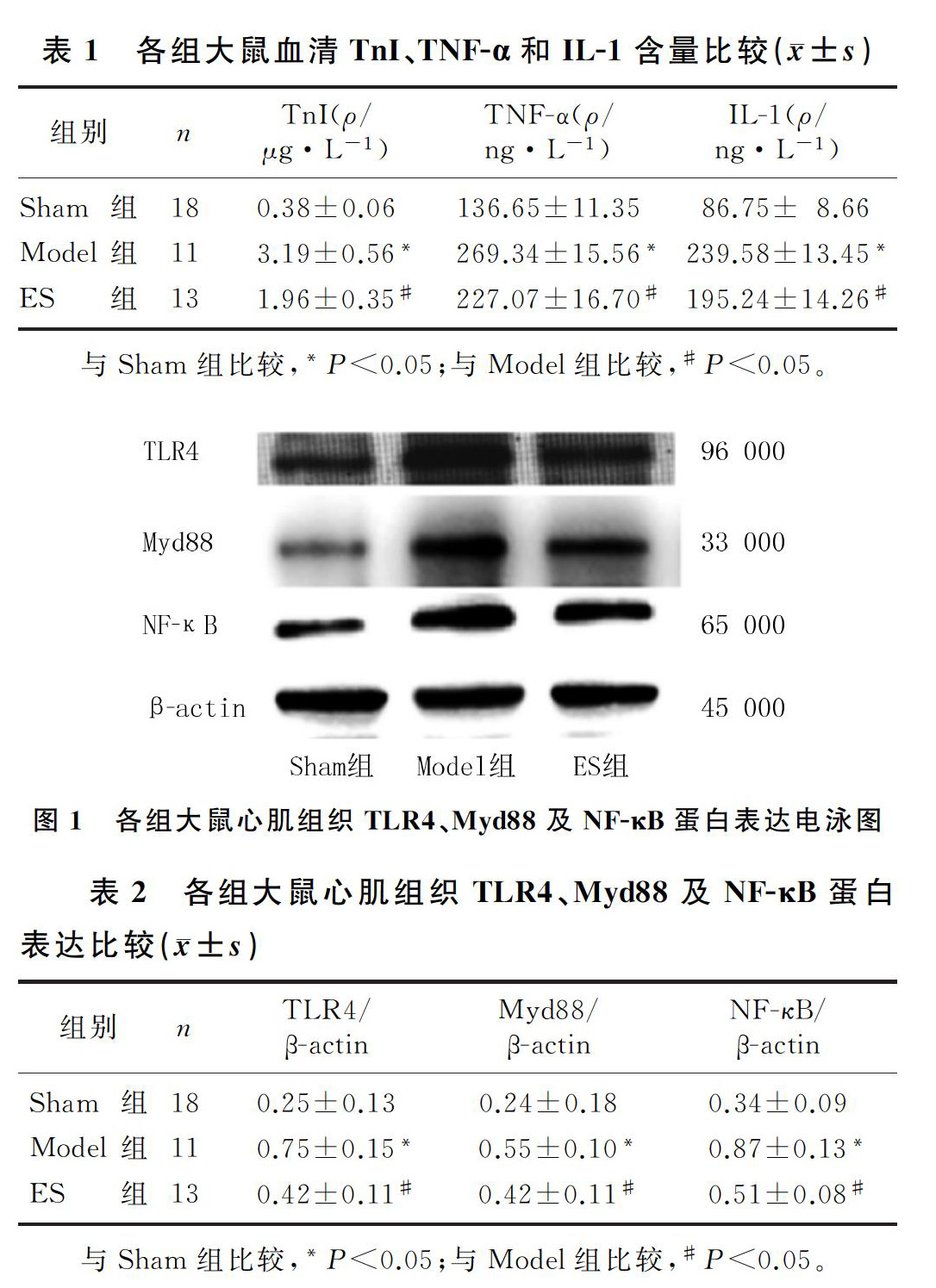
1.4.4 Western blot检测心肌组织TLR4、Myd88和NF-κB蛋白表达 用电子天平称取100 mg心肌组织,组织剪剪碎后,按每20 mg组织加入200 μg组织细胞裂解液,用玻璃匀浆器匀浆,裂解后的样品以12 000 r/min离心10 min,取上清液,用BCA法检测蛋白浓度。配制100 g/L的SDS-PAGE分离胶及50 g/L的浓缩胶,经过上样、蛋白电泳、转膜、封闭后,分别加入TLR4(1∶1 000)、Myd88(1∶1 000)及NF-κB(1∶1 000)抗体稀释液,4 ℃孵育过夜,洗膜后加入二抗(1∶5 000)稀释液,于室温下孵育2 h,洗膜后加入超敏ECL发光液进行显影,采用Image J软件分析各条带光密度值。
1.5 统计学方法
采用SPSS 22.0软件对结果进行统计学分析。计量资料以±s表示,多组比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD检验;计数资料以百分比表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠存活率的比较
术后24 h,Sham组大鼠死亡2只,存活率为90.0%;Model组死亡9只,存活率为55.0%;ES组死亡7只,存活率为65.0%。Model组大鼠存活率较Sham组显著降低(χ2=6.14,P<0.05),而ES组与Model组存活率比较差异无显著性(χ2=0.42,P>0.05)。盲肠结扎穿孔术后,Model组、ES组大鼠均出现精神萎靡、毛发竖立、眼鼻出血、腹泻等脓毒症症状,而Sham组大鼠未出现上述症状。
2.2 各组大鼠心肌组织病理学变化
光镜下Sham组心肌细胞结构正常,纤维肌丝束排列紧密,未见明显水肿、充血、变性以及坏死等;Model组可见心肌细胞大量坏死,呈空泡样变性,心肌纤维明显水肿,排列疏松,部分心肌纤维断裂,细胞核肿胀,间质水肿、炎性细胞浸润;ES组与Model组相比心肌细胞坏死减少,心肌纤维排列欠规整,间质无明显水肿,仍有少量炎性细胞浸润。心肌组织病理评分Model组(2.45±0.69)>ES组(1.77±0.73)>Sham组(0.83±0.71),差异具有显著意义(F=18.84,P<0.05)。
2.3 各组大鼠血清TnI含量的比较
Model组大鼠血清TnI含量较Sham组明显升高,ES组大鼠血清TnI含量较Model组明显降低,差异有统计学意义(F=231.82,P<0.05)。见表1。
2.4 各组大鼠血清TNF-α、IL-1含量的比较
Model组大鼠血清TNF-α、IL-1含量较Sham组明显升高,ES组大鼠血清TNF-α以及IL-1含量较Model组明显降低,差异有显著性(F=335.21、602.11,P<0.05)。见表1。
2.5 各组大鼠心肌组织TLR4、Myd88及NF-κB蛋白表达的比较
Model组大鼠心肌组织中TLR4、Myd88以及NF-κB蛋白表达较Sham组明显升高,而ES组大鼠心肌组织中TLR4、Myd88及NF-κB蛋白表达较Model组明显降低,差异有统计学意义(F=17.15~95.92,P<0.05)。表明艾司洛尔可抑制脓毒症大鼠心肌组织中TLR4、Myd88及NF-κB蛋白的表达。见图1、表2。
3 讨论
脓毒症是重症医学领域的常见病、多发病,已成为沉重的公共卫生负担。心肌损伤是脓毒症导致的常见的器官功能障碍之一,其发病机制复杂,涉及全身炎症网络系统激活、免疫功能障碍、冠状动脉低灌注或不均匀灌注、氧化应激、Ca2+超载、线粒体功能 障碍等[10-12]。虽然许多病理生理机制被提出,但每种机制的全部影响尚未阐明。目前临床上通过测量生物标志物(心肌肌钙蛋白、脑钠肽)和使用超声心动图,可以很容易地识别脓毒症病人的心脏功能障碍。然而,尚无针对脓毒症心肌抑制的特异性治疗方法。当前治疗常通过液体复苏、血管活性药物的支持确保足够的心室充盈,优化血流动力学稳定性,在很大程度上仍属于支持性治疗。未来的研究应集中在纠正特定病理生理学异常的靶向治疗上。
艾司洛尔作为一种β受体阻滞剂,因具有负性肌力作用以往通常被认为不适合用于脓毒症休克的治疗。随着对脓毒症病理机制的不断深入研究,人们发现脓毒症病人的典型特征是肾上腺素能系统过度激活,强烈的肾上腺素能刺激可产生多种毒副作用,包括心脏效应,如心率、心肌收缩力和心肌能量需求增加,以及心脏外效应,如高分解状态、高凝状态、全身炎症细胞因子的释放调节。因此,人们对在脓毒症病人中使用β肾上腺素能阻滞剂越来越感兴趣,目的是减轻交感神经过度刺激引起的副作用。SUZUKI等[5]的实验结果显示,连续输注艾司洛尔可改善CLP法所致脓毒症大鼠的各项心功能指标,表明艾司洛尔可改善脓毒症大鼠心肌氧利用率,作者认为艾司洛尔的这种心脏保护作用可能是通过阻断过度的β肾上腺素能刺激、减少β肾上腺素能受体密度而实现的。这一观点也得到了国内学者的认同[13-14]。另有研究显示,艾司洛尔还可通过抑制炎症递质的表达,提高脓毒症病人的心脏效应[15-16]。除此之外,β受体阻滞剂在治疗脓毒症方面也表现出生存率上的优势,例如,LIU等[17]研究表明,艾司洛尔可降低脓毒症休克病人28 d死亡率,同时缩短ICU住院时间。由此可见,艾司洛尔在治疗脓毒症所致心肌损伤方面具有积极作用。
文献报道,盲肠结扎穿孔术后24 h心肌损伤最明显,是观察脓毒癥心肌损伤最合适的时间点[18]。本实验模型评价结果显示,造模24 h后开腹可见腹腔大量渗出伴有恶臭,盲肠末端充血坏死,同时心肌组织病理切片镜下可见心肌细胞大量坏死,心肌纤维明显水肿、排列疏松,部分心肌纤维断裂,细胞核肿胀,间质水肿、炎性细胞浸润,提示脓毒症造模成功。TnI是目前检测心肌细胞损伤的“金标准”[19],不仅可以作为诊断脓毒症心肌损伤的指标,还可以作为病情严重程度和预后的指标[20]。LABUGGER等[21]的研究发现,在脓毒症过程中,心肌细胞损害多为细胞亚微结构的改变,心肌内肌钙蛋白裂解为较小片段,心肌细胞膜通透性增加,从而导致血浆肌钙蛋白水平的升高。因此,本实验选择TnI作为脓毒症后心肌损伤及其程度的评价指标。本文结果显示,Model组大鼠的血清TnI浓度较Sham组显著升高,提示采用CLP法可诱导脓毒症心肌损害,ES组的TnI浓度较Model组显著降低,表明艾司洛尔能够减轻脓毒症大鼠心肌损伤。
脓毒症时,LPS可促进大量细胞因子释放,从而引发一系列炎症反应,过度炎症反应可导致器官功能障碍,尤其是心脏。TNF-α在脓毒症发病早期起关键作用,它是启动炎症级联反应的始动因子,抑制TNF-α信号能有效改善内毒素血症引起的心肌损伤[22]。例如,糖皮质激素在抑制TNF-α的同时,可以减轻脓毒症大鼠的心肌抑制[23];阿托伐他汀可以抑制TNF-α的表达,减轻炎症反应,从而减轻脓毒症大鼠的心肌损伤[24]。与以往研究相一致,本实验也证实脓毒症大鼠血清中TNF-α的表达水平明显增加,通过外源性给予艾司洛尔,可以明显降低TNF-α的表达。另外,炎症因子IL-1也在脓毒症心肌损伤中发挥重要作用[25]。例如,黄芪多糖能够抑制脓毒症大鼠心肌组织IL-1的表达,从而减轻心脏损害[26]。本文研究结果显示,Model组大鼠血清中IL-1的表达水平较Sham组明显增加,而艾司洛尔可以明显降低IL-1的表达水平。以上结果提示,艾司洛尔可能通过降低炎症因子TNF-α和IL-1的表达,抑制炎症反应,从而改善脓毒症心肌损伤。
TLRs是一種跨膜蛋白,它能识别PAMPs,通过Myd88依赖性信号传导通路启动信号传导,激活细胞内NF-κB信号通路,启动炎症因子转录[27]。近年来,对TLR4/Myd88/NF-κB信号通路的研究涉及器官移植、神经系统疾病、呼吸系统疾病、肾脏疾病、肿瘤、内分泌系统疾病等多个领域。ZHOU等[28]采用CLP法建立脓毒症大鼠模型,证实了抗TLR4单抗预处理可抑制TLR4/Myd88信号通路,减轻炎症反应。本研究进一步探讨了艾司洛尔调控脓毒症大鼠心肌炎症反应的作用机制,结果显示,艾司洛尔能显著抑制TLR4、Myd88、NF-κB蛋白的表达。表明TLR4/Myd88/NF-κB信号通路可能参与了脓毒症大鼠的心肌损伤及炎症反应。
综上所述,艾司洛尔能够减轻炎症反应和心肌损伤,其作用机制可能与抑制TLR4/Myd88/NF-κB信号通路的激活有关。这将为脓毒症大鼠心肌 损伤的预防和治疗提供新的研究方向。但本实验存在未设置艾司洛尔浓度梯度、观察时间短等不足,因此,艾司洛尔在脓毒症心肌保护中的剂量和作用时间仍需进一步研究。
[参考文献]
[1]RHODES A, EVANS L E, ALHAZZANI W, et al. Surviving sepsis campaign: International Guidelines for Management of Sepsis and Septic Shock:2016[J].? Intensive Care Medicine, 2017,43(3):304-377.
[2]NAPOLITANO L M. Sepsis 2018: definitions and guideline changes[J].? Surg Infect, 2018,19(2):117-125.
[3]ANNANE D, BELLISSANT E, CAVAILLON J M. Septic shock[J].? Lancet, 2005,365(9453):63-78.
[4]RUDIGER A. Beta-block the septic heart[J].? Crit Care Med, 2010,38(10 Suppl):S608-S612.
[5]SUZUKI T, MORISAKI H, SERITA R, et al. Infusion of the beta-adrenergic blocker esmolol attenuates myocardial dysfunction in septic rats[J].? Crit Care Med, 2005,33(10):2294-2301.
[6]DE MONTMOLLIN E, ABOAB J, MANSART A, et al. Bench-to-bedside review: beta-adrenergic modulation in sepsis[J].? Crit Care Lond Engl, 2009,13(5):230.
[7]MORELLI A, ERTMER C, WESTPHAL M, et al. Effect of heart rate control with esmolol on hemodynamic and clinical outcomes in patients with septic shock: a randomized clinical trial[J].? JAMA, 2013,310(16):1683-1691.
[8]RITTIRSCH D, HUBER-LANG M, FLIERL M A, et al. Immunodesign of experimental sepsis by cecal ligation and puncture[J].? Nature Protocols, 2009,4(1):31-36.
[9]REZKALLA S, KLONER R A, KHATIB G, et al. Beneficial effects of captopril in acute coxsackievirus B3 murine myocarditis[J].? Circulation, 1990,81(3):1039-1046.
[10]LIU Y C, YU M M, SHOU S T, et al. Sepsis-induced cardiomyopathy: mechanisms and treatments[J].? Frontiers in Immunology, 2017,8:1021.
[11]PARK J H, KANG S J, SONG J K, et al. Left ventricular apical ballooning due to severe physical stress in patients admitted to the medical ICU[J].? Chest, 2005,128(1):296-302.
[12]WERDAN K, OELKE A, HETTWER S, et al. Septic cardiomyopathy: hemodynamic quantification, occurrence, and pro-gnostic implications[J].? Clin Res Cardiol: Off J Ger Cardiac Soc, 2011,100(8):661-668.
[13]方德舟. 艾司洛尔对脓毒症大鼠心肌保护作用的实验研究[D].? 兰州:兰州大学, 2016.
[14]刘德红,刘映峰,孟新科,等. 艾司洛尔对脓毒症大鼠心肌细胞β肾上腺能受体及血流动力学的影响[J].? 中国老年学杂志, 2014,34(13):3703-3705.
[15]WEI C J, LOUIS H, SCHMITT M, et al. Effects of low doses of esmolol on cardiac and vascular function in experimental septic shock[J].? Crit Care Lond Engl, 2016,20(1):407.
[16]李宛霞,陶少宇. β1受体阻滞剂对脓毒症大鼠心肌损伤的影响[J].? 中国急救医学, 2015,35(7):577-579.
[17]LIU X Q, HUANG W P, WEN M Y, et al. Esmolol improves clinical outcome and tissue oxygen metabolism in patients with septic shock through controlling heart rate[J].? Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2015,27(9):759-763.
[18]MACEDO R, JAVADI S M, HIGUCHI T, et al. Heart and systemic effects of statin pretreatment in a rat model of abdominal sepsis. Assessment by 99mTc-sestamibi biodistribition[J].? Acta Cirurgica Brasileira, 2015,30(6):388-393.
[19]DEMISSEI B G, POSTMUS D, CLELAND J G, et al. Plasma biomarkers to predict or rule out early post-discharge events after hospitalization for acute heart failure[J].? Eur J Heart Fail, 2017,19(6):728-738.
[20]邓粤敏,闵玲. 脓毒症患者心肌损伤标志物的水平分析[J].? 中国微生态学杂志, 2017,29(6):680-683.
[21]LABUGGER R, ORGAN L, COLLIER C, et al. Extensive troponin I and T modification detected in serum from patients with acute myocardial infarction[J].? Circulation, 2000,102(11):1221-1226.
[22]GIL M, KIM Y K, HONG S B, et al. Naringin decreases TNF-α and HMGB1 release from LPS-stimulated macrophages and improves survival in a CLP-induced sepsis mice[J].? PLoS One, 2016,11(10):e0164186.
[23]MENG X, AO L, MELDRUM D R, et al. TNF-alpha and myocardial depression in endotoxemic rats: temporal discor-dance of an obligatory relationship[J].? Am J Physiol, 1998,275(2):R502-R508.
[24]王之余,赫太平,顾金萍,等. 阿托伐他汀对脓毒症大鼠心肌保护的研究[J].? 实用休克杂志(中英文), 2019,3(4):213-218.
[25]GE Y, HUANG M, YAO Y M. Recent advances in the biology of IL-1 family cytokines and their potential roles in development of sepsis[J].? Cytokine & Growth Factor Reviews, 2019,45:24-34.
[26]程燕,陈志明,李莉,等. 黄芪多糖对脓毒症大鼠心脏功能及炎症因子水平的影响[J].? 浙江中医药大学学报, 2018,42(5):354-359.
[27]LIU L, GU H L, LIU H M, et al. Protective effect of resveratrol against IL-1β-induced inflammatory response on human osteoarthritic chondrocytes partly via the TLR4/MyD88/NF-κB signaling pathway: an “in vitro study”[J].? Int J Mol Sci, 2014,15(4):6925-6940.
[28]ZHOU S J, WANG G, ZHANG W B. Effect of TLR4/MyD88 signaling pathway on sepsis-associated acute respiratory distress syndrome in rats, via regulation of macrophage activation and inflammatory response[J].? Exp Ther Med, 2018,15(4):3376-3384.
(本文編辑 马伟平)
- 基于“互联网+”时代的企业管理创新研究
- 企业管理创新创业领域竞争力框架及机制研究
- 市场经济条件下企业管理创新问题探究
- 财务分析在企业管理中的应用研究
- 论我国中小企业管理模式及其体制创新
- 企业管理中信息技术的应用探讨
- 企业文化创新对企业管理创新的影响力
- 我国企业管理中存在的问题及对策分析
- 互联网金融对证券行业的影响与对策
- 探索互联网金融环境下对中小企业融资的可行性路径研究
- “人本自然”思维下企业人力资源发展模式与领导力修炼路径
- 企业文化建设在企业管理中的重要性
- 经济数学在金融经济分析中的应用探讨
- 数据环境下企业管理模式创新研究
- 企业信息化建设与企业管理创新
- 中国企业管理沟通问题及对策研究
- 激励理论在企业管理方面的应用分析
- 企业管理因素与银行贷款风险的影响
- 企业管理成本控制的问题与对策研究
- 浅析互联网背景下移动云办公与企业管理效率提升
- 互联网金融背景下中国证券公司盈利模式转型研究
- 当前金融开放背景下的证券行业风险及防范研究
- 浅析互联网金融对商业银行的影响及对策
- 浅析我国商业银行小微金融业务的创新
- 互联网金融冲击下商业银行盈利能力分析
- unchewed
- unchic
- unchid
- unchidden
- unchided
- unchiding
- unchidingly
- unchildish
- unchildishly
- unchildishness
- unchildishnesses
- unchildlike
- unchilled
- unchiming
- unchippable
- unchipped
- unchiselled
- unchivalries
- unchivalrousness
- unchivalrousnesses
- unchlorinated
- unchokeable
- unchoosable
- unchoosing
- unchopped
- cuan
- cuba
- cuba
- cui
- cul
- cun
- cuo
- cuo
- cuàn
- cuán
- cuì
- cuò
- cuó
- cuī
- cuō
- cuǐ
- cuɑn
- cvc
- cvc
- cvd
- cvd
- cvo
- cvo
- cv分析法
- cwo