易伟 李思 吴晶晶 苏华 龚光明
[摘要] 目的 建立清肾丸微生物限度检查法,并对其微生物检查结果进行分析,为实际生产提供参考。 方法 参照2015年版《中国药典》中的方法,建立清肾丸和清肾丸中8种中药饮片的微生物计数方法。对30批次清肾丸进行微生物限度检查,考察其需氧菌含量与丸剂水分的关系,并考察其微生物含量与烤丸时间的关系,并对清肾丸中8种中药饮片的微生物含量进行分析。 结果 清肾丸的微生物污染菌主要是需氧菌。清肾丸水分越高,其微生物污染水平越高;烤丸时间越长,丸剂水分逐渐减少,需氧菌总数也逐渐减少。8种中药饮片中蒲公英的微生物污染最严重。 结论 应严格控制清肾丸水分和烤丸时间,并建立中药饮片微生物限度标准,以引导实际生产,逐步提高清肾丸质量。
[关键词] 清肾丸;微生物限度检查;质量分析;中药饮片
[中图分类号] R927? ? ? ? ? [文献标识码] A? ? ? ? ? [文章编号] 1673-7210(2020)10(c)-0138-04
Microbial limit test and influence factor analysis of Qingshen Pills
YI Wei? ?LI Si? ?WU Jingjing? ?SU Hua? ?GONG Guangming
Department of Pharmacy, General Hospital of the Chinese People′s Liberation Army Eastern Zone, Jiangsu Province, Nanjing? ?210002, China
[Abstract] Objective To establish the microbial limit test method for Qingshen Pills, and analyze the results of the microbiological tests, and provide reference for actual production. Methods With reference to the method in the 2015 edition of the Chinese Pharmacopoeia, a method for microbial counting of 8 kinds of traditional Chinese medicine in Qingshen Pills and Qingshen Pills was established. The microbial limit tests of 30 batches of Qingshen Pills were tested to investigate the correlation between the content of aerobic bacteria and the moisture of the pill, and the correlation between the microbial content and the baking time. And the microbiological contents of 8 kinds of traditional Chinese medicine in Qingshen Pills were analyzed. Results The microbial contamination of Qingshen Pills is mainly aerobic bacteria. The higher the water content of Qingshen Pills was, the higher the microbial contamination level was. The longer the baking time, the less the moisture of the pills and the less the total number of aerobic bacteria. Dandelion had the most serious microbial contamination in 8 kinds of traditional Chinese medicine. Conclusion The water content and baking time of Qingshen Pills should be strictly controlled, and microbial limit standards for traditional Chinese medicine should be established to guide actual production and gradually improve the quality of Qingshen Pills.
[Key words] Qingshen Pills; Microbial limit test; Quality analysis; Traditional Chinese medicine
醫院制剂中,口服中药制剂是最常见的剂型,具有使用方便、疗效好、制备工艺简单等特点。相关文献显示[1-2],医院口服中药制剂微生物限度检查合格率相对较低。这可能是由于其生产工艺环节多、周期长,各个环节都有可能导致微生物污染,特别是工艺及条件设计不合理更容易污染制剂[3]。此外,中药口服制剂的原料,即中药材,是微生物污染的重要途径,药材的前处理对制剂的卫生质量有很大影响[4-5]。对于直接以药材原粉入药的制剂,检查药材前、处理后的微生物含量并根据其药性进行除菌操作(微波灭菌、辐射灭菌、酒精喷洒、流通蒸汽、高温烘干、环氧乙烷灭菌)[6-8],有利于提高成品微生物限度检查合格率。
清肾丸为东部战区总医院药剂科(以下简称“我科”)自制制剂,由金银花、丹参等10味中药组成,具有活血化瘀、涼血止血之功效。清肾丸的制备工艺中大多以药材原粉入药,因此,为提高成品微生物限度检查合格率,保障用药安全,本研究通过对30批次清肾丸进行微生物限度检查,考察其微生物含量的影响因素,希望为清肾丸的实际生产和微生物质量提供参考。
1 仪器与试药
1.1 仪器
PYX-DHS.500-BS隔水式电热恒温培养箱(上海跃进医疗器械有限公司);PYX-DHS-40×50隔水式电热恒温培养箱(上海跃进医疗器械厂);MJ-160霉菌培养箱(上海恒科有限公司);SQ510C高压蒸汽灭菌器(雅马拓科技贸易有限公司);苏Q/WS2-175-79电热恒温鼓风干燥箱(连云港医疗器械设备厂);CT-C-II热风循环烘箱(连云港医疗器械设备厂);MP1100B、MP2001电子天平(上海恒平科学仪器有限公司,精密度:0.01 g);HTY-761匀浆仪(浙江泰林生物技术股份有限公司);XW-80A涡旋仪(上海驰唐电子有限公司);MA35水分仪(赛多利斯科学仪器有限公司)。
1.2 试药
清肾丸:30批次均由我科提供。中药饮片:金银花、丹参、红花、当归、赤芍、板兰根、川芎、蒲公英8种中药饮片均购自南京鹤龄药事服务有限公司。
1.3 定量菌株
金黄色葡萄球菌[CMCC(B)26003第4代,规格:(1.0~2.0)×106/支];铜绿假单胞菌[CMCC(B)10104第4代,规格:(1.0~2.0)×106/支];枯草芽孢杆菌[CMCC(B)63501第4代,规格:(1.0~2.0)×106/支];大肠埃希菌[CMCC(B)44102第4代,规格:(1.0~2.0)×106/支];乙型副伤寒沙门菌[CMCC(B)50094第4代,规格:(1.0~2.0)×106/支];白色念珠菌[CMCC(F)98001第4代,规格:(1.0~2.0)×106/支];黑曲霉[CMCC(F)98003第4代,规格:(1.0~2.0)×106/支]。以上菌株均购自北京三药科技开发公司。
1.4 培养基
胰酪大豆胨琼脂培养基(批号:190321);沙氏葡萄糖琼脂培养基(批号:190307);胰酪大豆胨液体培养基(批号:181126);麦康凯液体培养基(批号:1905212);麦康凯琼脂培养基(批号:1701122);肠道菌增菌液体培养基(批号:181226);紫红胆盐葡萄糖琼脂培养基(批号:1906062);RV沙门菌增菌液体培养基(批号:181220);木糖赖氨酸脱氧胆酸盐琼脂培养基(批号:1905282)。上述培养基均购自北京三药科技开发公司,培养基适用性检查均符合2015年版《中国药典》第四部[9]通则的要求。
稀释剂:pH 7.0氯化钠-蛋白胨缓冲液,依照2015年版《中国药典》第四部[9]微生物限度检查项下稀释剂配制方法配制,灭菌备用。
1.5 数据处理
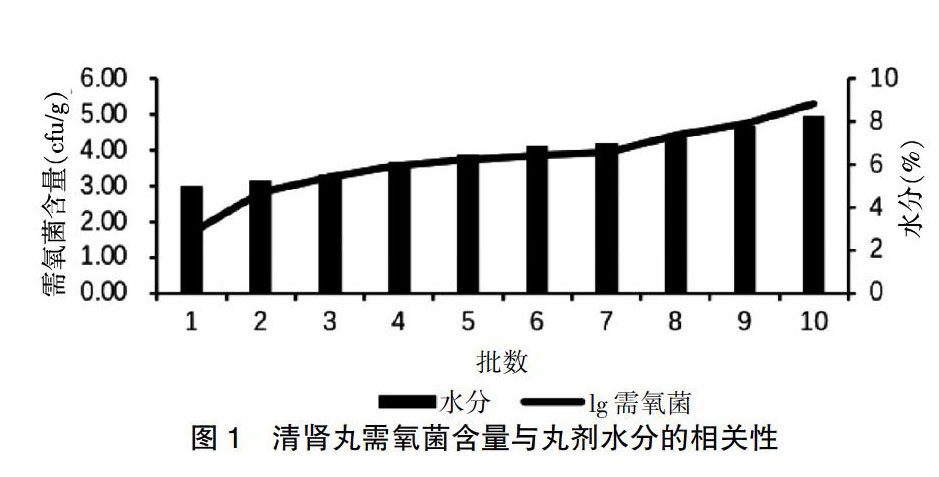
对于平板计数结果数值均以对数值,即Lg值表示,Lg值为0.5表示菌落数(N)<10 cfu/g;对于耐胆盐革兰阴性菌,Lg值为0.5表示N<10 cfu/g,1.5代表10 cfu/g 2 方法与结果 2.1 菌液的稀释 取4代定量菌株金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉、大肠埃希菌、乙型副伤寒沙门菌各1支,放置室温。分别吸取菌株复溶液1 mL,混匀。用稀释剂制成适宜浓度的菌悬液,备用。 2.2 供试液制备 取样10 g,加稀释剂至100 mL,用匀浆仪研匀,制成1∶10供试液,备用。 2.3 方法适用性试验 参照2015年版《中国药典》第四部[9]通则1100生物检查法,对清肾丸进行方法适用性试验,确定其微生物限度检查方法为:需氧菌、霉菌及酵母菌计数采用1∶10供试液,计数方法为1 mL/皿。大肠埃希菌检查:取1∶10供试液10 mL至100 mL胰酪大豆胨液体培养基中培养,按照《中国药典》第四部[9]中大肠埃希菌检查法检查。耐胆盐革兰阴性菌检查采用定量检查法:取10 g样品用胰酪大豆胨液体培养基制成1∶10供试液,取相当于0.100、0.010、0.001 g样品至10 mL肠道菌增菌液体培养基中培养,按照《中国药典》第四部[9]中耐胆盐革兰阴性菌检查法检查。沙门菌检查方法:取样品10 g至200 mL胰酪大豆胨液体培养基中培养,按照《中国药典》第四部[9]中沙门菌检查法检查。其微生物限度标准,均参照2015版《中国药典》第四部[9]实施。对8种中药饮片进行微生物计数方法的适用性试验,其需氧菌、霉菌及酵母菌检查采用1∶100供试液,计数方法为1 mL/皿。 2.4 30批次清肾丸微生物检验结果分析 本次共完成30批次清肾丸的微生物限度检查,需氧菌总数:<102 cfu/g的样品占3.33%,102~103 cfu/g的样品占10.00%,103~104 cfu/g的样品占70.00%,104~6×104 cfu/g的样品占13.33%,>6×104 cfu/g的样品占3.33%。霉菌及酵母菌总数:所有批次均<102 cfu/g。控制菌:所有批次耐胆盐革兰阴性菌均<10 cfu/g;大肠埃希菌均未检出(1 g);沙门菌均未检出(10 g)。检验结果显示,清肾丸中主要是需氧菌污染,需氧菌总数<104 cfu/g的样品占总数的83.33%,远小于6×104 cfu/g,结果较为满意,但仍有3.33%超出限度范围。 2.5 清肾丸需氧菌含量与丸剂水分的相关性
清肾丸水分测定方法为:将样品粉碎均匀,取约5 g于样品碟中,尽量铺平,采用水分仪进行测定。其标准为不得过9.0%。对10批次清腎丸进行需氧菌含量与水分的测定,发现清肾丸水分越高,其微生物污染水平越高。见图1。
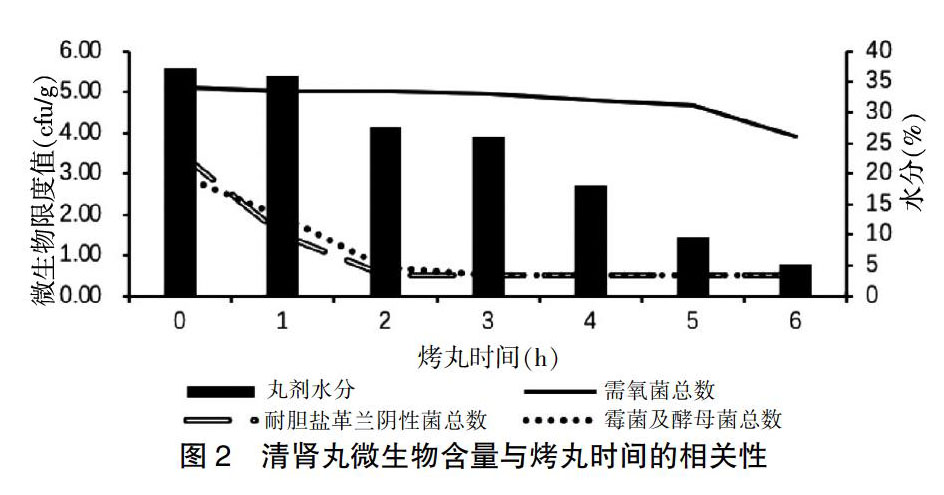
2.6 清肾丸微生物含量与烤丸时间的相关性
清肾丸的烤丸工艺采用热风循环烘箱,缓慢升温至105℃。本研究于0、1、2、3、4、5、6 h取样,分别测定需氧菌总数、霉菌及酵母菌总数、耐胆盐革兰阴性菌总数和水分。实验发现控制菌大肠埃希菌在2 h被杀灭,沙门菌在3 h被杀灭;随着烤丸时间的增加,丸剂水分逐渐减少,需氧菌总数也逐渐减少。霉菌及酵母菌总数以及耐胆盐革兰阴性菌总数在3 h后数值降至0.5,即含量<10 cfu/g。见图2。
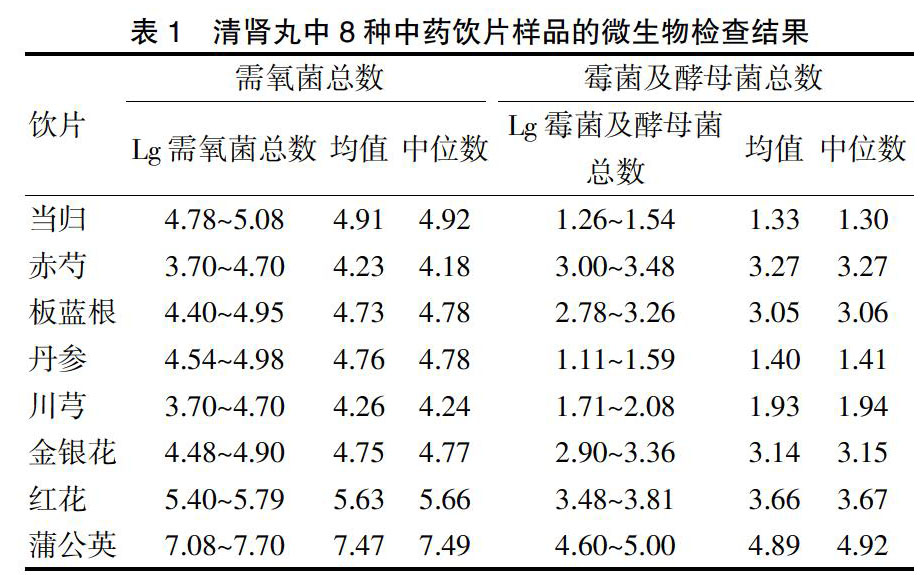
2.7 清肾丸中8种中药饮片样品的微生物检查结果
对清肾丸中8种中药饮片进行微生物限度检查,其微生物检查结果见表1。本研究发现,蒲公英的需氧菌总数和霉菌、酵母菌总数都比较高,微生物污染最严重;赤芍和川芎的需氧菌含量较低;当归、丹参的霉菌及酵母菌含量较低。见图3~4。
3 讨论
本研究结果显示,清肾丸的微生物污染主要是需氧菌。清肾丸水分越高,其微生物污染水平越高;烤丸时间越长,丸剂水分逐渐减少,需氧菌总数也逐渐减少。而丸剂水分的高低与烤丸温度、烤丸时间是密不可分的,实验显示温度为105℃,烤丸时间为6 h,这样既保证了样品中微生物的控制水平,也保证了样品水分。实验中考察了提高烤丸温度、增加烤丸时间,发现温度增加会使丸剂烤焦,烤丸时间为7、8 h,丸剂会崩解,不符合规定。
从30批次的样品统计结果可以看出,3.33%的样品超出微生物限度范围。因此本研究考察了中药饮片的微生物负载量。根据样品来源部位,可以将8种饮片进行分类。当归、赤芍、板蓝根和川芎归为根类,金银花和红花归为花类,蒲公英是全草入药。从实验结果可以看出根类饮片的微生物含量偏低,相关文献研究发现全草类、花类中药饮片微生物负载较高,根类中药饮片的微生物负载相对较低[10-13]。花类饮片中金银花的微生物负载相对较低,这可能与金银花的抑菌性有关[14-16]。因此为控制清肾丸微生物质量,需严格控制其原料中药饮片的微生物量。但是由于中药制剂原料的特殊性,也由于缺乏权威、统一的质量标准以及有效的灭菌方法,我国中药饮片微生物负载量整体较高,不同类型饮片间微生物污染差异较大[17-23]。2015年版《中国药典》第四部[9]仅规定了直接口服或泡服中药饮片的耐胆盐革兰阴性菌和沙门菌的限度标准,其他类型饮片未作规定。因此,我国中药饮片的微生物限度标准亟待完善。为提高清肾丸微生物质量,可以构建我科中药饮片的微生物限度标准作为内控标准,指导安全生产,保障患者用药安全。
[参考文献]
[1]? 康连,庞云娟,周晓婷.5种同名异型中药制剂微生物限度检查法的建立与结果分析[J].中成药,2017,39(7):1515-1518.
[2]? 马方励.常用灭菌技术及其对中药制剂质量的影响[J].中华中医药学刊,2010,28(12):2640-2642.
[3]? 温玉明,王夏潮.医药口服中药制剂微生物限度检查的影响因素及改进措施[J].中国药业,2018,27(14):90-93.
[4]? 赵高潮,张晓辉,刘继宁.中药制剂微生物污染的因素及对策[J].陕西中医,2004,25(1):68.
[5]? 刘莹,封亮,贾晓斌.中药制剂质量的影响因素探析[J].中国中药杂志,2017,42(9):1808-1813.
[6]? 严丹,袁星,解达帅,等.中药饮片灭菌的研究现状与思考[J].中草药,2016,47(8):1425-1429.
[7]? 谢正福,王淼.浅谈辐射灭菌在中药生产中的应用及相关问题[J].海霞药学,2010,22(7):261-263.
[8]? 韦瑀龙,蓝晓庆.中药钴60辐照灭菌的应用研究进展[J].海峡药学,2019,31(8):4-7.
[9]? 国家药典委员会.中国药典[S].四部.北京:中国医药科技出版社,2015.
[10]? 蝇金房,杨晓丽,李辉.陕西省12种中药饮片微生物污染调查及风险评估[J].西北药学杂志,2016,31(6):608-612.
[11]? 张光华,王似锦,江志杰,等.北京地区销售的10种中药饮片微生物污染程度考察[J].中国药房,2018,29(14):1940-1944.
[12]? 邓海英,龚勇祥,李连凤,等.中药饮片微生物污染现状及典型菌鉴定研究进展[J].中草药,2019,50(9):2242-2250,2256.
[13]? 甘永琪,农浚,零文超,等.广西等地区9种中药饮片微生物污染状况分析[J].中国药师,2018,21(5):922-927.
[14]? 苟占平,万德光.川产习用金银花的抑菌作用研究[J].时珍国医国药,2008,19(3):724-725.
[15]? 任敏,金振锐,徐小博,等.金银花不同器官提取物抑菌作用研究[J].安徽农学通报,2019,25(9):41-42.
[16]? 张忠斌,沈洪宽,孙玉风,等.金银花中酚酸类有效成分的提取及其抗菌活性研究[J].安徽农学通报,2019,28(16):27-29.
[17]? 姚东云,张静,谢俊霞,等.医院中药制剂质量的常见影响因素及控制对策[J].中国药业,2015,24(23):108-110.
[18]? 曹明成,黄泰康.我国中药饮片质量的影响因素分析和对策[J].中国药业,2016,25(6):7-9.
[19]? 范一灵,李琼琼,房蕊,等.上海地区10种中药饮片微生物污染情况研究[J].中草药,2015,46(13):1908-1913.
[20]? 谢文明,张敏,潘建文.常用中药饮片两头尖和桑寄生中微生物污染的检测及分析[J].中国药学杂志,2015, 50(18):1630-1633.
[21]? 李闽真,马群飞,傅武胜.市售中药材霉菌污染情况和优势种群分布的研究[J].中国卫生检验杂志,2013,23(17):3351-3353.
[22]? 刘广桢,林永强,林林,等.部分地区瓜萎饮片的微生物污染状况分析[J].中国药学杂志,2016,51(22):1962-1966.
[23]? 秦筱茂,郭顺星.药材霉菌及霉菌毒素污染现状分析[J].中国中药杂志,2011,36(24):3397-3404.
(收稿日期:2020-06-04)
[基金项目] 国家自然科学基金资助项目(31671026);全军医疗机构制剂标准提高科研专项课题重点项目(14ZJZ08)。
[作者简介] 易伟(1989-),女,硕士;研究方向:微生物检验、医院制剂。
[通讯作者] 龚光明(1973-),男,博士,高级工程师;研究方向:微生物免疫学、药物递送、中药制剂。
- 农机田间作业的农艺技术要求实践思考
- 农机工程对农业节能节水的作用分析
- 茶叶病虫害无公害防治技术
- 圣女果的栽培模式及高效种植技术
- 农业物联网技术与农业机械化发展
- 水稻机插秧大田栽培技术
- 关于林业资源管理与林业造林方法的实践探讨
- 玉米秸秆与根茬全量还田作业模式和机具选择初探
- 农机技术与农艺技术深度融合探讨
- 棉花种植及生产机械化发展研究
- 农艺措施与现代农业的发展
- 机械化免耕播种技术在北方地区的应用情况与作业要求
- 榆树市农用无人机植保试点作业情况分析
- 农田水利工程施工技术难点和质量控制
- 农机深松技术在农作物种植中的运用探讨
- 农业机械自动化在现代农业中的应用与发展趋势
- 地方林业天保工程实施效果的评价
- 阜新市秸秆综合利用情况
- 玉米机械化收获后的秸秆处理与再利用途径
- 农机深松技术在农作物种植中的作用
- 水肥一体化技术在水果生产的应用
- 机械设计实验教学的现代化改革与创新
- 基于中职汽车运用与维修专业实践教学数字化资源库建设方法分析
- 农业机械化培训推动现代农业可持续发展研究
- 基于中职机械制图课程“项目导向式”教学模式探讨
- glacier
- glaciered
- glacierization
- glaciers
- glad
- gladded
- gladden
- gladdened
- gladdener
- gladdeners
- gladdening
- gladdens
- gladder
- gladdest
- gladding
- glade
- gladelike
- glades
- gladiator
- gladiatorial
- gladiatorian
- gladiatorism
- gladiators
- gladiatorship
- gladiatory
- 达到最大限度
- 达到最高境地
- 达到最高点、最高限度
- 达到最高限度
- 达到极善美的境地
- 达到极完美的境界
- 达到极点
- 达到极点,不可能再增加
- 达到极端程度
- 达到极细致的程度
- 达到极限
- 达到某种境界
- 达到某种标准
- 达到某种程度
- 达到某种职位
- 达到某种高度
- 达到标准
- 达到满足的程度
- 达到玄妙的境界
- 达到生育的年龄
- 达到的程度
- 达到目的
- 达到目的后就忘恩负义
- 达到目的后就把帮助过自己的人一脚踢开
- 达到目的的便捷途径