摘 要:伦理审查是临床科研项目伦理管理的主要手段。结合当前形势和临床科研项目各阶段伦理管理遇到的项目申报前的伦理管理易“走过场”、项目正式实施前的伦理管理难度大、项目实施后的伦理管理等挑战,提出了部门联动合作、“三审制”监管、加强培训的对策,旨在提高科研伦理的质量,提升临床研究受试者的保护水平。
关键词:临床科研;伦理管理;伦理审查;三审制
随着生物医学科技的发展和医学研究手段的进步,临床研究国际化进程不断加速,世界各国涉及人的生物医学研究也日趋增多。在医院科研管理过程中,许多临床科研项目的研究对象涉及患者或健康人,由此,在项目的申报、立项、设计实施、成果发表等阶段引发的一系列伦理学问题和争议也日益凸显。如何在不违反伦理道德共识、更好地在保护人体受试者的前提下开展临床科研越来越受到研究机构、政府和社会的重视。在这种背景下,科研项目就需要一个旨在保护受试者尊严及合法权益的组织—伦理委员会,履行职责,对其管理和监督。伦理委员会管理和监督的最主要形式是伦理审查。
从2007年原国家卫生部印发的《涉及人的生物医学研究伦理审查办法(试行)》(以下简称《办法(试行)》),到2014年北京市卫生计生委和北京市中医管理局发布的《北京市人体研究管理暂行办法》(以下简称《暂行办法》),到2016年国家卫生计生委为进一步加强生物医学科学研究伦理管理工作,在《办法(试行)》的基础上增补二十条的《涉及人的生物医学研究伦理审查办法》(以下简称《办法》),再到2017年中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《意见》)都可以看出,我国涉及人的生物医学研究伦理在发展,伦理委员会对其管理与审查待进一步引导和完善。但相较于已趋成熟的药物与医疗器械注册试验,伦理委员会对临床科研项目发挥伦理审查职能进行的监管并不彻底、效果并不显著。临床科研项目的伦理管理中普遍存在不规范的现象,主要有三方面:一是科研项目的伦理管理在思想认识上并没有引起足够的重视。这种伦理意识的缺乏存在于所有利益相关者之中,包括研究者、实施管理者,以及受试者自身。二是对科研项目的伦理管理在监督、稽查操作层面尚为欠缺,仍属空白。三是伦理委员会通过审查职能对科研项目管理缺乏完整的、切实可行的、可操作性强的具体规定和制度。[1]因此,梳理临床科研伦理管理中的挑战,提出相应对策,有益于纠正科研项目实施不规范、研究的扭曲发展,更有益于推动受试者安全和合法权益的保护。
临床科研项目伦理管理遇到的挑战
1.项目申报前的伦理管理易“走过场”
伦理审查是伦理委员会规范科研项目强有力的管理手段。科研项目立项的客观需求也在一定程度上推动着伦理审查的进步。在历年国家自然科学基金委员会《项目申请指南》中,医学科学部对申报项目作出如下伦理方面的要求,“由于医学科学研究对象的特殊性,请申请人注意在项目申请及执行过程中严格遵守相关医学伦理和患者知情同意等问题的有关规定和要求,包括在申请书中提供所在单位或上级主管单位伦理委员会的纸质证明”[2],换言之,在临床科研项目申报之前,伦理委员会应提供纸质版的审核意见。而现实中这些项目总是在临近最终基金申报时才递交伦理申请审查,为了不做项目申报的“绊脚石”,有的伦理委员会“不得不”做虚设、走过场,审查仓促且讨论不充分,从而影响了伦理审查的质量[3],阻碍审查效力的真正发挥。
2.项目正式实施前的伦理管理难度大
《暂行办法》第十条规定,“经伦理委员会审查通过的,医疗卫生机构方可批准项目负责人在本机构内实施人体研究。”也就是说,通常科研项目在立项后正式实施前须经伦理委员会审查通过方可执行。伦理委员会在对正式实施前的科研项目进行伦理审查时,往往会在项目研究方案、知情同意书以及提供给受试者的其他材料(如招募广告)中发现共性问题。
第一,很多经伦理委员会审查通过的项目研究方案,内容过于精简、关键要素缺失严重,有甚者竟以课题申报书的形式替代研究方案进行伦理审查申请递交,即临床科研项目的研究方案存在内容过于简单、形式不符合伦理审查基本要求的问题。科研项目申报书具宏观性,一般不涉及具体的操作层面,而伦理委员会行使审查职能判断研究方法风险的关键则是基于项目方案中細化的具体操作。伦理审查既不是行政审批,亦不是技术准入,更不是形同虚设。伦理审查的要素点是渗透到研究方案的每一个具体步骤和实施措施中的。因此,凭课题申报书申请伦理审查是行不通的,否则将迫使伦理委员会成为“橡皮图章”。
第二,在研究方案的内容上,鉴于临床科研思维与伦理学理念的侧重点差异,即科研思维往往是从技术层面出发,确定研究方向、研究过程和研究方法,看重实施的可行性;而伦理学是从人文角度出发,考虑的多是研究对人、对社会、对人类的影响程度,看重的是研究该不该做。[4]这使得并非所有的临床科研内容和设计都符合伦理的要求。临床科研项目知情同意书是研究者与受试者之间最直接也是最便利的沟通形式。它的起草通常是在项目申报成功后,研究者借助知情同意书向受试者提供信息。充分的提供信息意味着“信息的充分告知”。关键信息包括研究项目研究目的、背景、内容、流程、方法、研究时限、研究者信息及研究机构资质等,研究的风险与受益、医疗与保护、研究相关费用、隐私与保密、受试者权利等内容。而这些关键信息的缺失往往导致信息告知不充分,特别是与受试者密切相关的实质内容,如受试者参加研究的风险程度、受益大小、费用承担、补偿影响及遭受损害的赔偿程度等。
第三,由于知情同意书需要“受试者对信息的充分理解”,所以除了考虑到受试者的受教育程度、智力、社会地位等外界因素外,更要求研究者对知情同意书的表达形式和内容易于受试者理解。实践中往往由于研究者撰写的知情同意书太过复杂、专业性太强或是以检查项目的“检查须知”代替知情同意书,导致受试者难以理解整个研究的概况和相关事宜,侵犯了受试者知情的权利。而且,实践中的某些知情同意书存在诱导性的内容或采用疗效夸大、广告性过强的语言,也会影响受试者的理性判断,侵犯受试者自由、自主同意的权利。[6]受试者了解科研研究信息并决定是否参加该研究的另外一种方式,就是研究者发布的受试者招募广告。由于研究者伦理意识淡薄,研究者往往会在广告内容上隐藏研究的“属性”和“身份”,即没有明确阐明本研究是一项“临床研究”还是“常规医疗诊疗”,是实验性研究还是观察性研究。再者,也会含糊包括研究概况、研究机构名称及地址在内的有效信息,使得受试者不能全面充分知晓本研究。另外,招募广告过度“美化”其预期研究效果或避重就轻地表述该科研研究带来的风险也是隐患。[7]
3.项目实施后的伦理管理挑戰
临床科研项目在正式启动后,伦理委员会对其实施伦理跟踪管理,实质上这里是指伦理委员会为了使人体研究受试者的权益得到充分保护,根据一定的规范、标准和方式对已经通过初始审查的研究项目所进行的审查、监督和评价……科研项目的伦理跟踪管理是保障受试者权益的核心手段[8]。但由于我国的跟踪管理只停留在概念提出层面,并未深入到具体操作指南和法规制定层面[9],加之研究者对该项管理内容的积极主动性不高,致使伦理委员会对科研项目进行的跟踪管理难度系数较高,对批准后科研项目的真实进展犹如“盲人摸象”,进而也阻碍了伦理委员会监管作用的发挥。
此外,论文发表往往是临床科研项目成果的体现。近年来,涉及人的生物医学研究所牵涉到的伦理学问题也逐渐成为国际、国内权威医学期刊约稿、决定是否刊登的关注重点。据调查,国内某知名系列杂志的稿约中均加入了医学科研伦理方面的要求,并规定当论文报告是以人为对象的研究成果,作者应说明其遵循的程序是否符合负责人体研究的委员会所制定的伦理学标准并得到该委员会的批准,是否取得研究对象的知情同意。[9]目前,很多论文无法做到在投稿前均已进行了伦理审查,投稿者往往是投出文章后应期刊编辑部的硬性要求来找伦理委员会开具审查证明。对科研项目已经伦理审查通过后发表的论文而言,投稿人可直接出具所依托的该项目的伦理审查批件作为编辑部要求的证明;而对于由研究者自发撰写、未依托任何已通过伦理审查的科研项目发表的论文,如何解决出具审查证明的问题,也是当前解伦理委员会摆脱“被动”管理僵局的燃眉之急。
临床科研项目伦理管理的启示
1.相关管理部门联动合作构建科研项目伦理管理保障机制
临床科研项目伦理管理的主体是伦理委员会,同时与科研项目相关的其他主管部门也需积极配合与主动协作,构建伦理管理保障机制共同解决项目管理各阶段中遇到的共性挑战。例如:《暂行办法》第八条规定,“医疗卫生机构应当组织学术委员会或相关专家对项目负责人申请开展的人体研究的科学性、先进性、风险程度及防范措施、知识产权等方面进行学术审查,形成书面审查记录和审查意见。经学术委员会或相关专家审查通过的,医疗卫生机构应当依据《办法》,组织伦理委员会遵循伦理基本原则进行伦理审查,形成书面审查记录和审查意见。”即在项目正式实施前,采用由学术委员会先审—伦理委员会再审的联动审查模式,从不同的侧重点、科学性和伦理合理性双管齐下,保障伦理审查的全面覆盖。
2. “三审制”监管保障伦理管理的质量和效率
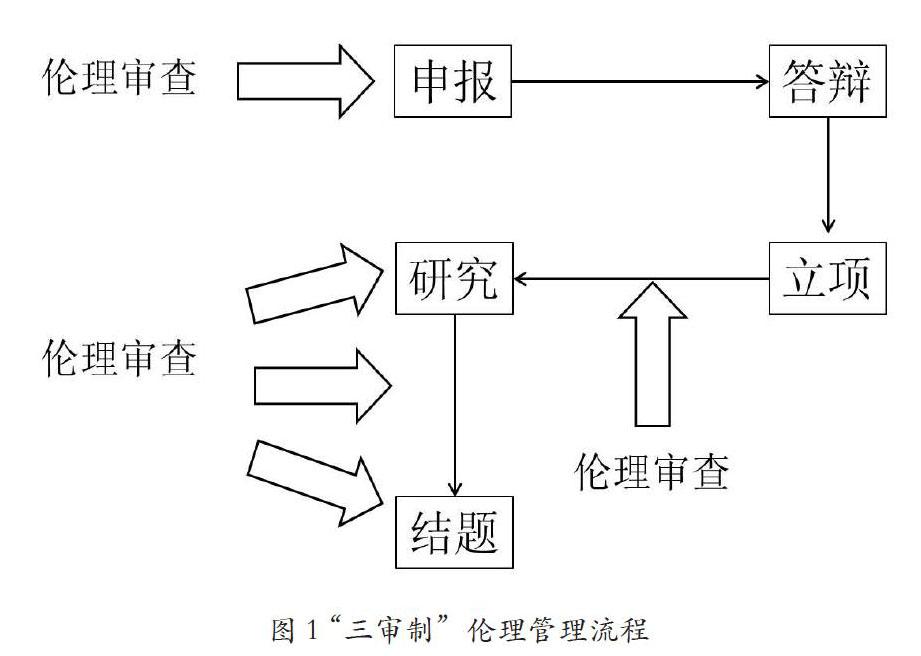
结合临床科研项目伦理管理中的普遍性问题和项目申报、实施的特殊性,笔者以为目前探索的“三审制”值得借鉴。“三审制”(见图1),即伦理委员会对临床科研项目申报前审查、实施前审查、跟踪监管。[1]三个环节紧密联系融会贯通,从审查目的、审查方式和审查内容上各有侧重,一定程度上保障了伦理管理的质量和效率。
图1 “三审制”伦理管理流程
第一,“申报前审查”是临床科研项目申报中伦理委员会要把的第一道伦理关卡,也是为项目的申报质量奠定坚实基础。出于伦理审查的独立性、公正性考虑,该道关卡可以采用会议审查的方式进行,每个项目选择两名主审委员,以会审的最终投票结果作为评审结果。由于申报前项目申请伦理的时间紧、待审任务重,伦理委员会审查的内容重点是仅对项目是否存在重大的违背伦理原则的问题、是否具有可行性,而无需对实施方案、知情同意书、病例报告表等材料进行系统的审查。主审委员的任务也仅仅是判断研究本身是否满足伦理道德要求、是否具备开展条件。
第二,“实施前审查”的目的不同于“申报前”的“宏观性审查”,而是要审查得更细致、更具体,审查的性质和方式与药物、医疗器械注册试验的并无二致,可以采取快速审查和会议审查。首次递交的临床研究项目,一般应采用会议审查的方式[10]。审查的内容可参照《办法》第二十条囊括的13个审查要素执行。该阶段审查的目的是帮助研究者在取得资助后更科学、更伦理地完善方案设计。同时,满足“科学性”和“伦理合理性”的好方案才有可能促进项目规范顺利的实施执行。
第三,“跟踪监管”是跟踪科研项目的“一生”,其间出现的有关该研究的新信息、新进展都应向伦理委员会告知。在掌握了整个项目的动态后,伦理委员会可从以下三点做进一步判断:一是研究是否存在影响研究进行的情况?二是研究风险是否控制在预期的范围内?三是研究是否存在影响受试者权益的问题?可见,该阶段审查对受试者的保护更强于“实施前审查”。在上述判断的基础上,伦理委员会审查研究者递交的各类材料,同时主动介入各实施科室开展实地访查,以了解研究的最真实情况,最及时发现研究中不符合伦理原则的现象。
3.加强培训、积极引导
面向研究者,加大对伦理委员会职能和伦理人文知识的宣传,组织宣教等活动,让研究者了解到伦理审查的本质—不是束缚科研发展、阻碍创新思维,也不是吹毛求疵,而是一种出于对科学研究人文考量的协助和合作,逐步消解研究者对伦理审查的抵触心理。科研思维与伦理意识的有机结合,有利于推进科研活动更加顺利地开展。同时,鼓励伦理委员会积极发挥咨询、培训职能,面向项目研究者开展有关申报院内伦理审查流程、注意事项,讲解申报模板使用、材料撰写的专题培训。积极引导研究者在搭建论文思路和研究正式实施前,以科研项目申报伦理审查,逐步扭转伦理委员会“被动”管理项目成果的局面。
继中共中央办公厅、国务院办公厅《意见》的发布,我国药品和医疗器械注册临床试验的审查和监管正步入一个新时代。虽然目前临床科研项目的伦理审查和管理刚刚起步,但在伦理委员会、研究者、相关科研管理部门的共同重视和努力合作下,探索新思路、寻求新方法,各司其职,肩负保护受试者的神圣职责,那么临床科研项目的伦理管理质量、研究质量,广大临床科研工作者的伦理意识必将呈现出科研伦理的新气象。
参考文献:
[1]陈勇川,杨竟.临床科研课题申报和实施中的伦理审查[J]. 医学与哲学,2016, 37(11A):26-28.
[2] 国家自然科学基金委员会.2017项目指南[EB/OL]. (2016-12-09)[2017-11-24]. http://www.nsfc.gov.cn/nsfc/cen/xmzn/2017xmzn/index.html.
[3] 黄瑾,刘厚佳,蒲江,等.临床医学科研伦理审查面临的问题与对策[J].中国医院管理,2011,31 (6):45-46.
[4] 赵一鸣.医学伦理学:医学研究中不可回避的问题[J].中华医学杂志,2005,85(6):424-426.
[5] 李娌,张艳萍,魏玉萍,等.医学临床研究中知情同意存在的问题和如何保护受试者的知情同意权[J].中华医学科研管理杂志, 2011,24 (5) :298-300.
[6] 林颖,周谏开.关于加强临床试验招募广告伦理审查的探讨[J].中国处方药,2014,12(9):1-2.
[7] 张雪,尹梅,刘丹茹.伦理审查委员会跟踪审查制度探析[J].医学与哲学,2012,33(4A):26-27.
[8] 于丹丹,徐源,张雪,等.论美国伦理审查制度及其对我国的启示[J].中国医学伦理学,2015, 28(4):625-627.
[9] 王蕾.从医学期刊编辑角度谈医学科研管理[J].中华医学科研管理杂志,2006,19(6):369-370.
[10] 熊宁宁,李昱,王思成.伦理委员会制度与操作规程(第3版)[M].北京:科学出版社,2013:78.
(作者单位:首都医科大学宣武医院伦理委员会)
[责任编辑:卜 珺]
- 以中山市建斌中等职业技术学校为例谈工匠精神在中职德育课教学中的渗透
- 试析高中思想政治课教学中如何渗透社会主义核心价值观教育
- 浅谈“做中学”在会计基础教学中的应用
- 中学生物互动课堂研究
- 强化问题意识,培养创新能力
- 小学《道德与法治》教学中失真现象及提高教学实效性的策略探讨
- 提高化学专业物理化学有效教学效率的探讨
- 基于MOOC的混合式教学研究
- 基于课程园本化视野下民间游戏资源在幼儿教学中的有效运用
- 美在民间,传承在心
- 利用主题活动月提升生命健康意识
- 电子电工教学培养学生兴趣的策略研究
- 新课改下提高初中物理教学的有效性的路径探索
- 学前教育专业音乐课程的发展研究
- 谈谈怎样精心设计使物理课堂教学高效化
- 浅谈关于思想政治教育教学开展的方法分析
- 五年制高职理实一体化课程引入微课教学的探索及应用
- 关于高职会展专业双创课程考核方式的思考
- 关于中职德育课堂中案例教学法案例选取的几点疑问
- 关于线描写生教学的思考
- 钢琴教学中节奏及力度的训练技巧探究
- 探究生活素材在初中物理教学中的应用
- 智慧教育理念下高职“基础护理学”教学模式的研究与实践
- 构建正能量课堂,培育积极健康人格
- 浅析高校《大学计算机基础》教学中的因材施教
- eˌlectrical engineering
- e-ˌmoney
- eˌmotional capital
- eˌmotional intelligence
- e-ˌtailer
- e-ˌtailing
- e-ˌticket
- e-ˌticketing
- eˌxecutive assistant
- eˌxecutive chairman
- eˌxecutive director
- eˌxecutive information system
- eˌxecutive secretary
- eˌxecutive summary
- eˌxecutive vice-president
- eˌxemplary damages
- f
- f.
- f2f
- fa
- faa
- fab
- fable
- fabler
- fablers
- 放心肉
- 放心茶
- 放心菜
- 放心落意
- 放心解体
- 放心食品
- 放心,不挂念
- 放心,内心踏实
- 放心,无忧虑
- 放快
- 放怀
- 放恕
- 放恣
- 放情
- 放情丘壑
- 放情山水
- 放情者危,节欲者安
- 放情自纵
- 放意
- 放意肆志
- 放慢
- 放慵
- 放懒
- 放扇
- 放手