化学反应中的能量变化是中学化学教材体系的另一条主线,其中之一的化学能与电能相互转化是日常生活、工农业生产联系最广的一种,因此新型电池成为高考题材中的“宠儿”,以新型电池为载体考查了学生对电化学原理及其应用的掌握程度。由于题材新、陌生度高,综合性强,有些学生的知识容量有限,难以识别和理解,有一定的难度和区分度。本文举例说明仅就以新型电池来考查原电池工作原理的考查形式。
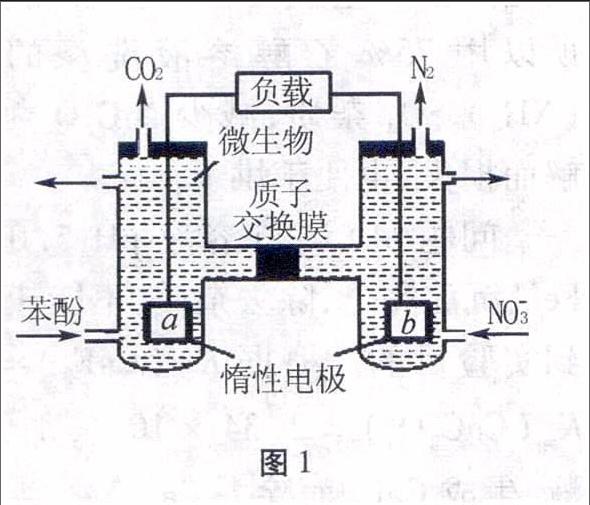
例1一种微生物燃料电池如图1所示,下列关于该电池的说法正确的是()。
A.a电极发生还原反应
B.H+由右室通过质子交换膜进入左室
C.b电极反应式为2NO-3+10e-+12H+N2↑+6H2O
D.电池工作时,电流由a电极沿导线流向b电极
图1解析本题以微生物燃料新型电池考查原电池工作原理,考查了正负极的判断、两极上反应类型、电池内电路(电解质溶液中)阴阳离子的移动方向、外电路电流的方向和电极方程式的书写。正负极判断依据氧化还原反应原理,化合价升高,失去电子的一极是负极,被氧化,发生氧化反应。由b电极上由NO-3变成N2,N元素的化合价降低,可判断b电极为正极,发生还原反应,推出a电极为负极,发生氧化反应,故A错误;电池内电路电解质溶液中阳离子向正极移动,阴离子向负极移动,B选项中H+应从左室通过质子交换膜进入右室,故B错误;C选项考查了电极方程式的书写,b电极为正极,得电子,又符合酸性介质,b电极的电极反应式为:2NO-3+10e-+12H+N2↑+6H2O,故C正确;电池外电路电子的流向是由负极通过导线流向正极,电流方向正好相反,故D错误。
答案:C
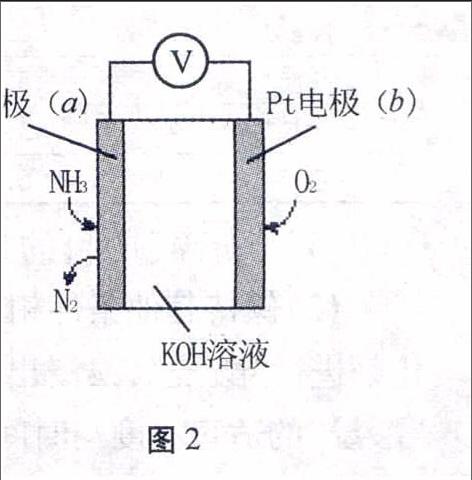
图2例2某电化学气敏传感器的工作原理如图2所示,下列说法正确的是()。
A.b极为负极
B.a极的电极反应式为2NH3+3O2--6e-N2+3H2O
C.反应消耗的NH3与O2的物质的量之比为4∶5
D.该传感器在工作过程中KOH的物质的量不变
解析本题以电化学气敏传感器的工作原理为载体进行考查。A选项考查电极判断,b电极通入的O2是氧化剂,反应中是得到电子,b极为正极,故A错误;图中以KOH溶液作电解质溶液,不可能存在O2-,没有考虑到离子的存在形式,故B选项错误; C选项考查了反应物之间的物质的量比,只是写出电池总反应方程式就可判断,电池总反应方程式为:
4NH3+3O22N2↑+6H2O
则NH3与O2的物质的量之比为4∶3,故C选项错误。从总反应方程式中来看没有消耗KOH,产物是N2和H2O,故KOH的物质的量不变,但需注意的是KOH的物质的量浓度是因为有水生成而降低的。故选D。
答案:D
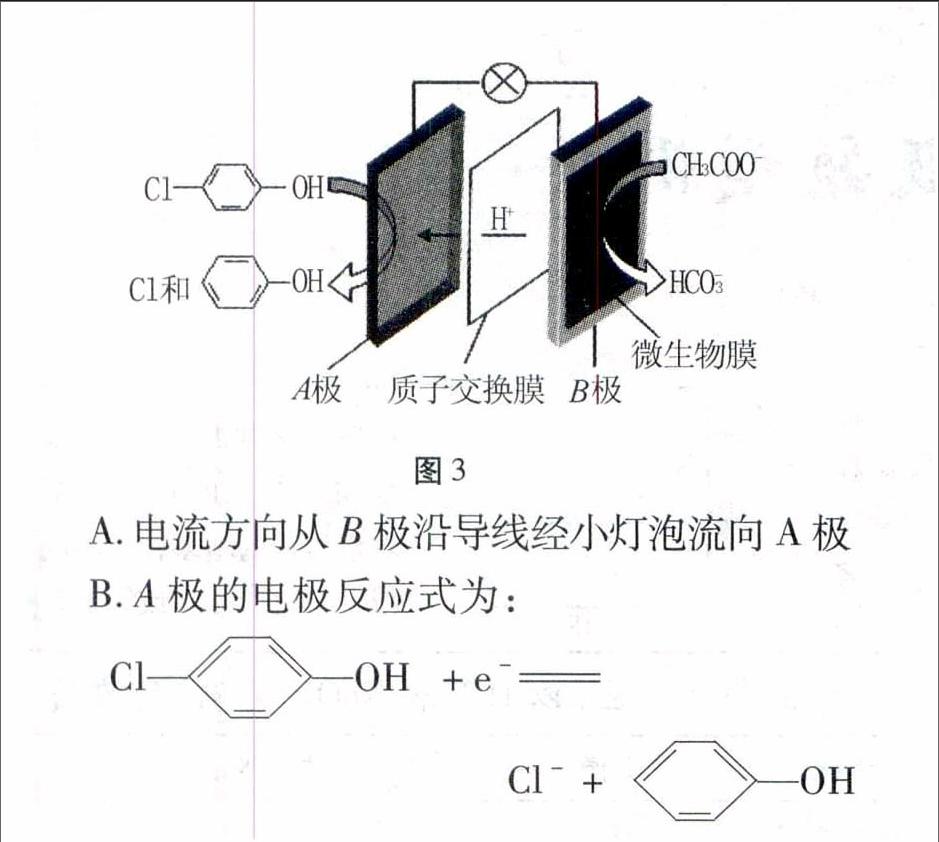
例3现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚ClOH,其原理如图3所示,下列说法正确的是( )。
图3A.电流方向从B极沿导线经小灯泡流向A极
B.A极的电极反应式为:
ClOH+e-
Cl-+OH
C.当外电路中有0.2 mol e-转移时,通过质子交换膜
的H+的个数为0.2NA
D.B极为电池的正极,发生还原反应
解析本题中的新型电池以现实工业生产中除去含乙酸钠和对氯苯酚污水处理,并以有机污染物为原料设计的新型电池,学生对共价键理解不深,有机物中元素的化合价判断是学生的一个难点,其实,只要采用整体法,依据中性微粒的化合价代数和为零的原则,常见元素的化合价以常规来处理,计算出碳元素的化合价,不管碳元素的真实化合价是多少,可用分数表示,根据碳元素化合价的变化来判断正负极及电极方程式的书写。 如A极中对氯苯酚的分子式C6H5OCl中碳元素的化合价可计算为-1/3,苯酚中碳元素的化合价 计算为-2/3,则A极中碳元素化合价降低,得电子,故A极为正极,同理B极CH3COO-中碳元素化合价为0价,HCO-3中碳元素化合价为+4价,则B极中碳元素化合价升高,失电子,B极为负极。 可写出电极方程式:
A极:正极2ClOH+2e-
2Cl-+
2OH
B极:负极CH3COO--8e-+4H2OHCO-3+H2CO3+8H+
A选项考查的外电路电流方向是正极通过导线流向负极,故A选项错误;B选项转移2e-,错误;一个电子与一个H+都带一个单位电荷,所以C选项当外电路通过0.2mol e-时,内电路中有0.2 mol H+通过质子交换膜,C选项正确。D选项B极为电池的负极,错误。
答案:C。
例4H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:
2H2S(g)+O2(g)S2(s)+2H2O(l)
ΔH=-632 kJ·moL-1
图4为质子膜H2S燃料电池的示意图。下列说法正确的是( )。
图4A. 电极a为电池的正极
B. 电极b上发生的电极反应为:O2+2H2O+4e-4OH-
C. 电路中每流过4 mol电子,电池内部释放632 kJ热能
D. 每34 g H2S参与反应,有2 mol H+经质子膜进入正极区
解析本题结合H2S废气资源化利用和化学反应与热能的变化设计的新型电池,结合电池总反应方程式,图中电极b通入的O2是氧化剂,得电子,电极b是正极,电极a通入的H2S是还原剂,电极a是负极,选项A错误。选项B的电极方程式是在碱性条件下,而题中给出的是质子交通膜,B选择项错误。选项C对原电池的概念不清,原电池是把化学能转化为电能的装置,所以电路中每流过4 mol电子,有632 kJ的化学能转化为电能,故选项C错误。选项D中34 g的H2S刚好是1 mol,1 mol H2S的硫从-2价升高到0价,转移的电子数为2 mol,所以电池的内电路电解质溶液中有2 mol H+经质子膜进入正极区,所以选项D正确。
答案:D。
这种题型虽然题材新,来源广范,时代性强,备受命题者青睐,看上去起点高,实质上落点低,仍然考查的是中学所学的原电池的基础知识和基本工作原理,只要掌握了相关知识和原理,问题就可迎刃而解。
(收稿日期:2016-07-15)
- 新媒体时代医药企业营销渠道的选择及控制策略探究
- 民航服务高质量发展问题研究
- 中小餐饮企业在感官营销方面存在的问题及改进策略
- 浅析如何从保险营销方面重塑保险行业形象
- 公立医院绩效考核管理存在的问题及对策
- 如何提高电话营销成功率
- 中小企业研发项目质量管理存在的主要问题和解决策略
- 农业科研单位科技人才队伍建设分析
- 企业党建能否提升经营业绩
- “走出去”企业外派员工管理问题与对策研究
- 基于向量空间模型的KNN分类器模型在反洗钱监管体制中的应用研究
- 我国商业银行理财产品法律规制研究
- 区域性城市商业银行个人客户场景化营销研究
- 香港保险与内地保险对比分析
- 我国互联网金融监管现状与体系构建研究
- 分红保险在香港地区与大陆地区差异分析
- 浅析大数据时代对税务工作的挑战与对策
- 关于做好新形势下国税工作的思考
- 马克思经济共享思想对当前供给侧改革的启示
- 基于平衡计分卡的Y私立小学绩效管理研究
- 企业财务成本管理存在的问题及对策分析
- 浅谈政府会计改革进程中面临的问题及解决措施
- 基于GONE理论的上市公司财务舞弊成因及对策分析
- 浅析加快医院财务管理信息化建设步伐的思路
- 大数据背景下企业财务共享服务中心应用研究
- yetis
- yet to come
- yet²
- yet¹
- yew
- yews
- y-fronts
- yha
- yiddish
- yiddisher
- yiddishes
- yield
- yieldable
- yielded
- yieldings
- yields
- yields to maturity
- yield to
- yield to maturity
- yieldtomaturity
- yield to sth
- yield²
- yield¹
- yikes
- yippee
- 神态镇定自然
- 神怆
- 神怒人弃
- 神怒人怨
- 神怒人痛
- 神怒天诛
- 神怒民怨
- 神怒鬼怨
- 神怕敬,鬼怕送
- 神思
- 神思不定或神志不清
- 神思专注
- 神思凝滞的样子
- 神思恍惚
- 神思恍惚散乱
- 神思迷糊错乱
- 神思,意念
- 神怡
- 神怡心旷
- 神怡心醉
- 神怪
- 神怪小说
- 神怪的事物
- 神怿气愉
- 神恬