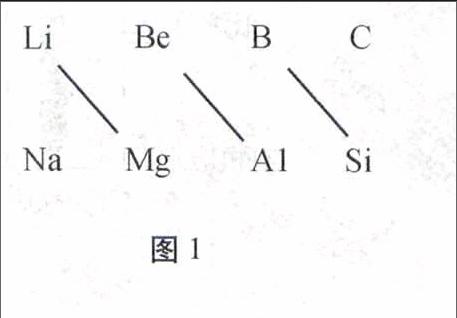
研究周期表中元素性质变化规律,不难发现在周期表二、三周期的ⅠA~ⅣA族中,左上方和右下方的两种元素性质十分相似,这种现象特称其为对角线规则。对角线规则是中学阶段最重要的规则之一。对于此类问题只要抓住“相对应”物质的特殊性质,就可以很好的解决问题。
例1根据对角线规则,下列物质的性质不具有相似性的是()。
A.硼和硅B.铍和铝
C.锂和镁D.锂和铝
分析在周期表中,某元素的性质和它左上方或右下方的另一元素性质相似性,称对角线规则。这种规则,属于经验规则,尚无统一理论解释。这种相似性特别明显地存在于如图1所示三对元素之间。
图1
答案:D。
小结周期表中仅有图1所示三组元素符合对角线规则。
例2在周期表中,同一主族元素的化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此请回答:
(1)鋰在空气中燃烧除生成外,也生成微量的(均填化学式)。
(2)下列对锂或镁的性质的推断不合理的有(填代号)
A.两者在自然界中均无游离态
B.LiOH易溶于水,受热不分解
C.Li遇浓硫酸不“钝化”
D.Mg可以在二氧化碳中燃烧
E.碳酸镁可以受热分解生成氧化镁
F.Li2SO4能溶于水
(3)受到对角线规则的启发,根据NaH的存在,有人提议可将其中反氢元素放在ⅦA族,你认为其理由是;由此推知,根据其最高正价与最低负价的绝对值相等,则也可将反氢元素放在周期表中的族。
分析空气中除氧气外,还有大量的氮气。由于锂和镁处在对角线上,根据对角线规则,结合镁的化学性质,不难判断出(1)为Li2O和Li3N;对于(2)由于镁很活泼,故此,Li和Mg在自然界中一定无游离态存在;根据Mg(OH)2难溶于水,那么,可推断LiOH也不溶于水;依次可顺推出C、D、E、F都正确。(3)VIIA元素的特征和NaH比较,可得出主要是由于H显-1价的性质而做出的判断;而最高正价与最低负价的绝对值相等,只有ⅣA族。
答案:(1)Li2OLi3N;(2)B;(3)H显 -1价 ⅣA族
小结锂与镁相似性表现在:
(1)锂、镁在氧气中燃烧都生成正常氧化物,而其它碱金属生成过氧化物或超氧化物;
(2)都能与N2直接化合生成氮化物(Li3N、Mg3N2);
(3)氢氧化物均为中等强度的碱,在水中溶解度不大。加热时可分别分解为Li2O和MgO。其他碱金属氢氧化物均为强碱,且加热至熔融也不分解。
(4) 碳酸盐在受热时, 均能分解成相应的氧化物( Li2O、MgO)。
例3(1)铍的性质类似于铝,下列有关铍性质的推断正确的是()。
A.铍能与冷水反应
B. 氢氧化铍能与强酸、强碱溶液反应
C.氧化铍的化学式为Be2O3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
(2)铍的最高价氧化物的水化物属于两性化合物(提示:铍酸的化学式为H2BeO2),证明这一结论的有关离子方程式为:。
(3)若已知反应
Be2C+4H2O2Be(OH)2↓+CH4↑
则Al4C3与水反应的化学方程式为:。
分析(1)根据题目信息,“铍的性质类似于铝”,易知A、D错,B对。对于C由于铍在第ⅡA族,最高正价为+2价,因此,氧化铍的化学式为BeO。(2)所谓两性即既与强酸反应生成盐和水,又与遇强碱反应成盐和水,据此可写出其离子方程式。(3)观察给的化学方程式不难看出,是形成了Be的氢氧化物,C的氢化物。
答案:(1)B;
(2)Be(OH)2+2H+Be2++2H2O
Be(OH)2+2OH-BeO22-+2H2O
(3)Al4C3+12H2O4Al(OH)3↓+3CH4↑
小结铍与铝的相似性有:
(1) 单质均为活泼金属;
(2) 单质均为两性金属, 既能溶于酸也能溶于强碱,一般得都到氢气。(如硝酸例外)
(3) 单质都能被冷的浓硝酸钝化;
(4) 氯化物均为共价化合物;在卤化铝中,除AlF3是离子化合物外,其余都是共价化合物。
(5) 氧化物的熔点、硬度都很大;如Al2O3因硬度大、熔点高而俗称刚玉。
(6)氢氧化物的颜色均为白色固体,难溶于水,呈两性。
Be(OH)2 + 2 H+Be2+ + 2 H2O
Be(OH)2+2OH-Be(OH)2-4
此外,硼与硅也有许多相似性。例如,两者单质的硬度很大,都能和强碱作用产生氢气,含氧酸为不溶于水的固体酸、氢化物的稳定性差,易自燃等。
(收稿日期:2017-02-15)
- 物流公司财务管理体系优化思考
- 我国农村商业银行财务管理存在的问题及对策研究
- 园林公司财务管理绩效提升探析
- 试论事业单位财务管理中新事业单位会计准则的影响
- 关于权益净利率在实际应用中的探讨
- 新形势下化工生产企业财务管理优化路径之我见
- 现代企业制度下财务管理的创新路径初探
- 电力企业工程项目全面预算管理
- 基于财务人员视角下高校报销难问题浅析
- 企业应收账款成本对账务分析初探
- 新经济背景下企业财会管理创新问题的探讨
- 论如何完善部队财务预算管理
- 企业改制对企业财务会计的影响与对策分析
- 再议全面预算管理在企业经营管理中的作用
- 高校财务风险规避措施的实践探索
- 企业财务风险管理与内部控制管理现状及对策
- 基于经济时代电力财务管理的模式认识
- 内控视角下地勘单位财务核算集中监管系统建设研究
- 有关行政事业单位加强预算管理的探讨
- 事业单位财务风险的防范措施探讨
- 国有民办学校义务教育经费使用与管理研究
- 国有企业纵向课题经费管理中存在的问题及对策
- 精细化预算管理在电力企业中的应用探讨
- 初探企业预算管理
- 国有企业全面预算管理的重点与难点探讨
- summers
- summer school
- summer schools
- summertime
- summertimes
- summerward(s)
- summing
- summings-up
- summing-up
- summingup
- summing up
- summit
- summital
- summited
- summiting
- summitless
- summits
- summon
- summonable
- summoned
- summoner
- summoners
- summoning
- summonings
- summons
- 塔西佗
- 塔里木河
- 塔里木盆地
- 塔顶
- 塔顶上挂灯笼——高明
- 塔顶上散步——无路可走
- 塔顶上迈步——没路可走
- 塔顶散步
- 塔香
- 塕
- 塗
- 塗龟
- 塘
- 塘口
- 塘坝
- 塘坳
- 塘埝
- 塘埭
- 塘堤
- 塘堰
- 塘子
- 塘岸
- 塘怕渗漏,人怕引诱
- 塘池
- 塘沽协定