
摘要:为了使学牛真正理解和掌握摩尔质量的概念及由来,充分利用玻璃注射器对压力反应灵敏、刻度准确、气密性良好等特点进行常温下体积法测定氧气摩尔质量实验的设计,使实验过程能自动收集气体并调节装置内外的压力相一致。通过测量过氧化氢溶液在二氧化锰的催化作用下产牛氧气的体积,可以求出氧气的摩尔质量。实验操作简单,实验成本低,便丁推广。
关键词:体积法测定;气体摩尔质量;实验设计;化学实验探究
文章编号:1005 - 6629(2015)5 - 0066 - 03
中图分类号:G633.8
文献标识码:B
1 问题的提出
在学习摩尔质量一节时[1],各种物质的摩尔质量的数值都是通过理论推导得出的,导致课堂教学显得枯燥无味,不便于学生掌握,增加了学生的学习负担。那么,能否通过实验来测定,将这一知识点的学习由感性认识逐步转变为理性认识,从而降低学生学习的难度,实现有效教学?
2 研究目的
为了解决这一问题,我们通过网络,以“常温下氧气摩尔质量的测定”、“氧气摩尔质量的测定”、“摩尔质量的测定”等词条进行搜索,结果都没有找到所需的内容。为此,我们设计了如下实验。
3 实验方法
3.1 实验原理
双氧水在二氧化锰的催化作用下分解生成氧气。
通过网上资料查到,标准状况( 20℃,latm)下,氧气的密度为1.43 g/L,水的密度为0.998 g/cm3。再将《水的密度表》[2]和《过氧化氢浓度密度对照表》[3]进行对比,发现在同一条件下,溶质的质量分数为1%~5%的双氧水的密度与水的密度非常接近,特别是3%的双氧水与水的密度几乎相等,约为0.998 g/cm3,为了方便数据处理,我们按1.0 g/cm3进行计算。
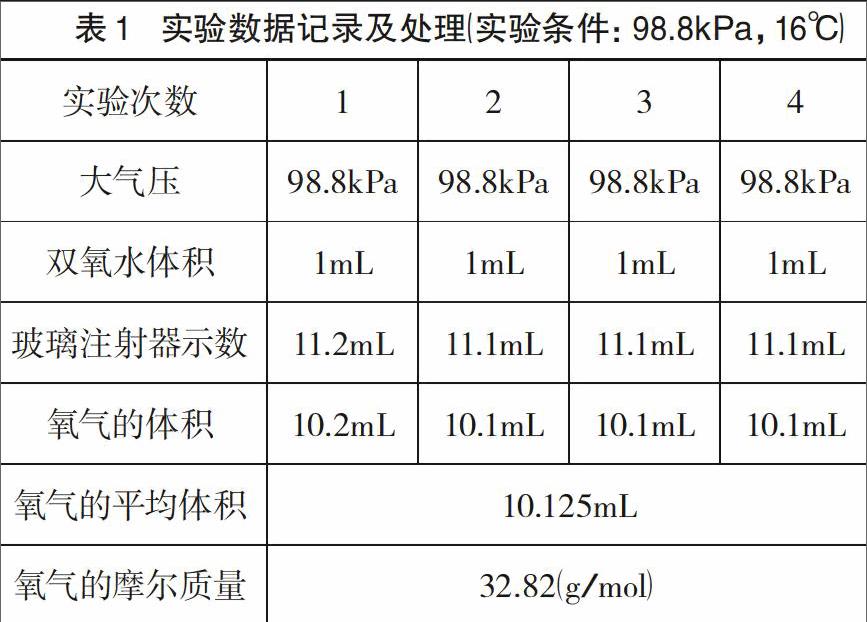
设常温常压下(实验时间为2014年10月16日下午17:30~18:30,实验条件为:98.8kPa,16℃,实验地点为贵州省金沙县城区),氧气的摩尔质量为M( g/mol),当用ImL 3%的双氧水(广东恒健制药有限公司生产的“恒健”牌过氧化氢溶液)来做实验时,完全反应后产生的氧气体积为V (mL),则有:
上式说明,只要测得ImL溶质的质量分数为3%的双氧水在常温常压下完全分解后产生的氧气体积V即可计算出氧气的摩尔质量。
但如何才能准确测定反应中所产生的02的体积呢?通过“常温下气体摩尔体积的测定”[4]一文的研渎,发现该方法可行,但文中所述实验方法是利用排水集气法收集并测量反应产生的O2,体积,涉及到反应前后两次调节集气筒和集液筒中液面高度的操作,操作比较麻烦。为了简化实验操作,我们考虑作以下改进。
(1)由于是通过测量体积而不是称质量来测定氧气的摩尔质量,故无需考虑气体的纯度,可以用排空气集气法来收集并测量氧气的体积,这样可以免去排水集气法收集并测量反应产生的02体积时,调节集气筒和集液筒中液面高度的操作,从而简化了实验操作。
(2)由于笔者曾经使用并研究过玻璃注射器,了解其对压力的感应非常灵敏,且具有刻度准确、气密性良好等特点,因此将其与气体发生装置直接相连,不仅使反应产生的气体被自动收集到其中,义能较准确地读出气体体积,从而使该实验实现了一定程度的自动化,减少了人工操作步骤,大大地简化了实验操作。
(3)为了缩短实验操作的时间,我们还考虑连续实验时所需解决的废液和废气的排出问题。于是在反应室底部设计了废液出口,当进行下一次实验时,只需打开止水夹将玻璃注射器活塞归零,再关闭止水夹就能同时解决废液和废气的排出问题。
3.2 实验装置
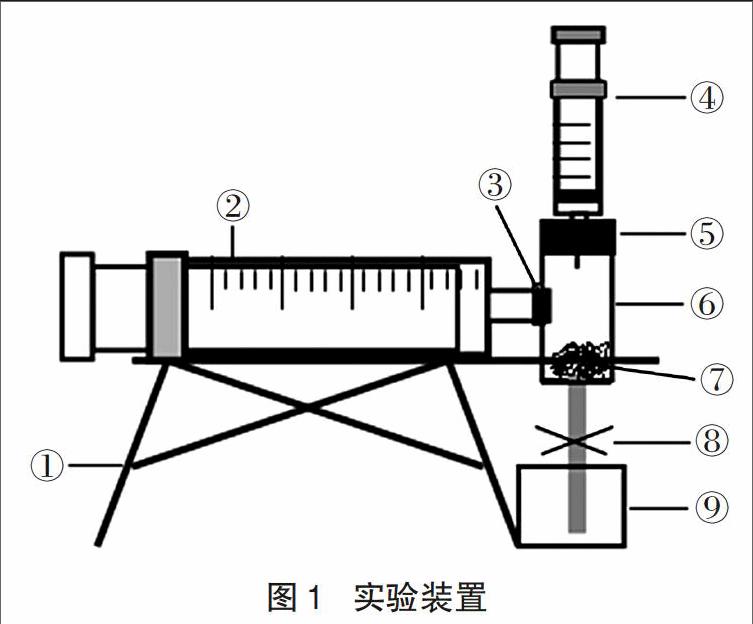
基于上述分析和思考,根据实验原理,我们设计了如图1所示的实验装置。
图示说明:
①支架(装饰用铝塑板粘合而成)
②20mL医用玻璃注射器(用于收集并测量反应产生的02体积。为了提高测量的精确度,用直尺测量注射器上两个最小刻度[lmL]之间的距离,直尺显示为3mm,于是打印了一张间距为Imm的短竖线纸条,用透明胶带粘贴在玻璃注射器的对应刻度上,从而将玻璃注射器的精确度提高到了0.33mL)
③注射用针头帽(将注射用针头的针管拔掉,用胶水将其粘在反应室侧壁上的孔中)
④SmL医用塑料注射器(用于抽取并添加液体反应物3%双氧水)
⑤橡皮塞(用于封闭反应室)
⑥反应室(用半截20mL医用塑料注射器制成,用作反应容器,盛装反应的催化剂——块状或颗粒状的二氧化锰)
⑦块状或颗粒状二氧化锰(将二氧化锰粉末与熟石膏按3:1或2:1的体积比或质量比混匀后加水调和晾干制成)
⑧废液出口管及开关(用一段输液管和止水夹组成)
⑨废液收集容器(半截空药瓶制成)
3.3 实验步骤
3.3.1 检查气密性
如图1所示,打开废液出口开关,拉动SmL注射器活塞抽人_定量空气,关闭废液出口开关,推、拉SmL注射器活塞,如果20mL注射器活塞移动的示数与SmL注射器相同,表明装置气密性良好,就可以用来做实验了。否则应用水将橡皮塞外沿和玻璃注射器内壁润湿后插回原位旋紧,然后重复上述操作,直至两注射器活塞移动的示数相同为止。
3.3.2 实验操作
(1)实验准备。取下反应室口橡皮塞,加入适量二氧化锰颗粒,重新塞好橡皮塞;然后取下SmL注射器筒抽取4~5mL 3%标准浓度的双氧水,插回原位。
(2)制取并收集氧气。打开废液出口开关,将20mL注射器活塞归零,关闭废液出口开关,推动5mL注射器活塞,向反应室中注入ImL 3%双氧水标准溶液。在二氧化锰的催化作用下,双氧水分解生成氧气,随着反应的进行,玻璃注射器活塞在产生的氧气形成的压力下慢慢向外移动。待反应室中不再产生气泡,恢复至室温,读取收集到的氧气的体积,同时从气压计中读取此时的大气压和室温,记录在表1中。重复相同操作3~4次。将几次实验测得的氧气体积的平均值减去加入的双氧水的体积(因为加入的双氧水排出的空气也会进入玻璃注射器)代人①式中,即可得出常温下氧气的摩尔质量。
4 精确度
(32.82-32)÷32 x100%=2.5%
亦即实验的精确度为97.5%。
5 误差分析
本实验的误差来自如下两个方面:
(1)双氧水的密度是按l.Og/cm3进行处理的,而实际上没有这么大。(2)本实验所用药品为广东恒健制药有限公司生产的“恒健”牌过氧化氢溶液,标签上标明“含过氧化氢(H202)2.5%~3.5%”,并不是我们所需要的标准3%的过氧化氢溶液。从实验结果来看,测量值比实际值略偏大,说明该厂生产的并非标准浓度的过氧化氢溶液,用于科研工作的定量实验中会产生一定误差。
6 实验说明
针对药品所造成的实验误差,我们义买来其他厂家生产的不同品牌的标识为3%的过氧化氢溶液进行反复实验,但测量结果仍然存在不同程度的误差,有时偏高,有时偏低,而在中学化学实验室义无法获取3%的标准过氧化氢溶液,因此实验只能到此为止。但这并不影响我们设计实验的初衷,因为我们设计该实验的目的,是旨在设计一个简单的实验装置和利用一些现成的物品,提供一种在普通中学实验室甚至日常生活中,均能轻松测量摩尔质量的实验方法,并达到高达97.5%的精确度,可以说实验已经获得了成功。
7 本实验的优点
(1)使摩尔质量的教学通过实验从感性认识逐步转变为理性认识,同时让学生感受和体验了科学研究的方法和过程。
(2)充分利用玻璃注射器对压力感应灵敏、气密性良好、刻度准确的特点,使实验实现了一定程度的自动化,大大简化了实验操作。
(3)利用体积法来进行测定,避免了质量法中因称量物质的微小质量而带来的操作难度大、对称量仪器精密度要求高、且要考虑称量过程中因注射器体积变化空气浮力对质量的影响等不利因素,解决了不具备质量法测定氧气摩尔质量实验条件的普通中学的实验设备问题。
(4)利用初中化学中所学基本化学反应原理进行设让实验原理简单,浅显易懂,学生容易理解和接受。实验所用物品均为学生所熟悉,使学生感受到生活中处处有化学,创新就在身边,从而激发学生的创新欲望,培养学生的创新意识和能力。
(5) 一瓶市售医用3%双氧水(lOOmL)售价为1元钱,而每次实验只需3—4mL,实验成本几乎为零,且反应产物为水和氧气,环保无污染。
(6)如果改变实验原理,更换药品后,用同样的操作方法,还能测量其他气体(如H2、C02、Cl2等气体)的摩尔质量。
参考文献:
[1]宋心琦主编.普通高中课程标准实验教科书·化学1(必修)[M]北京:人民教育出版社,2007
[2] 1990年国际温标纯水密度表.http:∥wenku.baiducom/view/39fc7f785 acfalc7aaOOccbc.html
[3]过氧化氢浓度密度对照表.http://wenku.baidu.com/view/af4f8d46a8956bec0975e3be.html.
[4]王发应.常温下气体摩尔体积的测定[J].中学化学教学参考,2012,(10):50~51
- 初中物理教学中提高学生参与度的研究
- 数学学科核心素养
- 让班主任的运气好起来
- 微视频教学在初中英语教学中的运用
- 浅析在新课标背景下如何优化高中化学的教学工作
- 论增强初中《道德与法治》教学实效性的策略
- 文化素质教育及其实践路径研究
- 思维导图在高中生物教学中的应用
- 基于“微课”的翻转课堂模式在高中英语教学中的应用
- 微视频资源在高中物理教学中的应用
- 关于高中英语读写训练教学的实践与思考
- 初中语文微型写作模式“一事一议”的实践研究
- 高中化学教学中学生反思能力的培养研究
- 在初中信息技术课程中采用翻转课堂教学模式的初探
- 用心去做每一位学生的引路导师
- 基于学生个体差异的初中英语分层教学研究
- 打开学生心结,初中班主任德育工作方法的研究
- 新高考形势下高中生物学科核心素养培养探析
- 多媒体环境下初中数学教学策略探析
- 初中作文教学序列化的构建和运用
- 初中语文教师课堂教学语言特点探析
- 浅谈积极心理学视角的初中生心理健康教育理念与实施探讨
- 互联网+农村初中数学课堂教学改革实践探索
- 浅析初中语文教学中学生表达能力的提升策略
- 浅谈生活化教学理念在初中历史教学中的应用
- underbeam
- underbeams
- underbear
- underbearer
- underbearing
- underbeat
- underbeats
- underbed
- underbellies
- underbelly
- under/below
- underbeveling
- underbevelings
- underbevelling
- underbevellings
- underbid
- underbidding
- underbill
- underbillow
- underbillowed
- underbillowing
- underbillows
- underbishop
- underbishops
- underbit
- 锋铓
- 锋铦
- 锋铩
- 锋锐
- 锋锷
- 锋镝
- 锋镝之苦
- 锋镝铸
- 锋镞
- 锋面
- 锋面气旋学说的开宗人
- 锋面降水
- 锋颖
- 锋颖的光焰
- 锋颖较长的毛笔
- 锋驲
- 锋骨
- 锌
- 锌版
- 锌白
- 锌肥
- 锍
- 锍幅子
- 锎
- 锏