摘要:阐述了由镁粉与空气里的氮气反应制备氮化镁的实验设计和原理。针对该传统实验流程过于繁琐、所需时间较长、不适宜在课堂展示等不足进行了改进。实践表明,改进后的实验操作简便,现象明显,适于课堂演示,有利于激发学生的学习兴趣。
关键词:氮化镁;氮气;镁;实验改进
文章编号:1005–6629(2015)3–0050–02 中图分类号:G633.8 文献标识码:B
中学化学在讲授镁元素的相关知识时,给学生介绍了镁在空气中燃烧的相关反应,即分别与氧气、氮气、二氧化碳的反应。通过学习学生对氧化镁的生成反应往往比较熟悉,但对氮化镁的生成却很陌生。因此,在化学兴趣实验课上展示氮化镁的制备及其性质是必要的。笔者根据实验原理设计了实验方案,探讨了设计实验的可行性和有效性,并针对实验效果进行了改进。
1 实验原理及改进的提出
镁和氮气可以直接反应生成氮化镁,氮化镁是黄色固体[1],可以较明显地区别于其他物质的生成。因此该实验检验标准就是:(1)观察有无黄色固体生成;(2)取产物与水反应,若有气体生成则用红色湿润石蕊试纸检验。若试纸变蓝,说明有碱性的氨气生成,则可推测产物中有氮化镁。
实验药品:镁粉和氮气。中学实验室有镁粉,但没有氮气瓶。根据《化工辞典》[2]解释,地面附近干燥空气中成分如下(体积百分率):氧20.93;氮78.10;氩0.93;二氧化碳0.028;其他(氪、氖、氙、甲烷等)0.002。
由于空气中的氧气和二氧化碳均要与镁反应,因此在使用前需要除掉氧气和二氧化碳。
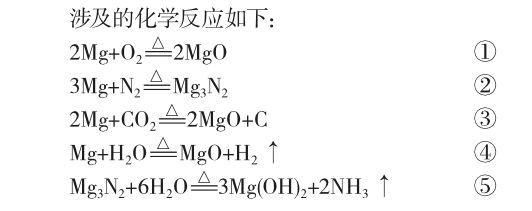
一般做法是:用氢氧化钠溶液除去二氧化碳,用铁粉除去氧气,用浓硫酸干燥,最后将剩余气体(氮气)通入装有镁粉的硬质玻璃管并加热,观察记录现象。很多有关氮化镁制备的实验也是这样做的[3]。笔者在实验室按照这个方案进行了实验,结果并不理想:没有得到黄色固体,在产物中加水,产生的气体能使润湿的红色石蕊试纸变蓝,说明只有极少量的氮化镁生成。而且该流程过于繁琐,所需时间较长,不适宜在课堂展示。于是笔者对该实验进行了简化和改进。
2 实验用品
带铁圈的铁架台1个、酒精灯1盏、石棉网1张、烧杯(500mL)1个、烧杯(50mL)1个、火柴1盒、红色石蕊试纸若干、镁粉、镁条
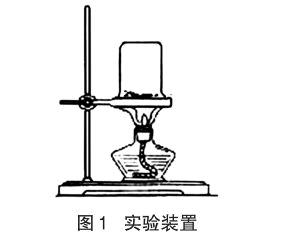
3 实验装置
示意图见图1。
4 实验步骤
(1)取5g镁粉平铺在石棉网上(厚约2mm)。
(2)用点燃的镁条引燃镁粉。
(3)待镁粉引燃后,立即用烧杯盖住镁粉,使镁粉与外界空气近乎隔离。
(4)将燃烧生成物取少量置于试管中,加入适量水,将润湿的红色石蕊试纸置于试管口,观察试纸是否变色。
5 实验现象及分析
见图2、图3、图4。可观察到:镁粉表层燃烧,有火星,生成白色固体(MgO);燃烧面逐渐蔓延扩大,最后所有镁粉呈红热状,烧杯壁很烫,反应放出大量的热;烧杯中有大量的白烟生成;反应结束冷却后,产物呈块状,表层呈白色(MgO),白色固体表层下有大量黄色固体生成,还有少量黑色粉末(未反应完全的镁粉);向产物中加入水后,有大量气泡生成,并有刺激性气味,润湿的红色石蕊试纸变蓝。

由于氧气比氮气活泼,反应开始时,镁粉先与烧杯中活泼的氧气反应,生成白色的氧化镁(MgO)。烧杯中的氧气反应完之后,过量的镁粉继续和氮气反应,由于反应放出大量的热,使反应物呈红热状。该反应很快,烧杯可以起到一定的阻隔空气交换的作用,间接提高了烧杯中氮气的浓度,使尽可能多的镁粉与氮气反应,确保反应的主要产物是Mg3N2。反应结束后有较多的Mg3N2(黄色固体)生成。
6 改进后的优点
(1)操作简便,实验条件要求不高,现象明显,适于课堂演示。
(2)安全性易于保证。
(3)可重复性强,试验几乎都可以成功。
(4)产物量大,原料利用率较高。
参考文献:
[1]吴孙富.镁条与镁粉燃烧实验的比较及有关应用[J].中学化学,2004,(2).
[2]王箴.化工辞典(第四版)[M].北京:化学工业出版社,2000.
[3] 2008年普通高等学校招生全国统一考试(海南卷)第16题.
- 高中英语词汇教学中的“语块”教学启示
- 在初中英语教学中培养学生的创新能力
- 多退后观察 少站台指挥
- 浅析如何提升初中英语口语课堂教学的质量
- 浅谈高考英语听力应试技巧
- 初中英语教学中的学生兴趣培养方法浅析
- 浅谈高中英语词汇量的记忆法
- 研究性教学理念下的高中英语语法教学
- 对话教学,让课堂“动”起来
- 对于2015江苏高考语文名著题的一点思考
- 初中语文探究性学习方式初探
- 构建生活化语文大课堂教学的实践研究
- 写景散文教学内容的确定
- 厚重积淀华美篇章
- 今天你“下水”了吗?
- 初中语文教学中语感的培养与迁移
- 高中语文教学中的合作学习教学组织策略分析
- 倾听思维花开的声音
- 让“欣赏”点燃高中语文课堂
- 接受美学在中学阅读教学中的应用探微
- 语文教学如何有效贯彻口语教学
- 初中语文教学应读写并重
- 浅析古今词义的差异
- 浅析分层教学法在高中作文教学中的应用
- 初中语文个性化作业设计形式新探
- overponderousnesses
- overpopular
- overpopularities
- overpopularity
- overpopularly
- overpopulated
- overpopulation
- overpopulous
- overpopulously
- overpopulousness
- overpopulousnesses
- over-positive
- overpositive
- overpositively
- overpositiveness
- overpositivenesses
- overpost
- overpotencies
- overpotency
- overpotent
- overpotential
- overpower
- overpowered
- overpowerful
- over-powerful
- 应诏回答帝王的问难
- 应诏而赋成
- 应试
- 应试教育
- 应试求取功名
- 应试的文字
- 应试考中
- 应试落第
- 应该
- 应该享受的不容侵犯的权利
- 应该做的事
- 应该列入或提到的因疏忽而没有列入或提到
- 应该大胆去做
- 应该安守本分,为人做事诚恳,不投机取巧
- 应该应分
- 应该有的全有了
- 应该知道
- 应请
- 应诺
- 应诺句
- 应诺声
- 应谊
- 应谐
- 应谢
- 应谶