摘要:试图以“弱电解质的电离”为例,说明基于化学学科观念的化学课堂教学实施的策略。分别从课堂教学目标的设计、真实问题情境的创设、探究活动的实施和化学问题解决等方面予以阐述。
关键词:弱电解质的电离平衡;学科观念;化学教学
文章编号:1005–6629(2016)3–0045–04 中图分类号:G633.8 文献标识码:B
1 问题的提出
《普通高中化学课程标准》要求学生:了解化学科学发展的主要线索,理解基本的化学概念和原理,认识化学现象的本质,理解化学变化的基本规律,形成有关化学科学的基本观念。使学生形成化学科学的基本观念是高中化学新课程的一个重要教学目标。然而,目前中学化学教师普遍认为:化学课堂教学就是教给学生具体的化学知识,特别是高考涉及的化学知识。其实,化学学科知识的教学是必要的,但是让学生掌握知识不应该成为最终目标。英国哲学家怀特海说:教育就是忘记了在学校所学的之后剩下的东西。由此我们应该思考的是“什么是学生通过中学化学课程的学习不会忘记的”。零散的化学学科知识、片段性的化学概念或事实是很容易被忘记的,学生不会忘记的是学科观念、学科特征的思维习惯和解决问题的方法。“任何一个研究领域的知识体系都是由经验要素(科学事实)、理论要素(科学理论)和观念要素(科学观念)3种成分组成的。科学观念凝聚着所在领域科学思想的精华,是科学知识体系中更本质的东西,处于核心的地位”。对于“弱电解质的电离平衡”的教学已有不少讨论,本文从基于化学学科观念教学的视角,结合“弱电解质的电离平衡”的课堂教学,探讨在化学课堂教学中如何对学生进行学科观念教育,以期对中学化学课堂教学改革做些有益的尝试。
2 基于化学学科观念的化学课堂教学策略
2.1 课堂教学目标中包含化学学科观念
新课程倡导从知识与技能、过程与方法、情感态度与价值观三维建构课堂教学目标。但是,日常教学中教师制定的课堂教学目标主要还是围绕着“知识与技能”目标的达成而设计的,即使涉及“过程与方法、情感态度与价值观”维度的目标也是浮在表面的,缺乏可行性。
基于化学学科观念的课堂教学应在制定教学目标时,把化学学科观念的形成作为化学课堂的教学目标。例如,“弱电解质的电离平衡”的教学,学生通过必修1的学习已经知道了氯化氢是强电解质,能完全电离;醋酸是弱电解质,不能完全电离。醋酸的电离程度、醋酸电离过程中的热效应、醋酸不能完全电离的本质原因、醋酸电离平衡的影响因素及电离平衡的移动等是本节课的教学内容。而这些内容的主动获取需要学生通过实验探究、交流讨论(争论)、问题解决等学习活动才能完成。基于以上思考,“弱电解质的电离平衡”可设计以下教学目标:(1)能从宏观与微观相结合的视角描述和解释弱电解质的电离平衡。(2)能通过实验获取“弱电解质电离平衡”的证据,并基于证据推理。(3)能应用化学平衡移动原理,解释弱电解质电离平衡的移动。
通过服务于上述教学目标的“弱电解质的电离平衡”的课堂教学,学生可以感悟“宏微结合”是认识物质的重要的思维视角;通过“弱电解质存在电离平衡”的实验探究,学生可以感悟“化学实验是化学研究的重要方法”、“化学研究通过观察和实验获取证据,基于证据推理形成结论”、“化学实验需要控制变量”等学科观念;通过对醋酸电离平衡移动的认识,学生可以感悟到认识物质及其变化规律的“模型化方法”,形成“物质是不停变化运动的、物质的变化是有条件的、物质变化过程中遵循着一定的规律”等观念。
2.2 在真实而有意义的问题情境中建构学科观念
学生是否建构了学科观念,首先学生要认同观念,其次学生要能运用学科观念去解决真实而有意义的实际问题。学科观念的建构不是将其当成知识进行讲述就能完成的。必须倡导让学生“在真实而有意义的实际情境问题解决中应用学科观念”。因此,基于化学学科观念建构的课堂教学,应创设真实而有意义的实际问题情境。
“弱电解质的电离平衡”的课堂教学可创设如下问题情境:室温下,用0.100 mol/L NaOH溶液分别滴定20mL 0.100 mol/L HCl、20mL 0.100 mol/L CH3COOH溶液,得到滴定曲线如图所示。观察两滴定曲线异同,并与同学讨论导致两滴定曲线的异同的原因。
NaOH滴定盐酸、CH3COOH溶液的滴定曲线的绘制,是一个真实而有意义的问题情境。其基本过程是用一定物质的量浓度的NaOH分别滴定一定物质的量浓度的盐酸、CH3COOH溶液,记录加入一定体积的NaOH溶液时溶液的pH,以NaOH溶液的体积为横坐标,溶液pH为纵坐标绘制曲线。学生通过对滴定曲线的观察,根据观察得到的事实(证据),通过宏观-微观相结合的方法,运用结构决定性质的学科观念,进行分析推理形成结论,这一“观察事实-获取证据-形成结论”的过程就是应用化学学科观念解决问题的过程。
学生对滴定曲线的观察过程是对学生观察品质的全面性和深刻性的培养过程,观察结果的表述培养了学生的表达能力。学生通过认真而慎密的观察,可以得到下列观察结果(证据):
证据(1):V(NaOH)=0mL时,滴定曲线Ⅰ的pH约为2.8,滴定曲线Ⅱ的pH=1;
证据(2):V(NaOH)=10mL前后,滴定曲线Ⅰ相对平坦,滴定曲线Ⅱ相对陡峭;
证据(3):V(NaOH)=20mL时,滴定曲线Ⅰ的pH>7,滴定曲线Ⅱ的pH=7;
学生根据证据进行推理形成结论,必须从盐酸和醋酸在水溶液中存在的微粒、微粒间相互作用,溶液中存在质量守恒和电荷守恒,电离平衡等方面进行结合分析,经历基于证据进行推理的过程。
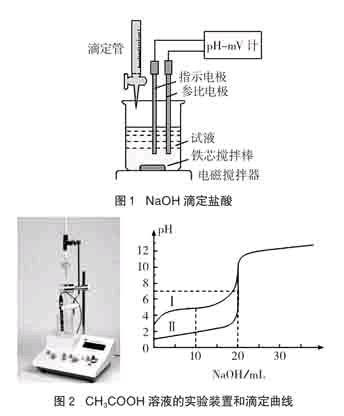
根据证据(1)可以得出结论:HCl在水中是完全电离的(0.100 mol/L HCl溶液pH=1),而CH3COOH在水中是部分电离的(0.100 mol/L CH3COOH溶液pH约为2.8),说明醋酸在水中存在电离平衡:
CH3COOH CH3COO-+H+
醋酸在水中存在电离平衡的微观解释是:在水溶液中存在着两个反应,一是CH3COOH分子电离生成CH3COO-和H+,二是CH3COO-和H+结合成CH3COOH分子,当两个反应速率相等时形成了醋酸的电离平衡;醋酸存在电离平衡的宏观解释是:a mol/L CH3COOH溶液的pH>-lg(a),溶液中存在一定量的CH3COOH没有发生电离,存在醋酸电离平衡。
根据证据(2)可以得出结论:醋酸在水溶液中存在电离平衡。因为向20mL 0.100 mol/L CH3COOH溶液中加入10mL 0.100 mol/L NaOH溶液得到的是等物质的量浓度的CH3COOH和CH3COONa的混合溶液,从醋酸电离平衡表达式可以看出,在该混合溶液中加少量的NaOH,NaOH与CH3COOH结合生成CH3COONa和H2O,而对溶液的pH影响不大,在滴定曲线上表现为较平坦。
根据证据(3)可以得出结论:HCl在水中是完全电离,醋酸在水溶液中存在电离平衡。因为向20mL 0.100 mol/L HCl中加入20mL 0.100 mol/L NaOH溶液,反应后得到NaCl溶液,HCl完全电离生成的H+全部被NaOH完全电离生成的OH-中和生成水,溶液的pH=7;向20mL 0.100 mol/L CH3COOH溶液中加入20mL 0.100 mol/L NaOH溶液,反应后得到CH3COONa溶液,由于醋酸存在电离平衡,溶液存在少量CH3COOH没有电离,NaOH完全电离生成的OH-中和CH3COOH电离生成的H+反应后仍有剩余,因而溶液的pH>7。
实际课堂教学中,学生通过教师引导下的交流讨论,独立思考,分析推理,形成“醋酸是弱电解质,在水中存在电离平衡,实验可以提供醋酸电离平衡的证据,醋酸的电离平衡可以从宏观和微观等方面给予解释”的知识体系,而该知识体系的建构过程中,学生充分应用“物质的结构决定性质、化学变化遵循守恒和平衡等规律”等化学学科观念。
2.3 实验探究活动中融合化学学科观念
实验探究活动需要学生围绕探究目的设计实验方案,需要收集证据并基于证据进行推理而得出结论,这些过程都是建构和应用化学学科观念的最佳载体。在“弱电解质的电离平衡”教学中,通过上述情境问题的解决,学生已经得出这样的结论:根据0.100 mol/L CH3COOH溶液pH>1,CH3COONa溶液pH>7,可以说明醋酸在水溶液中存在电离平衡。由此可适时引导学生进行实验探究:(1)实验探究证明醋酸在水溶液中存在电离平衡;(2)实验探究条件改变对醋酸电离平衡移动的影响。
实验探究活动1:证明醋酸在水溶液中存在电离平衡
教学中让学生证明醋酸确实存在电离平衡,要引导学生从微观本质上进行分析,如果醋酸在水溶液中存在电离平衡,将会导致醋酸溶液具有哪些宏观现象?或醋酸在水溶液中表现出哪些性质才能得出醋酸存在电离平衡的结论?解决这样的问题的过程实质上是“寻找支撑结论的证据”的过程,其思考解决问题的过程为:“若醋酸溶液中存在电离平衡,则一定有……,可通过‘……实验测定……”。例如,若醋酸溶液中存在电离平衡,则c(H+)
(1)分别测定0.1 mol/L HCl和0.1 mol/L CH3COOH溶液的pH。
(2)向0.1 mol/L HCl和0.1 mol/L CH3COOH中分别加入足量镁粉(或锌粉),比较产生气体速率快慢。
(3)向0.1 mol/L HCl和0.1 mol/L CH3COOH中分别加入足量CaCO3粉末,比较产生气体的速率快慢。
(4)向等体积、等pH的HCl和CH3COOH溶液中加入足量镁粉(或锌粉),比较反应完全放出H2总量的多少。
(5)向等体积、等pH的HCl和CH3COOH溶液中加入足量CaCO3粉末,比较反应完全放出CO2总量的多少。
(6)测量0.1 mol/L CH3COONa和NaCl溶液的pH。
(7)向0.1 mol/L HCl溶液中分别加入少量NaCl和CH3COONa固体粉末,测量比较两溶液的pH。
实验探究活动2:条件改变对醋酸电离平衡移动的影响
探究条件改变对醋酸电离平衡的影响,就是将化学平衡移动理论迁移应用到醋酸电离平衡移动的问题解决中,再通过实验验证温度、反应物和生成物的浓度的改变对醋酸电离平衡移动的影响。教学中学生设计条件改变对醋酸电离平衡移动影响的实验探究方案,能有效建立“化学变化是有条件的,条件改变所产生的平衡移动的宏观现象可以从电离平衡的微观结构进行解释和说明”等学科观念。实际教学中,可引导学生通过交流讨论,设计出如下方案:
(1)温度对醋酸电离平衡移动的影响:分别测量10℃、20℃、30℃时0.01 mol/L CH3COOH溶液的pH。
(2)醋酸浓度对醋酸电离平衡移动的影响:向0.01 mol/L CH3COOH溶液中加入几滴冰醋酸,测量比较冰醋酸加入前后溶液的pH。
(3)醋酸根浓度对醋酸电离平衡移动的影响:向0.01 mol/L CH3COOH溶液中加入少量固体醋酸钠,测量比较醋酸钠固体加入前后溶液的pH。
2.4 在问题解决中应用化学学科观念
“弱电解质的电离平衡”的教学目标是学生能运用化学学科观念和化学知识解决问题,在实际教学中可以安排学生通过课堂讨论或课后独立完成下列问题的解决来实现教学目标:
(1)向等体积的pH=3的HCl和CH3COOH溶液中加入9倍酸溶液体积的水稀释,请预测稀释前后醋酸和盐酸溶液的pH变化,并进行解释。

学生解决“醋酸溶液加水稀释电离平衡移动”的问题有多种方法:
方法1:微观结构解释。醋酸加水稀释后,CH3COO-和H+结合成CH3COOH分子的反应速率减慢的幅度远大于CH3COOH分子电离生成CH3COO-和H+的减慢幅度,导致电离平衡正向移动。


上述分析不难发现,学生在问题解决中需要从宏观与微观相结合的视角,应用物质结构决定性质、化学变化中守恒与平衡等化学学科观念分析醋酸溶液中的电离平衡及电离平衡移动的原因,学生应用化学学科观念的能力得到有效提高。
3 结语
化学学科观念建构不是让教师抛弃化学知识与技能的教学,反而需要教师更加深刻理解所教化学知识的学科价值和育人价值,将化学学科观念的应用融合在教学的整体设计中。化学学科观念建构不能一蹴而就,需要渗透在教师对知识与技能的教学中,在学生运用知识和技能解决化学实际问题中。化学学科观念的建构是一个长期而复杂的教育工程,需要教师从思想上、观念上重视起来并运用自己的智慧不断的将化学学科观念建构与运用落实到教学实践中去。
参考文献:
[1]吴俊明,吴敏.为什么要关注科学观念——关于科学观念和科学观念教育的思考之一[J].化学教学,2014,(4):3~6.
[2]韦明新,郑雪鹤.醋酸电离平衡的温度影响及其热力学分析[J].九江师专学报,1987,(2):36~40.
[3]何彩霞.以化学观念为统领设计教学活动——对“弱电解质的电离”教学课例的再研究[J].化学教育,2013,(1):16~18.
- 分组分享教学法在高中体育教学中的应用实践
- 论初中数学教师如何对学生实施分层教学
- “引导探究感悟”教学模式在初中物理中的应用
- 浅谈交流—互动视域下的初中英语有效教学
- 强化创新意识转变教育行为
- 只等鲜花绽放时群芳斗艳我最强
- 浅谈朗读对小学语文教学的重要性
- 合作学习模式在小学语文写作教学中的应用探析
- 基于“以说促写”方法的初中生英语写作能力培养
- 农村高中英语阅读教学中跨文化意识培养策略的研究
- 学生数学反思能力的培养与实践探索
- 探究初中英语有效阅读教学模式的应用
- 浅谈初中语文古诗词有效教学的策略
- 高效,教学的永恒追求
- 寻求“契合点”谈语文教学问题的生成
- 新课程背景下初中数学例题教学设计分析
- 浅谈如何提高钳工教学的质量
- 浅谈提高初中体育教学有效性的途径
- 初中物理实验导入的具体做法
- 合作学习在小学语文教学中的应用
- 论如何帮助初中生掌握英语音标
- 谈高中英语词汇教学的激活策略
- 高中数学教学中数形结合思想的应用研究
- 谈对初中英语学困生转化的几点认识
- 浅析探究式教学在高中历史教学中的应用
- disinfections
- disinfection's
- disinfective
- disinfector,disinfecter
- disinfectors
- disinfects
- disinfestation
- disinflation
- disinflationary
- disinflation's
- disinformation
- disinhabit
- disinherit
- disinheritable
- disinheritance
- disinheritances
- disinheritance's
- disinherited
- disinheriting
- disinherits
- disinhibitory
- disinhume
- disintegrable
- disintegrate
- disintegrated
- 秀木
- 秀杰
- 秀格
- 秀毛
- 秀气
- 秀水
- 秀水明山
- 秀洁
- 秀活
- 秀润
- 秀澈
- 秀玉
- 秀甲
- 秀的棒
- 秀眉
- 秀眉玉颊
- 秀穗
- 秀立
- 秀竹
- 秀简
- 秀粹
- 秀约
- 秀绝
- 秀绝时流
- 秀美