摘要:对中学教学中出现的“N和Cl元素非金属性孰强孰弱”的困惑进行了深入思考,诠释了“活泼性”与“非金属性”的差异,巧用水解反应原理、电负性及电子效应的相关概念,阐述了N与Cl非金属性强弱的变化。基于对相关反应历程的探讨,揭示了NCl3、NOCl、NO2Cl水解反应的机理本质,认为N和Cl非金属性的强弱随环境变化而变化。
关键词:氯氮的非金属性;水解反应;元素性质比较;化学教学研讨
文章编号:1005–6629(2017)9–0077–04 中图分类号:G633.8 文献标识码:B
1 问题提出
1998年第5期《化学教学》中刊登了林其虎老师关于“氧元素的非金属性比氯元素强,但氯气比氧气活泼”的一篇文章[1],2011年第11期《化学教学》中刊登了张新中老师关于“非金属性与非金属活动性两者不同概念”的一篇文章[2]。两篇文章均指出非金属性所指的对象为“元素”,非金属活动性(或称活泼性)所指的对象为“单质”,比较不同元素的非金属性强弱与相应不同元素所组成单质的活动性强弱可能出现不一致的情况。同样,学生在分析氯和氮两种元素的非金属性强弱时,出现了这些问题:“Cl2比N2更加活泼,所以非金属性:Cl>N”;“元素最高价氧化物对应水化物的酸性:HClO4>HNO3,所以非金属性:Cl>N”;“NCl3水解的实验结果得到NH3和HClO,由元素化合价入手,N为-3价,Cl为+1价,所以非金属性:N>Cl”。不同的判断依据导致不同的结论,学生只能陷入两难状态:“N和Cl非金属性到底谁强”。对此,本文从电子效应和反应机理历程角度进行了深入思考,展示科学思维的表达过程。
2 概念辨析
2.1 非金属性强弱判断依据
由非金属单质的活泼性大小来推断非金属性强弱的思维逻辑存在不一定的情况,不能作为判断依据。而元素最高价氧化物对应水化物的酸性强弱,可以作为非金属性强弱判断的逻辑依据,酸的强度HClO4>HCl>HNO3>H2SO4[3],由此得到Cl的非金属性强于N。至于NCl3的水解情况能否作为非金属性强弱判断的依据呢?
2.2 水解反应的原理
“水解反应”就是离子型或共价型的化合物和H2O发生复分解反应,显正电性的部分与H2O中的OH-结合,显负电性的部分与H2O的H+结合。但是,水解后的产物是否稳定,是否发生歧化反应,是否发生产物与过量反应物之间的络合反应,是否发生产物与产物之间的氧化还原反应等,情况较为复杂。例如,ICl水解得HCl和HIO,后者发生歧化反应生成HIO3和I2单质;XeF2水解成HF和Xe(OH)2,后者分解成Xe(g)和O2(g);SiF4水解得到HF和H4SiO4,HF能和尚未水解的SiF4结合成H2SiF6。可见,“水解反应”不是简单的复分解反应,它同时伴有“连续反应”的发生,而且类型复杂。NCl3水解得到的NH3和HClO,两者之间发生氧化还原反应,反应的酸碱性环境将影响产物,氧化产物可能为N2H4或N2,还原产物为Cl-或HCl,反应的化学方程式如下:2NH3+3HClO=N2↑+3HCl+3H2O或2NH3+HClO+OH-=N2H4+ Cl-+2H2O。
综上分析,由NCl3水解的实验结果来看,NCl3中N显负电性,Cl显正电性,所以N的非金属性比Cl强。结论的矛盾性还是存在,这到底是怎么回事呢?
2.3 原子轨道杂化方式
查得不同的元素電负性值列表如下[4]:
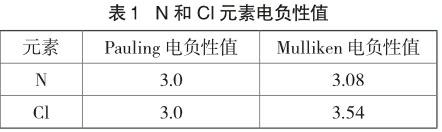
Pauling数值显示N和Cl元素的电负性相同,都是3.0。Mulliken数值显示Cl元素电负性略大于N元素,但相差不大。电负性是指元素原子在分子中对成键电子的吸引能力,而影响元素电负性的主要因素是原子用来接收电子的轨道的能量[5],原子轨道能量的变化取决于原子周围环境的变化,如原子轨道的杂化方式或诱导、共轭等效应对电负性数值改变的影响。
同一原子轨道杂化方式不同,其对成键电子的吸引力也不同。例如,C原子分别采用sp、sp2、sp3杂化时,其对应的轨道能量大小为:sp

3 NCl3水解机理
NCl3是淡黄色液体,熔点-40℃,沸点71℃,有刺激性气味,分子偶极矩0.6D,较NH3分子(偶极矩1.47D)小。氨为极性分子,H2O分子比氨具有更强极性,其偶极矩1.8D,说明NCl3偶极矩很小,近乎为非极性分子,易溶于CCl4、苯等有机溶剂中[8],这点也证明了N与Cl原子的电负性数值相差很小。
常温下NCl3在水或碱中能发生水解,生成NH3和HClO或NaClO,其机理过程为亲电取代。NCl3中Cl为亲电点,H2O中O为亲核点,水中氧原子2p轨道上的孤电子对进攻Cl原子上3d空轨道形成配位键,NCl3中N原子2p轨道上的孤电子对能进攻H2O中H原子轨道形成共价键,这“一送一拉”是条最省力的途径,形成N-H和Cl-O两个新的共价键,而N-Cl旧键就容易断裂,新的产物NH3和HClO就生成了,如图1所示:

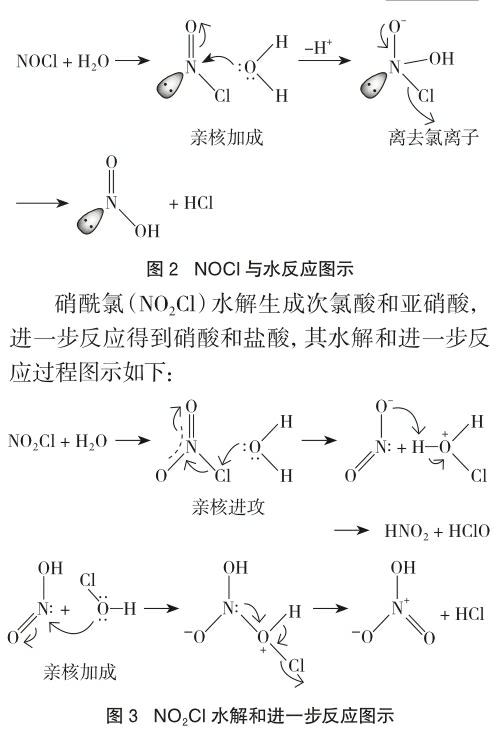
由上述机理和实验结果可见,在NOCl和NO2Cl分子中N元素由于受到电负性更强的O元素吸引明显表现出正电性(即正价),Cl原子周围的环境比NCl3更加复杂,在NOCl中N原子表现的亲电性比Cl强,水解时水分子对N原子直接亲核加成(结构中-N=O双键类似双键C=O),而不是对Cl原子亲核进攻,区别于NCl3的水解,因此,NOCl中Cl元素的化合价可视为-1价,N元素为+3价;在NO2Cl中Cl原子的親电性又比N强,可能原因是O-N-O中的离域π键增强了N原子上的电子密度,使N原子上的电正性有所下降,亲电性也跟着减弱,上述表格中的键角和键长参数也能够说明这点变化。因此,水解时,水分子对Cl原子的3d空轨道直接亲核进攻,表现出了与NCl3水解过程的相似性,Cl元素的化合价可视为+1价,N元素为+3,生成HClO和HNO2。接下去又发生了氧化还原反应(即图示的亲核加成过程)生成了HCl和HNO3,所以,从总的结果看NO2Cl中Cl元素化合价又可视为-1价,N元素为+5价。
总之,在实验结果的基础上,将有机反应机理巧妙地运用于各种含氮氯分子与水分子相互作用的分析,可以很好地解释其作用机理,实现从宏观到微观过程的理解和思考,从而能够辩证地看待N和Cl两种元素的非金属性强弱,处于伯仲之间,且随着周围环境的变化而变化,而不至于陷入所谓“N非金属性比Cl强”或“Cl非金属性比N强”的片面单纯的记忆性知识的误区。
参考文献:
[1]林其虎.比较氧元素和氯元素的非金属性[J].化学教学,1998,(5):41~42.
[2]张新中.关于非金属性和非金属活动性的辨析[J].化学教学,2011,(11):71~72.
[3]北京师范大学等编.无机化学(上册)[M].北京:高等教育出版社,1992:82.
[4][5][美]安斯林·道尔蒂著.计国祯,佟振合等译.现代物理有机化学[M].北京:高等教育出版社,2009:12.
[6]严宣申等.普通无机化学[M].北京:北京大学出版社,2006:83.
[7][9][英] N. N. Greenwood, A. Earnshaw著. Chemistry of the Elements(中册)[M].北京:高等教育出版社,1996:532~533,56~58.
[8]刘新锦等.无机元素化学[M].北京:科学出版社,2005:101~102.
- 关于内部环境的建设对创业企业的重要性
- 智能制造是时代赋予的必答卷
- 通用飞机商业策划与实施的常见问题思考
- 运用网络创新企业宣传工作模式探究
- 论合同管理在企业经济管理中的重要性
- 如何精准运用监督执纪“四种形态”
- 论如何做好国有企业纪检监察工作
- 提升企业监督执纪人员发现“四风”及违纪问题能力的思考
- 新时代深化信访改革化解信访矛盾的方式方法
- 标准化班组建设在新驿煤矿的探索和实践
- 农民工工资拖欠问题及解决办法研究
- 新时期军队离退休干部服务服务管理工作的问题及对策研究
- 创建“二二一三”工作机制全面推进监督执纪问责高质量发展
- 新常态下事业单位人事管理工作提升对策思考
- 子公司重大事项报告管理机制研究
- 事业单位编制管理问题及改进对策研究
- 行政精细化管理策略建议分析
- 论基层领导班子成员如何相处共事
- 工商管理在市场经济中的重要性分析
- 新形势下电力企业纪检监察工作的思考
- 做好人社工作 彰显人社担当
- 企业绩效管理在全面预算管理中的作用探讨
- “三大变革”引领企业转型升级
- 新形势下做好国有企业组织人事工作的思考
- 助力小人物的大梦想 培育天山下的追梦人
- unidealistic
- unidealistically
- unidentate
- unidentical
- unidentically
- unidentifiably
- unidentified
- unidentifying
- unideological
- unidimensionality
- unidiomatically
- unidle
- unidler
- unidlest
- unidling
- unidly
- unidolatrous
- unidolized
- unidyllic
- unification
- unified
- unifiers
- unifies
- uniform
- uniformation
- 贵任
- 贵伙
- 贵位
- 贵体
- 贵体不快,还望珍摄
- 贵体康强
- 贵体新痊,诸唯自摄
- 贵体违和
- 贵体违和,万望珍重
- 贵侈
- 贵僚
- 贵僚好
- 贵兆
- 贵先
- 贵党
- 贵公
- 贵其所以贵者贵。
- 贵兽
- 贵冗
- 贵农贱商
- 贵冠
- 贵冠履,忘头足
- 贵出贩收
- 贵势
- 贵县