摘 要 以羧基化CdTe/ZnSe量子点荧光微球为荧光标记物,采用1乙基(3二甲基氨基丙基)碳酰二亚胺(EDC)法偶联抗恶性疟原虫富组氨酸蛋白(Pf)单克隆抗体制备荧光探针;以羊抗恶性疟原虫组氨酸多克隆抗体和驴抗鼠二抗分别喷涂硝酸纤维膜,形成试纸条检测线和质控线,建立了免疫层析试纸条定量检测血清中恶性疟原虫的方法。所使用的羧基化量子点荧光微球的荧光强度为单个量子点的2800倍。实验结果表明,该荧光试纸条定量检测血清中恶性疟原虫线性范围为5.8~8010 Parasite/μL,最低灵敏度达到5.8 Parasite/μL, 单个样品检测时间只需15 min。加标回收实验显示,试纸条批内回收率为93.0%~111.8%,批间回收率为98.3%~115.1%,且批内、批间的相对标准偏差均小于5%。
关键词 量子点荧光微球; 免疫层析试纸条; 恶性疟原虫; 定量检测
1 引 言
疟疾(Malaria)是一种由疟原虫引起的红细胞内寄生虫病,其中90%由恶性疟原虫(Plasmodium falciparum,Pf)侵染造成[1,2]。该病由携带疟原虫的按蚊通过叮咬方式进行传播,是目前在全球范围内造成死亡人数最多的一种寄生虫病。疟疾常见的诊断方法包括以镜检法为基础的病原学诊断、以抗原抗体特异性反应为基础的免疫学诊断以及以聚合酶链式反应(PCR)为代表的分子生物学诊断方法。传统的镜检方法是疟疾诊断的金标准方法,但该方法检测周期长,对操作人员的专业技能要求较高,且平均灵敏度只有50~100 Parasite/μL,因此不能适应当前疟疾快速诊断的临床需求[3,4]。PCR方法检测灵敏度较高,且可以确定疟原虫的种属,对疟疾的有效防治具有较大的指导作用;但该方法检测疟原虫需要特殊的设备及实验室环境的支持,对操作人员实验技能要求较高,不适合基层医院及现场的即时检验(Pointofcare testing, POCT)[5,6]。
以胶体金为标记物的免疫层析方法,因具有快速、使用简单等优点[7],已逐渐应用于疟疾的现场诊断,目前约有30余种胶体金免疫层析试纸条商品。但常规胶体金免疫层析试纸条检测疟原虫灵敏度普遍偏低,只有50~100 Parasite/μL [8],且易受血样基质及外界条件的干扰而出现漏检现象。因此,在一定程度上限制了其推广使用。新型荧光标记物(如荧光微球等)能有效消除有色样品本底的基质干扰, 提高检测灵敏度,是目前免疫层析方法定量检测的首选标记物之一[9]。李怀明等[10]曾采用Ru(4,7Ph2phen)3 染料掺杂的荧光硅球为探针, 建立了猪尿中盐酸克伦特罗的免疫层析试纸条定量检测方法,检测灵敏度远高于胶体金免疫层析试纸条定性检测方法。量子点(Quantum dots,QDs)作为一种新型的荧光标记材料,具有激发光波长范围宽、斯托克位移大、荧光谱峰狭窄对称及耐光漂白等优良的光学特质[11],已广泛应用于提高免疫层析方法的检测灵敏度。如Beloglazova等[12]将QDs作为免疫探针用于免疫层析试纸条法检测玉米赤霉烯酮,灵敏度为0.03 ng/mL。崔希等[13]将免疫磁分离结合胶体金免疫层析方法快速测定大肠杆菌。量子点微球(Quantumdot submicrobeads,QBs)通过将大量的量子点包裹于聚合物微球中,使得荧光强度进一步提高,由于包有聚合物的外层,亦进一步增强了QBs光学及溶液稳定性[14]。Zhang等[15]以QBs为探针,建立了基于膜片的乙肝表面抗原斑点杂交免疫学检测方法,检测限达到0.078 ng/mL。本实验室以QBs为探针,建立了免疫层析试纸条检测食品中黄曲霉毒素B1的方法,灵敏度高达0.42 pg/mL[16]。本研究以Pf中富组氨酸蛋白(HRPⅡ)为检测抗原,以CdTe/ZnSe QBs标记抗HRPⅡ单克隆抗体,建立了基于QBs为探针的免疫层析试纸条超灵敏快速定量检测血清中Pf的方法。
2 实验部分
2.1 仪器与试剂
XY Z3000点膜仪(BioDot公司);自动切条仪(金标生物科技公司);粒径分析仪(英国马尔文公司);JEOL JEM 2100高分辨率透射电子显微镜(日本电子株式会社);便携式荧光试纸条读取仪(上海互帼科学仪器有限公司);硝酸纤维膜( NC 膜) 、结合垫、吸水纸及PVC底板(美国Millipore公司)。
表面羧基修饰的CdTe/ZnSe量子点聚合物微球(QBs,美国Ocean Nnotech.公司赠送);灭活的Pf阳性血清(美国夏威夷大学George Hui教授提供, 浓度为2.4×105 Parasite/μL);鼠抗HRPⅡ单克隆抗体(Mouse antiHRPⅡ mAb)与羊抗Pf多克隆抗体(Goat antiHRPⅡ pAb)由北京金源佳和生物科技有限公司免费提供;驴抗鼠二抗(北京中山生物科技公司);人血清(索莱宝公司);牛血清白蛋白(BSA)、乙基(3二甲基丙基)碳二亚胺盐酸盐(EDC,sigma公司);其它试剂均为分析纯。
2.2 QBs标记探针的制备
采用EDC一步法[17]将QBs上的羧基与鼠抗HRPⅡ单克隆抗体上的氨基进行偶联。具体步骤如下:将0.6 mg QBs、40 μg EDC与10 mL PB缓冲液(pH 6.0, 0.01 mol/L)混匀后,加入120 μg鼠抗HRPⅡ单克隆抗体;室温搅拌反应45 min后继续加入40 μg EDC以及1.2 mL 10% (w/V)BSA溶液进行封闭反应2 h;反应溶液以13000 r/min 离心10 min,2 mL 超纯水洗涤沉淀,离心,沉淀复溶于2 mL PBS(pH 7.4,0.01 mol/L,含2%果糖,1%聚乙二醇2000, 5%蔗糖,1% BSA,0.4%吐温20)中,4 ℃保存备用。
将不同浓度羊抗HRPⅡ多克隆抗体(0.5, 1.0和1.5 g/L)和驴抗鼠二抗(0.5 g/L)分别喷凃于NC膜上作为Pf检测线(T线)和质控线(C线),NC膜于37℃干燥12 h。将预处理好的NC膜、结合垫以及吸水纸依次粘贴在PVC 底板上,使用自动切条机将其切成宽度为4 mm的试纸条,室温干燥保存备用。[TS(][HT5”SS] 图1 免疫层析试纸条检测原理(A为阳性,B为阴性)
Fig.1 Schematic diagram of immunochromatographic strips
1. 结合垫(Conjugate pad); 2. PVC底板(PVC plate); 3. 硼酸纤维膜(Nitrocellulse membrane); 4. 检测线(Test line); 5. 质控线(Control line); 6. 吸水纸(Absorbent pad)。A: Positive sample,B: Negative sample.[HT5][TS)]
血清中Pf检测流程如图1所示。将1.5 μL QBs探针与68.5 μL血清混合孵育5 min后,加到试纸条结合垫上,室温反应10 min后,荧光试纸条读取仪读取试纸条T、C线荧光强度。当血清中含有Pf时,QBs探针上的鼠抗HRPⅡI单克隆抗体与HRPⅡ蛋白结合,免疫复合物经NC膜迁移至试纸条T线区域与羊抗HRPⅡ多克隆抗体结合,形成双抗体夹心免疫复合物,T线出现荧光条带,荧光强度与Pf浓度呈正相关(未出现Hook效应之前);反之,则QBs探针不能被T线上的羊抗HRPⅡ多克隆抗体捕获,T线无荧光条带,未被T线捕获的QBs探针进一步迁移至试纸条C线区域,与C线上的驴抗鼠二抗结合产生荧光。若C线不显荧光条带,检测无效。
2.4 QBs试纸条制备及检测条件的优化
2.4.1 QBs探针抗体标记量优化 取50, 100, 150, 200, 250, 300, 350和400 μg鼠抗HRPⅡ单克隆抗体分别标记1 mg QBs。获得的QBs探针与Pf浓度为244 Parasite /μL(P/μL)血清孵育5 min后,加入试纸条,30 min后检测(T线:羊抗HRPⅡ多克隆抗体喷涂液浓度为1.0 g/L,C线:驴抗鼠二抗喷涂液浓度为0.5 g/L),荧光读取仪读取T线荧光强度,以T线产生荧光信号最强为QBs 最佳抗体标记量。
2.4.2 QBs试纸条的优化
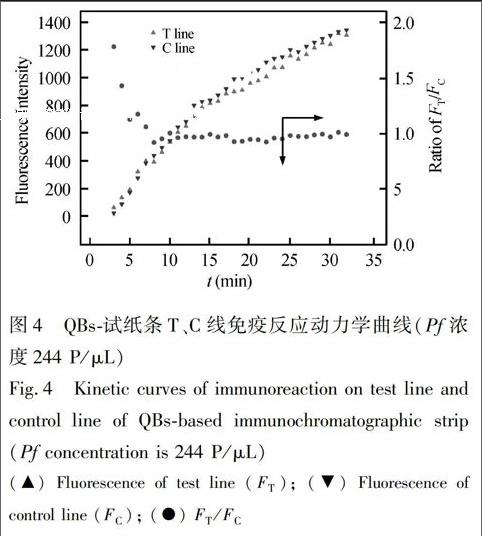
在最佳抗体标记浓度下,通过棋盘滴定实验确定QBs探针以及T线上多抗最佳剂量。试纸条定量分析的最佳判读时间采用免疫动力学分析方法进行确定。具体方案如下:在最优条件下,将70 μL待测血清(含1.5 μL QBs探针,血清Pf浓度为244 Parasite/μL)加入试纸条加样孔后,每隔1 min,荧光读取仪记录试纸条T、C线荧光强度(FT, FC)以及T、C线荧光强度比值(FT/FC)。绘制FT、FC以及FT/FC 随反应时间变化的曲线图,以FT/FC达到稳定值的时间为试纸条定量分析的最佳判读时间。
2.4.3 血清Pf检测的标准曲线
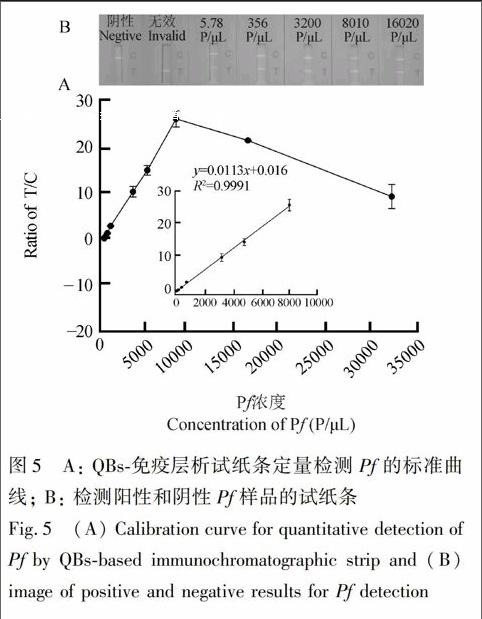
在最适条件下,将灭活的Pf分别添加至Pf阴性的人血清中配制Pf浓度为0~3.2×105 Parasite/μL的不同样品,QBs试纸条检测,10 min后荧光读取仪读取试纸条FT/FC比值,每个浓度样本重复检测3次。以Pf浓度为横坐标,FT/FC值为纵座标,绘制检测血清中Pf标准曲线。
2.4.4 QBs免疫层析试纸条性能初步评价
通过批内以及批间加标回收实验评价QBs荧光试纸条检测血清中Pf的准确性以及精密度,具体步骤如下:取阴性人血清,分别添加Pf至终浓度为 22.25, 360和4800 Parasite/μL。使用同一批次试纸条检测以上加标样品,每个浓度重复检测5次,计算Pf加标回收率与相对标准偏差以评价试纸条的批内稳定性;随后每隔5天连续检测3次,计算加标样品的回收率与相对标准偏差以评价试纸条的批间稳定性。
3 结果与讨论
3.1 QBs表征
透射电镜图片显示QBs聚合物微球呈球形,粒径分布均匀(图2A);单个粒子的高分辨率电镜结果显示聚合物中包埋了大量的油溶性CdTe/ZnSe量子点(图2A插图)。激光动态光散射结果显示裸露的QBs平均水化粒径为255 nm,而QBs探针平均水化粒径增加至295 nm,表明抗HRPⅡ单克隆抗体成功偶联至QBs表面(图2B)。QBs荧光光谱显示其最大荧光发射波长为620 nm,且3.5 × 10 3 nmol/L QBs溶液荧光强度与10 nmol/L水溶性CdTe/ZnSe量子点荧光强度基本相同,即QBs荧光强度较CdTe/ZnSe量子点增强了2800多倍(Con.QD/Con.QBs=(10 nmol/L)/(3.5 × 10 3 nmol/L) = 2857)。
3.2 QBs探针抗体标记量优化
用不同抗体标记量的QBs探针检测Pf加标血清(244 Parasite/μL),读取仪记录T线荧光强度,结果如图3所示。当抗体标记量从50 μg/mg增加至200 μg/mg时,试纸条T线荧光强度由579增至1076;当抗体标记量介于200~250 μg/mg时,T线荧光强度达到最大值;进一步增加抗体标记量,T线荧光强度反而降低。这是由于随着QBs表面抗体标记数量的增加,T线荧光强度增加,但是当QBs表面抗体标记浓度过高时,由于空间位阻效应,QBs探针结合活性反而下降,且随着抗体数量增多,活性下降越显著,导致T线荧光强度的降低。因此,本研究以200 μg抗体标记1 mg QBs为最佳抗体标记浓度。
3.3 QBs试纸条的优化
QBs探针用量及T线上羊抗HRPⅡ多克隆抗体喷涂浓度也是影响荧光试纸条灵敏度的关键参数。本研究通过棋盘滴定实验优化QBs探针及T线羊抗HRPⅡ多克隆抗体用量,结果见表1。从表1可知,当T线羊抗Pf多克隆抗体浓度为1.5 g/L,QBs探针用量为1.5 μL时,试纸条T线荧光强度达到最高1281(血清Pf浓度为244 Parasite/μL)。考虑到灵敏度以及检测成本,本实验采用T线羊抗Pf多克隆抗体浓度为1.5 g/L,QBs探针用量1.5 μL为最佳值。
试纸条荧光信号最佳判读时间的确定是实现试纸条定量分析的前提。通过试纸条测定阳性血清(244 Parasite/μL)的免疫动力学曲线(图4)可见,随着免疫反应时间的延长,试纸条T线和C线荧光强度迅速上升,且在30 min内FT、FC值未达到稳定值;而FT/FC比值在加样后10 min后即趋于稳定,且在随后20 min内比值无明显变化。此结果表明,FT/FC比值为考察对象,可在一定范围内可有效消除免疫反应动力学的差异,缩短试纸条定量分析的结果判读时间,这与本实验室前期关于胶体金免疫层析定量分析方法研究的结论一致[18]。因此Pf荧光试纸条最佳定量分析时间确定为加样后10 min。
3.4 QBs免疫层析试纸条定量检测Pf的标准曲线
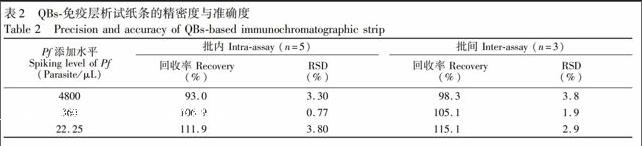
QBs免疫层析试纸条检测血清中Pf的标准曲线见图5A。血清中Pf 浓度在5.8~8010 Parasite/μL时,FT/FC比值随Pf浓度的增加而增大,其线性方程为y=0.0113x+0.016(R2=0.999)。当血清中Pf 浓度低于5.8 Parasite/μL时,荧光读取仪不能读取试纸条T线荧光数据;进一步将其置于紫外光下观测,在T线区域也未见荧光条带,检测Pf阳性和阴性的试纸条实物见图5B。依据以上结果,设定QBs荧光试纸条检测血清中Pf检出限(灵敏度)为5.8 Parasite/μL。当血清中Pf浓度大于8010 Parasite/μL时, FT/FC值出现随着Pf浓度的增大而下降的现象。分析其原因可能是Pf浓度过高,使得大量游离的Pf与T线上抗HRPⅡ多抗结合,从而阻碍了T线多抗与PfQBs探针免疫复合物结合,导致FT/FC值下降,即出现了类似于双抗夹心免疫法中常见的Hook效应。
3.5 QBs免疫层析试纸条性能评价
在阴性血清中添加高、中、低不同浓度的Pf,用QBs荧光试纸条检测,以试纸条批间、批内的加标回收率及相对标准偏差(RSD)评价方法的准确性与精密度,结果见表2。当Pf加标浓度为22.25,360和4800 Parasite/μL时,荧光试纸条批内回收率分别为111.9%, 106.9%和93.0%; 批间回收率分别为115.1%, 105.1以及98.3%;且试纸条批间、批内测定的RSD值均小于5%。以上结果表明,基于量子点微球的免疫层析试纸条方法检测血清中Pf具有良好的回收率及准确度,可对快速、灵敏地定量分析血清中Pf。
本研究以QBs为探针,成功建立了免疫层析法快速定量检测人体血清中Pf的方法。基于QBs的高荧光强度,Pf荧光试纸条检出限达到5.8 P/μL,灵敏度较目前常规胶体金免疫层析试纸条方法提高约10倍。相比于实验室常用的PCR及金标准镜检方法,Pf荧光试纸条方法检测只需15 min,且不需昂贵的设备、复杂的操作以及专业的操作人员,适于Pf的现场检测。
References
1 World Malaria Report 2012. World Health Organization. 2012
2 Anthony M. Clin. Microbiol. Rev., 2002, 15(1): 66-78
3 Payne D. Bull World Health Organ., 1988, 66: 621-628
4 Coleman R E, Sattabongkot J, Promstaporm S, Malar J., 2006, 5: 121
5 Barker R H, Banchongaksorm N T, Courval M M, Suwonkerd W, Rimwungtragoon K, Wirth D R. Am. J, Trop. Med. Hyg., 1992, 41: 266-272
6 Shokoples S E, Ndao M, KowalewskaGrochowska K, Yanow S K. J. Clin. Microbiol, 2009, 47: 975-980
7 Verheijen R, Stouten P, Cazemier G, Haasnoot W. Analyst, 1998, 123: 2437-2441
8 List of Known Commercially Available Antigendetecting Malaria RDTs. World Health Organization. 2008
9 GUO YanHong, LI Fei , ZOU MingQiang, JIN Yong, LI JinFeng, CHEN Ye. Chem. Reagent, 2010, 32(6): 496-498
郭艳宏, 李 飞, 邹明强, 金 涌, 李锦丰, 陈 野. 化学试剂, 2010, 32(6): 496-498
10 LI HuaiMing, LAI WeiHua, XU HengY i, XU Bo, LUO Wei, WEI Hua, WANG ShuiXing, XIONG YongHua. Chinese J. Anal. Chem., 2011, 39(11): 1647-1652
李怀明, 赖卫华, 许恒毅, 徐 波, 罗 薇, 魏 华, 王水兴, 熊勇华. 分析化学, 2011, 39(11): 1647-1652
11 Chan W C W, Maxwell D J, Gao X. Curr. Opin. Biotechno., 2002, 13: 40-46
12 Beloglazova N V, Speranskaya E S, De Saeger S, Hens Z, Abé S, Goryacheva Yu I. Anal. Bioanal. Chem., 2012, 403: 3013-3024
13 CUI Xi, XIONG QiRong, XIONG YongHua, SHAN Shan, LAI WeiHua. Chinese J. Anal. Chem., 2013, 41(12): 1812-1816
崔 希, 熊齐荣, 熊勇华, 山 珊, 赖卫华. 分析化学, 2013, 41(12): 1812-1816
14 Li X, Li W B, Yang Q H, Gong X Q, Guo W S, Dong C H, Liu J Q, Xuan L X, Chang J. ACS Appl. Mater. Interfaces, 2014, 6(9): 6406-6414
15 Zhang P F, Li Q, Chen J, Yan H, Ma W. Theranostics, 2014, 4: 307-315
16 Ren M L, Xu H Y, Huang X L, Kuang M, Xiong Y H, Xu H, Xu Y, Chen H Y, Andrew W. ACS Appl. Mater. Interfaces, 2014, 6(16): 14215-14222
17 Xie R, Kolb U, Li J, Basché T, Mews A. J. Am. Chem. Soc., 2005, 127: 7480-7488
18 LI ChaoHui, LUO Wei, XU Bo, LIU WenJuan, XU HengYi, XIONG YongHua. Food Science. 2012, 12: 114-118
李超辉, 罗 薇, 徐 波, 刘文娟, 许恒毅, 熊勇华. 食品科学, 2012, 12: 114-118
Abstract A CdTe/ZnSe quantumdot submicrobead (QBs), which exhibited fluorescence intensity approximately 2800fold stronger than that of single quantum dots, was conjugated with the antihistidine rich protein(HRP)Ⅱ mAbs using N(3(Dimethylamino)propyl)N′ethylcarbodiimide hydrochloride (EDC) method as fluorescence probe. The goat antiHRPⅡ polyclonal antibodies and donkey antimouse polyclonal antibodies were sprayed onto the nitrocellulose membrane as test line and control line, respectively. The resultant fluorescence probes were introduced to the immunochromatographic strip for the quantitative determination of Plasmodium falciparum. For determination of Plasmodium falciparum in serum, the QBs based immunochromatographic strips exhibited a good dynamic linear range from 5.8 Parasite/μL to 8010 Parasite/μL with a limit of detection of 5.8 Parasite/μL. The detection time of the proposed QBs based immunochromatographic strips for each sample was only 15 min. Moreover, the recovery rates of the intra and interassay ranged from 93.0% to 111.9%, and 98.3% to 115.1% respectively, while the relative standard deviations (RSDs) of intra and interassay were below 5%.
Keywords Quantumdot submicrobeads; Immunochromatographic strip; Plasmodium falciparum; Quantitative detection
(Received 19 September 2014; accepted 15 October 2014)
This work was supported by the National Natural Science Foundation of China (No.31160323) and the National Institute of Health of United State (No.1R43AI092962)
- 护理干预对肿瘤经外周静脉置入中心静脉导管患者自我护理能力的影响
- 细节护理管理在终末期糖尿病肾病血液透析中的应用价值
- 护理干预对降低冠心病患者动态心电图伪差的影响
- 神经外科护理中存在的问题及对策分析
- 呼吸内科进行护理风险管理的临床观察
- 肾病血液透析患者中心静脉导管血栓及纤维鞘形成的护理
- 中医护理技术对肛肠病术后疼痛的影响
- 新医改下护理人员职业倦怠的原因分析及对策
- 中西医结合康复治疗脑卒中偏瘫临床疗效观察
- 胃溃疡的日常护理和预防措施
- 集束化护理在泌尿外科留置尿管患者中预防感染的应用体会
- 护士合理选择静脉输液工具的现状及影响因素分析
- 分析优质护理模式对妇产科剖宫产率和分娩结局的影响
- 幼儿急疹出疹子后护理
- 癫痫患儿的康复护理与预后分析
- 甲状腺手术前后怎么护理
- 急诊分诊护士资质准入标准的构建研究
- 个性化护理对结核患者肺结核知识知晓率的影响研究
- 人性化护理在产科护理中应用效果观察
- 社区敬老院的护理现状及对策分析
- 不同口腔护理方法在预防呼吸机相关肺炎中实践效果观察
- 电话访视延续性护理对降低老年骨质疏松患者再入院率的效果研究
- 口腔颌面外科护理人员职业暴露和防护对策
- 助产士职业暴露调查及防护研究
- 护理干预在胃肠神经官能症中的应用效果观察
- up to a point
- up-to-date
- uptodate
- up to date
- up to now/until now
- up to speed (on sth)
- uptoss
- up to sth
- uptotheminute
- up-to-the-minute
- up to the minute
- up to the present day/until the present day
- uptower
- uptown
- uptowner
- uptowners
- uptowns
- uptrained
- uptrend
- upturn
- upturned
- upturner
- upturning
- upturns
- up until/up to
- 自叹壮志未酬、虚度光阴
- 自叹弗如
- 自吃自
- 自吃自的肉
- 自各儿
- 自同寒蝉
- 自名
- 自名体
- 自君作古
- 自君作故
- 自含秋露贞姿洁,不竞春妖冶态浓
- 自吹
- 自吹自捧
- 自吹自擂
- 自告
- 自告奋勇
- 自告奋勇自报奋勇
- 自告奋勇,自我推荐
- 自呼
- 自命
- 自命不凡
- 自命太高
- 自命清高
- 自命过高
- 自命非凡