

摘要 建立了双功能试剂2-[(4-异硫氰基苯基)甲基]-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(p-SCN-Bn-DOTA)与标准肽段反应的新方法,测定了反应产物与镧系金属Eu的螯合效率,探索了其作为靶向探针和蛋白定量标记试剂性能。考察了不同缓冲体系的浓度及pH值、p-SCN-Bn-DOTA量与肽段相对量、反应体系中有机相与水相比例,反应温度与反应时间对偶联效率的影响。实验结果显示: p-SCN-Bn-DOTA量为肽段的32倍,缓冲体系为0.2 mol/L TEAB (pH 8.5),60℃反应60 min, 有机相与水相之比为4.4∶1(V/V)时标记效率高;在HCl/NaAc缓冲体系(pH 4.0)中60℃反应60 min,金属离子鳌合反应效率高达94%。本研究建立了一种新的基于双功能试剂p-SCN-Bn-DOTA的标记方法,并成功用于RGD肽等的标记。
关键词 双功能试剂; 标记; 多肽; 蛋白定量; 质谱
2015-10-03收稿; 2016-03-11接受本文系北京市自然科学基金(Nos. 7143172, 7143173)资助
E-mail: shenjing69@sina.com
1 引 言
双功能试剂连接多肽并螯合金属元素,可以作为靶向探针结合分子影像技术用于肿瘤的靶向治疗研究[1],还可以通过标记多种金属元素制备蛋白质组学多重定量试剂[2],用于肿瘤标志物的筛选、鉴定、分类等研究。因此双功能试剂在肿瘤研究方面具有良好的应用前景。
RGD肽是一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)序列的短肽,基于靶向多肽RGD进行放射性核素标记可用于αvβ3(+)肿瘤的无创性检查以及判断患者是否适用于抗肿瘤血管形成治疗[3~5]。此外,标记的小分子多肽具有生物相容性好、穿透性强、免疫原性低、作用快、易于实时监测的特点,可在基于靶向探针的蛋白的分析检测方面发挥独特优势[6,7]。
在肿瘤蛋白质组定量分析研究方面,目前已开发的方法有基于稳定同位素标记的方法,如ICAT[8]、18O酶切标记[9]、SILAC[10] 、iTRAQ [11]等,但这些方法普遍存在同位素价格昂贵、标记难度较大、对质谱分析仪器具有选择性、同位素峰在质谱分析时会发生相互干扰等缺点,会给定量结果带来误差[12]。因此探索非同位素标记的方法,开发具有我国自主知识产权的蛋白定量试剂具有重要意义。文献[13~15]报道了针对肽段半胱氨酸标记设计的金属编码亲和标签。徐明等[16]利用外源Hg标签标记硒蛋白/多肽,实现Se-Hg双元素标记选择性识别和检测硒蛋白/多肽。但是在实际的蛋白质组学样本分析中,需要使用适用于所有肽段的标记方法。Liu等[17]开发了基于双功能试剂二乙酸胺五乙酸的标记方法,实现了肽段的无歧视标记,但所选择的双功能试剂标记效率不高。针对此问题,Wang等[18]用羟基琥珀酰亚胺-四氮杂环十二烷四乙酸(DOTA-NHS-ester) 作为螯合试剂进行了初步研究,在此基础上,文献[12,19]对标记方法进行了优化,提高了金属标记效率。
虽然非同位素标记的方法已取得了进展,但是仍有以下几方面需要改进。首先,DOTA-NHS-ester 容易水解,在反应体系中,活化酯与NH2的标记反应和水解反应互相竞争,不利于反应体系中水相和有机相组成的确立。其次,肽段中NH2与DOTA-NHS-ester是亲核取代反应,反应体系应在中性或偏碱性条件进行;而DOTA-NHS-ester 在碱性条件下极易水解,水解产生酸,在一定程度上改变反应体系的pH值[20]。因此,DOTA-NHS-ester的水解敏感性高不利于确立标记反应条件,对实际样本分析条件的限制很大,因此优化双功能试剂的意义重大。
2-[(4-异硫氰基苯基)甲基]-1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(p-SCN-Bn-DOTA)是一种被广泛应用的双功能螯合试剂,如与牛血清白蛋白(BSA)和鸡蛋清溶菌酶标记可用于肿瘤的检测[21],与利妥昔单抗[22]或核糖核酸[23]反应标记可以用于抗肿瘤药的生物分布和显影的研究,还可以与聚乙二醇[24]标记得到胶束用于制剂研发等。它的化学结构较DOTA-NHS-ester稳定,不易发生水解反应,这对于标记反应条件的确立十分有利,并可以通过螯合金属离子标记氨基多肽。基于p-SCN-Bn-DOTA的标记方法的建立不仅有望开发一种新型的金属标记试剂,用于肿瘤蛋白质组学的多重定量分析,而且可将该试剂用于RGD肽的标记,从而有利于肿瘤受体显像剂的开发。本研究建立了基于双功能试剂p-SCN-Bn-DOTA的螯合金属元素标记多肽新技术,并成功标记RGD等标准肽段。
2 实验部分
2.1 仪器与试剂
Ultraflex II基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF-MS,德国布鲁克公司);Discovery DV215CD分析天平(美国OHAUS公司);HQ-60涡旋混匀器(北方同正生物技术发展有限公司);PMC-060掌上离心机(日本TOMY公司)。
α-氰基-4-羟基肉桂酸(德国布鲁克公司);标准合成肽段 LGEYGFQNALIVR由吉尔生化(上海)有限公司合成;RGD肽由北京中海康医药科技发展有限公司合成;三乙二胺碳酸盐(TEAB)、氯化铕(EuCl3)(美国Sigma-Aldrich公司);p-SCN-Bn-DOTA(美国 Macrocyclics 公司);其它试剂均为国产分析纯;实验用水为Milli-Q(美国Millipore公司)超纯水。
2.2 实验方法
2.2.1 p-SCN-Bn-DOTA与标准肽段的偶联反应 100 μL 0.5 μmoL p-SCN-Bn-DOTA溶于二甲基甲酰胺(DMF), 50 μL 0.68 μmoL肽段LGEYGFQNALIVR溶于TEAB。将两种溶液以不同比例混合进行偶联反应,考察TEAB的浓度和pH值、DOTA与肽段的摩尔比、反应温度、反应时间等条件对偶联效率的影响。其中肽段的终浓度始终为0.05 nmol/μL。称取RGD肽 1 mg, 加DMF 124 μL,供p-SCN-Bn-DOTA与RGD肽的偶联反应。
2.2.2 偶联产物与金属离子的螯合反应
向2.2.1中的反应体系加入5 μL 0.1 mol/L EuCl3溶液(盐酸-乙酸钠缓冲液或乙酸-乙酸铵缓冲液),再分别加入相应的不同pH值的缓冲液50 μL,考察pH值、反应温度、反应时间对螯合效率的影响。
2.2.3 MALDI-TOF-MS分析 (1)干点法点样 取1 μL分析样品点于Ground steel靶板上,自然干燥后,再点5 mg/mL CHCA基质溶液(0.1%TFA-50%乙腈溶液)1 μL,自然干燥后进行质谱分析。(2)薄层法点样 先在靶板上点0.5 μL CHCA基质的乙醇过饱和溶液,自然干燥后,再点1 μL CHCA基质溶液(5 mg/mL,0.1% TFA-50% 乙腈溶液)和样品的混合溶液。采用Peptide Calib standard mono 作为标准品校正,相对标准偏差≤5 ppm。质谱数据采集采用反射模式。仪器控制软件为FlexControl software verion 3.0,数据处理软件为FlexAnalysis software verion 3.0。
3 结果与讨论
3.1 双功能试剂的选择
目前针对巯基的金属元素标记方法较多,标记氨基的金属元素标记方法研究较少,已有的标记N-端氨基的方法有转氨法等,如先将蛋白的游离N-端氨基转化为活性的羰基,然后与连有肼的荧光基团反应得到标记分子[25] 。氨基的金属标记,理论上可以标记所有的肽段,对所有的肽段和蛋白质(含巯基和不含巯基的)都能进行定量研究[2,20,26,27]。p-SCN-Bn-DOTA是一种双功能螯合试剂,可与肽段的氨基共价结合,并通过络合反应螯合金属离子,与Wang等[18]采用的DOTA-NHS-ester相比,其结构稳定,不易水解,既能够明确反应体系中水相和有机相的比例,又有利于确定反应体系的pH值,这些均利于标记反应条件的确立。
3.2 金属元素和标准肽段的选择
p-SCN-Bn-DOTA可与多种稀土金属离子形成螯合物,其中与镧系金属离子形成的螯合物稳定性最佳[28],故选镧系金属离子Eu作为螯合标签。
标准肽段的选择应具有典型性,由于实际的生物样本大多是通过胰酶酶解成肽段,肽段C端是精氨酸(R)或者赖氨酸(K),故选用常用的标准蛋白牛血清白蛋白的胰酶酶解肽段LGEYGFQNALIVR作为标准肽段之一;RGD肽由于在肿瘤诊断和治疗中的重要意义而被选作为标准肽段。
3.3 肽段的金属元素标记反应原理
肽段的金属元素标记反应的原理如图1所示,首先是肽段的氨基与p-SCN-Bn-DOTA发生共价反应,反应产物再与镧系金属元素形成稳定螯合物。
以产物和反应物的MALDI-TOF-MS质谱峰峰面积计算标记反应的效率,标记效率(%)= 产物峰面积/(产物峰面积+原肽峰面积)×100%。
3.4 p-SCN-Bn-DOTA与标准肽段偶联反应的优化
3.4.1 缓冲体系对p-SCN-Bn-DOTA标记反应的影响 考察了3种缓冲体系NaHCO3-Na2CO3体系、DMF-三乙胺体系以及三乙二胺TEAB体系。对于0.5 mol/L NaHCO3-Na2CO3缓冲液(pH 8.8),由于反应产物盐浓度过高,需要稀释50倍以上才能被MALDI-TOF检测到,而且钠盐是不可挥发性盐,Na+对质谱可能产生的干扰不易去除。Scheinberg等[29]将p-SCN-Bn-DOTA与肽段GGGFC在无水的DMF -三乙胺体系中反应,但是实际的生物样品酶解产物是含水的体系,因此纯有机溶剂的DMF-三乙胺体系不适用于生物样品酶解产物分析。而TEAB是可挥发性碳酸盐,p-SCN-Bn-DOTA与肽段LGEYGFQNALIVR(m/z 1479)可以在TEAB缓冲体系中反应生成标记产物(m/z 2031),而且结晶状态好,适合质谱检测,因此, 选择TEAB体系进行后续实验条件优化。
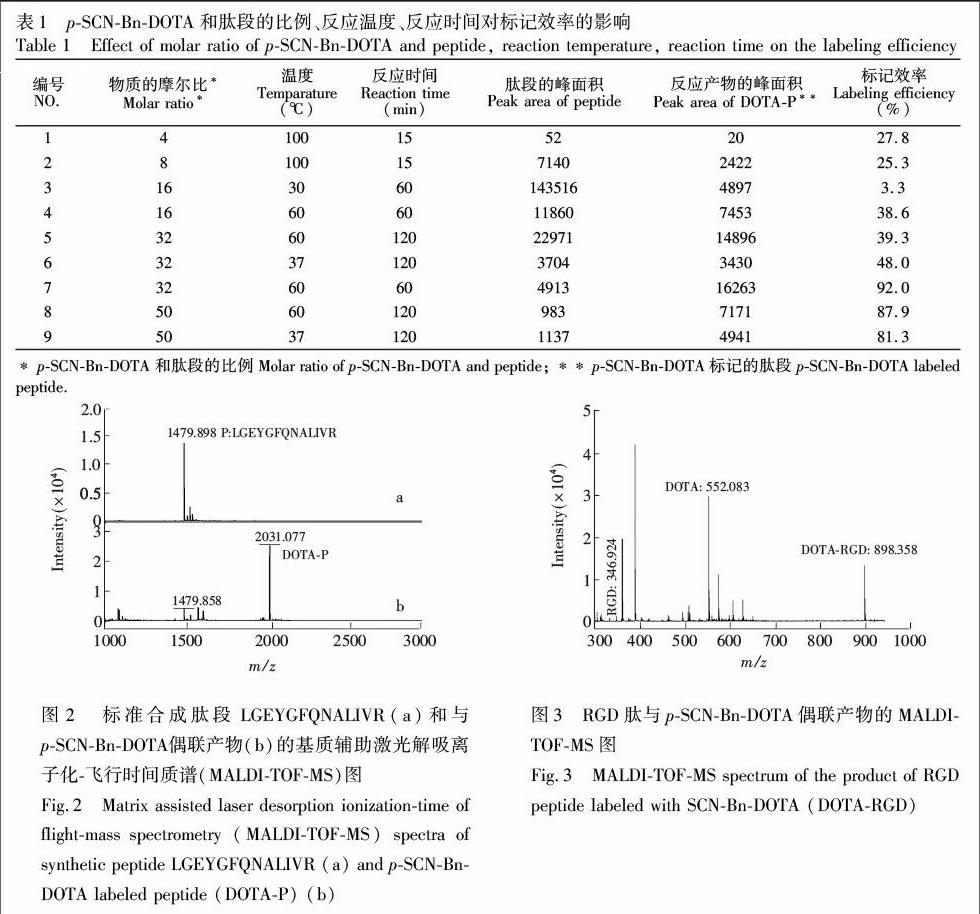
3.4.2 p-SCN-Bn-DOTA的量与肽段量的比例、反应温度、反应时间对标记反应的影响 由于标记反应中影响标记效率的因素众多[30,31],本研究考察了p-SCN-Bn-DOTA量与肽段量的比例、反应温度、反应时间等因素,结果如表1所示。由表1可见,p-SCN-Bn-DOTA和肽段的摩尔比为32倍,在60℃反应60 min时,标记效率最高,因此选择上述条件为最佳反应条件。与文献[20]报道的DOTA-NHS-ester 50倍过量于肽段、肽段的终浓度为0.125 nmol/μL相比,本方法反应试剂的用量少,而且适用的肽段的浓度更低,显示出更高的标记灵敏度。肽段和标记产物的质谱图如图2所示。
3.4.3 反应体系中有机相与水相比例的考察 实验条件优化过程中,为保证肽段的终浓度一致,需要改变有机相和水相的比例来实现其它参数的调整。实验过程中发现,在一定范围内,反应体系中水的比例越高,标记效率越低, 最佳有机相与水相之比为4∶1~5∶1(V/V)。
3.4.4 缓冲体系浓度及pH值对反应的影响 缓冲体系浓度及pH值是影响螯合剂配位能力的主要因素。本研究考察了0.1, 0.2和0.5 mol/L TEAB缓冲溶液在pH值分别为6.5,7.5,8.5,9.5 时DOTA与肽段的偶联效率,用三乙胺和冰醋酸调节pH值。结果表明,缓冲体系为0.2 mol/L TEAB, pH 8.5的条件下偶联效率较高,且重现性好。
3.5 p-SCN-Bn-DOTA与RGD肽的偶联反应
按照2.2.1节实验方法制备RGD肽,在优化的条件下,即缓冲体系为0.2 mol/L TEAB(pH 8.5),与p-SCN-Bn-DOTA在60℃进行偶联反应60 min, 实验结果如图3所示,标记效率为90.6%。
3.6 反应温度、反应时间及pH值对螯合反应的影响
对于EuCl3与DOTA 偶联产物的标记反应,分别考察了乙酸铵-乙酸(HAc-NH4Ac),盐酸-乙酸钠(HCl-NaAC)反应体系;反应温度为30℃,60℃和100℃;反应时间为15和60 min;pH值为4.0和5.5时的标记效率。结果如表3及图4所示, 其中在pH 4.0 的HCl-NaAC缓冲液中,60℃反应60 min标记效率最高,而且酸性条件下(pH 4.0),可以减少金属离子和肽段的非特异性结合。
3.7 MALDI检测方法的考察
对用于MALDI检测的样品点样方法进行了考察,比较了干点法和薄层法两种方法。如图5所示,结果显示干点法相对较好,结晶状态均匀,样品检测灵敏度高。
4 结 论
本研究通过双功能试剂p-SCN-Bn-DOTA与RGD等标准肽段反应,考察与镧系金属元素Eu 螯合效率,对螯合稀土金属标记肽段的反应条件进行了优化。p-SCN-Bn-DOTA与标准肽段反应的条件为:DOTA 为肽段的32倍,缓冲体系为0.2 mol/L TEAB,pH 8.5,反应温度60℃,反应时间为60 min; 偶联产物与金属离子反应的条件为:pH 4.0的HCl/NaAC缓冲体系中反应60 min。MALDI-TOF检测时样品点样方法使用干点法较好。本研究结果表明, p-SCN-Bn-DOTA在标记RGD等多肽上有良好的应用,有望成为一种新的高灵敏度金属标记试剂和肿瘤受体显像剂。
References
1 Lee S, Xie J, Chen X. Chem. Rev., 2010, 110(5): 3087-3111
2 Kerr T J, McLean J A. Chem. Commun., 2010, 46(30): 5479-5481
3 Ang C Y, Tan S Y, Zhao Y. Org. Biomol. Chem., 2014, 12(27): 4776-4806
4 Von Wallbrunn A, Hltke C, Zühlsdorf M, Heindel W, Schfers M, Bremer C. Eur. J. Nucl. Med. Mol. Imaging, 2007, 34(5): 745-754
5 DI Li-Juan, ZHANG Xu-Chu, ZHANG Chun-Li, WANG Rong-Fu. Labeled Immunoassays and Clinical Medicine, 2007, 14(1): 58-61
邸丽娟, 张旭初, 张春丽, 王荣福. 标记免疫分析与临床, 2007, 14(1): 58-61
6 HUANG Yan-Yan, ZHAO Rui. Journal of Instrumental Analysis, 2012, 32(9): 1184-1190
黄嫣嫣, 赵 睿. 分析测试学报, 2012, 32(9): 1184-1190
7 Shiba K. Chem. Soc. Rev., 2010, 39(1): 117-126
8 Gygi S P, Rist B, Gerber S A, Turecek F, Gelb M H, Aebersold R. Nat. Biotechnol., 1999, 17(10): 994-999
9 Yao X, Freas A, Ramirez J, Demirev P A, Fenselau C. Anal. Chem., 2001, 73(13): 2836-2842
10 Ong S E, Blagoev B, Kratchmarova I, Kristensen D B, Steen H, Pandey A, Mann M. Mol. Cell. Proteom., 2002, 1(5): 376-386
11 Ross P L, Huang Y N, Marchese J N, Williamson B, Parker K, Hattan S, Khainovski N, Pillai S, Dey S, Daniels S, Purkayastha S, Juhasz P, Martin S, Bartlet-Jones M, He F, Jacobson A, Pappin D J. Mol. Cell. Proteom., 2004, 3(12): 1154-1169
12 LI Jia-Bin, ZHOU Lian-Qi, YAN Hui, LI Nan-Nan, HAO Fei-Ran, TIAN Fang, ZHANG Yang-Jun. Chinese Journal of Chromatography, 2014, 32(4): 361-368
李佳斌, 周廉淇, 颜 辉, 李楠楠, 郝斐然, 田 芳, 张养军. 色谱, 2014, 32(4): 361-368
13 Whetstone P A, Butlin N G, Corneillie T M, Meares C F. Bioconjug. Chem., 2004, 15(1): 3-6
14 Ahrends R, Pieper S, Kühn A, Weisshoff H, Hamester M, Lindemann T, Scheler C, Lehmann K, Taubner K, Linscheid MW. Mol. Cell. Proteom., 2007, 6(11): 1907-1916
15 He Y, Esteban-Fernández D, Linscheid M W. Talanta, 2015, 134: 468-475
16 XU Ming, YANG Li-Min, WANG Qiu-Quan. Chinese J. Anal.Chem., 2015, 43(9): 1265-1271
徐 明, 杨利民, 王秋泉. 分析化学, 2015, 43(9): 1265-1271
17 Liu H, Zhang Y, Wang J, Zhou C, Cai Y, Qian X. Anal. Chem., 2006, 78(18), 6614-6621
18 Wang X, Zhang Y J, Wang X Y, Lin H J, Qin W J, Qian X H. Anal. Methods, 2012, (4): 1629-1632
19 Wang X Y, Wang X, Qin W J, Lin H J, Wei J Y, Zhang Y J, Qian X H. Analyst, 2013, 138: 5309-5317
20 Wang Xin, Development and Application of a Novel Method for Multiplex Proteomic Quantitation Based on Metal Element Labeling Coupled with Mass Spectrometry, Academy of Military Medical Science, Beijing. 2012
王 昕. 金属元素标记结合质谱技术的蛋白质组多重定量新方法研究及应用, 北京:军事医学科学院, 2012
21 Jakubowski N, Waentig L, Hayen H, Venkatachalam A, Bohlen A V, Roosb P H, Andreas M. J. Anal. At. Spectrom., 2008, 23: 1497-1507
22 Cooper M S, Ma M T, Sunassee K, Shaw K P, Williams J D, Paul R L, Donnelly P S, Blower P J. Bioconjug. Chem., 2012, 23: 1029-1039
23 Schlesinger J, Koezle I, Bergmann R, Tamburini S, Bolzati C, Tisato F, Noll B, Klussmann S, Vonhoff S, Wuest F, Pietzsch H J, Steinbach J. Bioconjug. Chem., 2008, 19(4): 928-939
24 Fonge H, Huang H, Scollard D, Reilly RM, Allen C. J. Control Release, 2012, 157(3): 366-374
25 Dong S Y, Zhao Z W, Ma H M. J. Proteome Res., 2006, 5(1): 26-31
26 Whetstone P A, Butlin N G, Corneillie T M, Meares C F. Bioconjug. Chem., 2004, 15(1): 3-6
27 Ahrends R, Pieper S, Kühn A, Weisshoff H, Hamester M, Lindemann T, Scheler C, Lehmann K, Taubner K, Linscheid M W. Mol. Cell. Proteom., 2007, 6(11): 1907-1916
28 Izatt R M, Pawlak K, Bradshaw J S, Bruening R L. Chem. Rev., 1991, 91(8): 1721-2085
29 Antczak C, Jaggi J S, LeFave C V, Curcio M J, McDevitt M R, Scheinberg D A. Bioconjug. Chem., 2006, 17(6): 1551-1560
30 MI Wei, WANG Jing, YING Wan-Tao, CAI Yun, QIAN Xiao-Hong. Chinese J. Anal. Chem., 2010, 38(10): 1393-1399
米 薇, 王 晶, 应万涛, 蔡 耘, 钱小红. 分析化学, 2010, 38(10): 1393-1399
31 ZHANG Ai-Hong, LIN Hong-Jun, HUANG Shun-Xiang, ZHOU Xue-Zhi. Jounral of Chinese Mass Spectometry Society, 2014, 35(5): 427-437
张爱红, 林虹君, 黄顺祥, 周学志. 质谱学报, 2014, 35(5): 427-437
Abstract A novel labeling approach with good compatibility based on 2-(4-isothiocyanatobenzyl)-1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (p-SCN-Bn-DOTA) was established. The labeling conditions of p-SCN-Bn-DOTA with standard peptides were optimized, and the labeling efficiency of macrocyclic complex of p-SCN-Bn-DOTA with lanthanide metal ion Eu was also investigated. The labeling process was a two-step reaction. The labeling efficiency was affected by several factors including pH, buffer, reaction time, reaction temperature, and ratio of p-SCN-Bn-DOTA to peptide. The optimized conditions were as followed: the first step of labeling reaction was reacted in 0.2 mol/L triethylene diamine (TEAB) (pH 8.5) buffer for 60 min at 60℃, and the molar ratio of p-SCN-Bn-DOTA with peptide was 32. The second step of rare earth metal chelating was in pH 4.0 HCl/NaAC buffer for 60 min at 60℃. This approach was successfully applied in RGD peptide labeling.
Keywords Bifunctional chelating reagents; Labeling; Peptide; Protein quantification; Mass spectrometry
- 近距离煤层煤柱及采空区下综采工作面矿压规律分析
- 浅析煤矿开采中的地质构造及其影响
- 节能降耗,势在必行
- 矿井瓦斯综合治理技术应用研究
- 园林绿化中五色草花坛的养护管理
- 炼油工艺的节能环保措施分析
- “爱”是提高素质教育的基础
- HN地区沙一、二段沉积环境与层序特征
- 高职院校教师现状分析及对策
- 通风技术与安全技术在煤矿开采中的应用探讨
- 浅谈语文课程改革新思路
- 探究煤矿机电设备降低零件磨损的途径与润滑措施
- 生物化学实验教学改革策略
- 石油炼化企业烟气脱硫技术研究综述
- 高职院校校园电视建设刍议
- 浅析天然气脱硫主要方法
- 关于电气设备故障诊断与模式识别探讨
- 浅析无刷直流测速发电机的发展及其应用
- 火电厂脱硝改造及对锅炉系统影响研究
- 大型屋面中压力流雨水排放系统的应用
- 电力调度运行中的安全稳定管理分析
- 新技术在建筑工程施工中的应用
- 浅议建筑物内电线电缆线路的防火
- 谈光伏电站建设对环境的影响
- 论高层建筑施工安全措施
- overpopularly
- overpopulated
- overpopulation
- overpopulous
- overpopulously
- overpopulousness
- overpopulousnesses
- over-positive
- overpositive
- overpositively
- overpositiveness
- overpositivenesses
- overpost
- overpotencies
- overpotency
- overpotent
- overpotential
- overpower
- overpowered
- overpowerful
- over-powerful
- overpowerfully
- overpowerfulness
- overpowerfulnesses
- overpowerfulness's
- 投井落石
- 投产
- 投亲
- 投亲不如落店
- 投亲不如落店。
- 投亲不如访友
- 投亲不如访友,访友不如下店
- 投亲靠友
- 投人
- 投人身
- 投人须投大丈夫
- 投以目光,注视
- 投传
- 投传而去
- 投体
- 投供
- 投保
- 投保人
- 投保客户
- 投借
- 投充了新军——掇起石头
- 投充令
- 投入
- 投入—产出分析之父
- 投入产出分析