摘 要 传统观点认为酶促反应并不会影响酶本身的扩散运动。最近的研究表明,在酶促反应过程中,酶分子的扩散系数会增大,而且其增大强度具有底物依赖性,即随着底物浓度的增加而增大。酶促反应分子马达,是利用酶促反应过程中产生的能量驱动纳米或微米级物体的运动。尽管在几种不同的酶体系中的研究已经证实了酶在催化过程中的底物依赖性,但是造成酶扩散增强的原因至今仍不清楚。本文从酶促反应过程中酶自身扩散系数的变化、酶自身扩散系数变化的可能机理及其应用等3个方面,对酶在催化过程中的底物依赖性以及酶促分子马达的研究进展进行了综述。
关键词 酶促反应; 扩散系数; 趋化性; 自驱动; 纳米马达; 综述
20160318收稿;20160418接受
本文系国家自然科学基金(Nos.21227804,21373260,31371015),中国科学院青年创新促进会项目(No.2013174),口腔疾病研究国家重点实验室开放课题项目(No.SKLOD2015OF05)资助
Email: lidi@sinap.ac.cn
1 引 言
众所周知, 液体中的分子不停地做无规则的布朗运动。对于有催化活性的酶分子而言,在无底物存在时,在溶液中的运动模式为布朗运动;在底物存在时,酶可以催化底物转化为产物,并释放出能量。传统观点认为,底物转化为产物所释放的能量不会对酶分子本身造成干扰[1]。然而最近的研究表明,在催化反应过程中,大多数酶的扩散系数会增大,而且增大程度与底物浓度呈正相关,即酶分子可以利用酶促反应过程中底物转化时释放的能量驱动酶分子自身的运动。
马达是指可以将某种形式的能量转化成机械能,用于做功的一类机器[2]。实际上,生物体内也包含多种多样的马达,如肌球蛋白、动力蛋白和驱动蛋白,都是胞浆内的分子马达,通过消耗能量分子(ATP)为马达在特定轨道(如微管)上的运动提供能量。基于酶的生物马达在细胞内高效而精确地行使着特殊的功能[3~6],如DNA的合成和囊泡的转运等。在更高层次上,生物体系中的马达可以使细胞有方向性地朝着特定的化学物质或光运动[7,8]。在上述情况中,这些生物马达的运动都是利用了酶促反应过程中底物转化为产物所释放的能量。酶是生物体内进行各种各样化学反应的催化剂。鉴于酶分子的多样性、高效性,以及酶分子可以利用酶促反应过程中底物转化所释放的能量进行自我驱动,因此可利用酶分子设计构建马达,这将会极大地扩展和丰富驱动纳米或微米马达的方式[9],为设计新型的化学刺激响应的自动药物输送系统开辟新型且多样化的途径。本文将围绕酶促反应过程中酶扩散系数的增强及其在分子马达构建等方面的研究与应用进行评述。
2 酶促反应过程中酶自身的扩散行为
2.1 酶促反应对酶分子自身扩散系数的影响
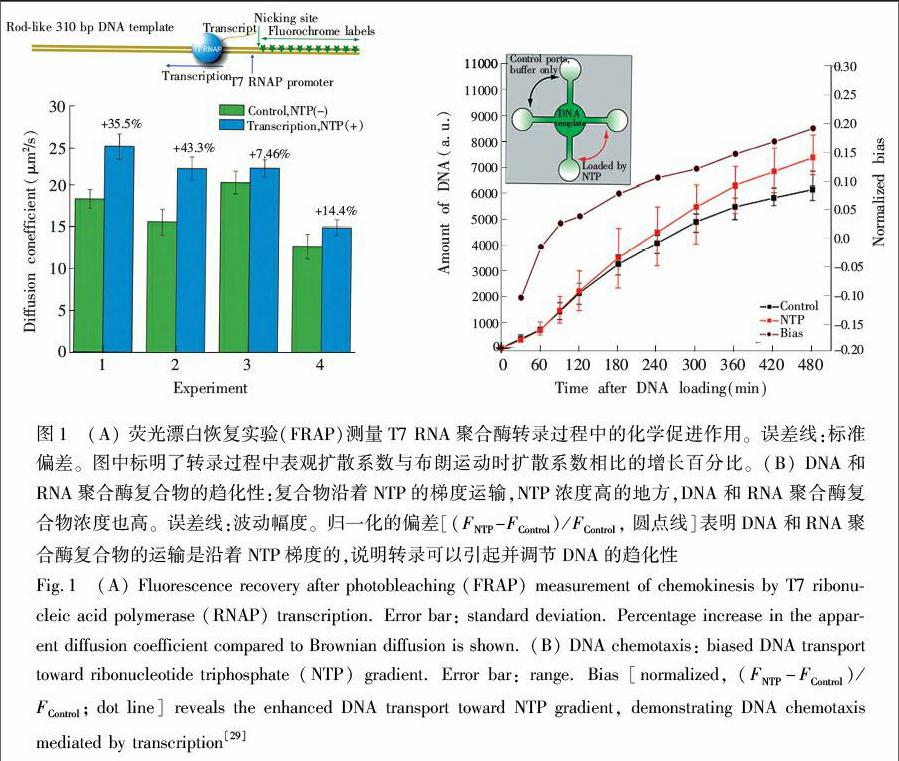
最近的研究表明,酶促反应过程中酶的扩散系数会随底物浓度的增加而增大。2009年,Yu等[10]通过实验证明,由DNA模板和相应的RNA聚合酶组成的复合物,在底物NTPs存在时扩散变快,而且该复合物有朝着底物NTPs浓度高的方向运动的趋势,这是一种类似于细胞趋化性的行为(如图1所示)。
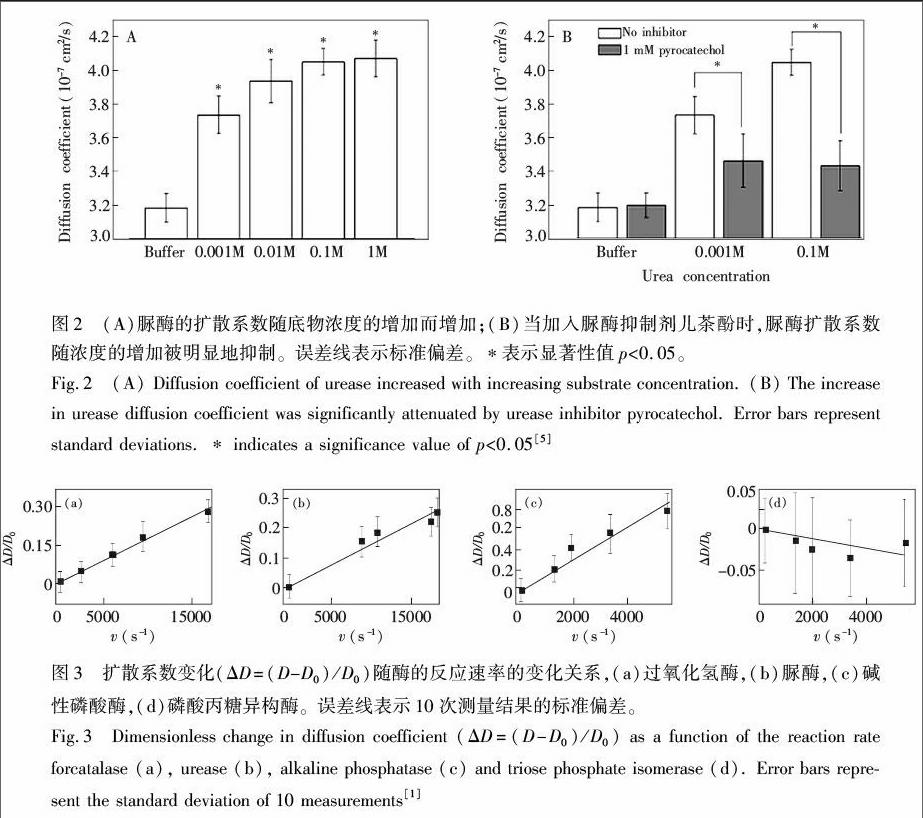
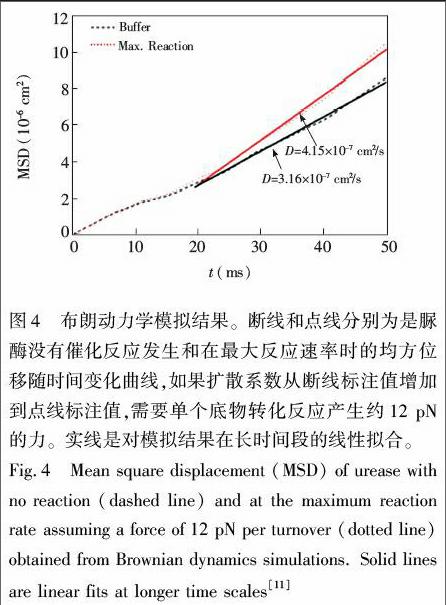
随后,宾夕法尼亚州立大学的Muddana等首次使用荧光相关光谱仪(FCS)在单分子水平上测到了酶促反应引起的脲酶扩散增强的行为(图2),并用布朗动力学模拟计算了扩散系数达到相应增强程度所需的力(约12 pN)[11]。Muddana等对酶促反应引起的扩散系数增强机理给出了几种可能的解释。2015年,加州大学伯克利分校的Bustamante研究组对文献[11]报道的酶的扩散增强行为进行了更加严密的论证与排除实验。他们的研究发现,酶促反应过程中酶扩散系数的增强与反应热相关。即仅有催化放热反应的酶才会表现出扩散系数增大,且扩散系数的增大与反应速率呈线性关系(图 3)[1]。酶促反应中酶分子扩散系数增强,表明酶分子可以利用底物转化为产物过程中所释放的能量进行自我驱动,所以需要重新考虑酶促反应可能对酶分子所产生的影响,这对更加深入地理解酶分子在催化过程中的一些行为具有极其重要的意义。
2.2 酶促反应过程中酶分子自身扩散增强的机理
最近的一系列研究成果表明,酶促反应中酶扩散系数的增强具有底物依赖性,但对于这种酶促反应引起的酶扩散系数增强的机理仍不清楚。2010年,Muddana等提出了几种可能的机理来解释脲酶在催化尿素分解过程中酶扩散增强的底物依赖性[11]。第一种导致脲酶扩散增强的可能机理是:酶促反应过程中产生的带电产物在酶分子的周围产生的不对称的电场,引起了带电的酶分子扩散的增强。具体而言,即脲酶在磷酸盐缓冲液中催化尿素分解的产物NH+4比HCO 4离子的扩散系数大,所以当尿素分子被水解后,这些产物离子被释放在酶分子的表面,由于NH+4的快速扩散而产生了一个局域电场,这个电场可以在极短时间内对酶施加pN数量级的电泳力,直至离子从双电层扩散离开。但是要测量如此短时间内的力是非常困难的,所以作者用布朗动力学模拟对单个底物转换时所产生的力进行了估算(图4)。第二种可能的解释是:尿素水解所引起了酶分子局部pH值升高,使得蛋白质(酶分子)表面电荷增加,蛋白蛋白以及蛋白平衡离子之间的相互作用增强。这些相互作用的增强使得脲酶的扩散系数增大。为了验证局部pH值变化对酶分子扩散的影响,作者使用荧光染料SNARF1(其荧光寿命随局部pH的变化而变化)对脲酶进行了标记。作者发现pH值变化所能引起的酶扩散系数的增加(5%)远不及实验中所观察到的扩散系数增加比例(28%),这说明pH值增加即使可以引起脲酶扩散系数变化,也不是导致如此大幅度扩散增强的主要原因。最后,作者通过计算得出,由于尿素水解所引起的溶液局部温度的升高约在μK数量级,所以几乎可以忽略其对酶分子扩散系数变化的影响。
2013年,Sengupta等[5]又发现过氧化氢酶的扩散系数也随着底物浓度的增加而增大,在排除了电荷、pH值变化、气泡以及溶液局部温度升高等因素对酶分子扩散增强的影响后,他们认为酶催过程中扩散系数变化的原因可能是酶分子瞬时局部温度升高造成的[5]。同时,在微流控通道中,脲酶与过氧化氢酶都有向底物浓度高的方向扩散的趋势,这是一种分子尺度上类似于生物体系中趋化性的行为。作者认为酶分子具有类似于趋化性的行为的主要原因是酶促反应中酶分子扩散系数增强的底物依赖性。底物依赖性使酶分子在底物浓度高的地方扩散快。因此,可以利用酶的“趋化性”控制酶分子的运动方向,这为纳米或微米马达的设计及定向药物运输提供了新思路。
2015年,Bustamante研究组提出酶促反应过程中酶分子扩散系数的增强与反应热相关[1],只有催化放热反应的酶的扩散系数才会增大,且扩散系数的增加与反应速率呈线性相关。他们研究了4种酶,包括过氧化氢酶、尿素酶、碱性磷酸酶和磷酸丙糖异构酶,发现前3种催化放热反应的酶,其扩散系数的增加与反应速率呈线性关系。磷酸丙糖异构酶催化磷酸丙糖异构体之间的构象转化,反应放热可以忽略,因此其扩散系数不依赖底物浓度,即反应速率。他们提出了一种全新的理论模型解释酶促反应过程中酶扩散系数增强的机理,即“化声效应”(Chemoacoustic effect)[1](图5)。催化位点不对称的酶在催化反应后释放的热量使酶本身膨胀而发生形变,导致对酶溶剂界面产生压力。溶剂除了通过声波释放部分能量,根据牛顿第三定律,溶剂还会对酶产生反作用力,使酶的质心发生位移。作者认为这种反应热所引起的“化声效应”可能才是酶促反应中酶扩散增强的根本原因。这颠覆了传统上认为反应热不会对酶分子造成干扰的观点,也使我们认识到酶促放热反应或许是通过“化声效应”引起了酶分子的质心发生位移。这种反应热驱动酶分子运动的全新视角表明,反应热或许也会对酶分子的结构完整性及内部自由度产生影响。对酶促反应中酶扩散增强机制的深入研究,不仅有助于理解生物体内酶分子一些复杂的生物学行为(比如聚合酶的方向性),也为设计一些具有特殊功能的纳米或微米马达指明了新的方向。
3 酶促反应过程中酶自身的扩散增强的潜在应用
3.1 构建利用酶促反应供能的微马达
近年来,利用催化反应供能的人造马达模拟生物分子马达和微生物的研究备受关注[12],因为它们在纳米尺度组装[13]、微型机器人制造[14~16]、化学或生物化学传感[17~21]等领域具有重要的潜在应用。此外,利用靶向运动的人造马达可运输药物[22,23],且比传统的被动扩散方式具有极大的优势,如速度快、用量少等。但是要真正实现在生物体真实环境中的应用,人造马达必须满足两个条件:一是利用生物体液中存在或生物相容性好的物质提供能量,进行自我驱动,而不是依靠自电泳或离子扩散泳机制[24]; 第二,制造马达的材料具有较好的生物相容性[23,25]。
酶分子是生物体中普遍存在的,并且可以高效催化转化生物体内的化学物质,所以其生物相容性很好。研究表明,过氧化氢酶、脲酶等在催化底物反应时,自身的扩散系数随底物的浓度的升高而增大。当酶与底物共存时,酶就成为一个利用化学反应供能的“分子马达”,但是酶自身的携带能力有限。最近,牛津大学Dey等[12]提出了一个利用酶促反应为动力的微马达模型(图6)。他们分别将过氧化氢酶和脲酶连接聚苯乙烯微球表面,当这种表面包裹酶分子的微球在相应的底物存在时,扩散系数也会随着底物浓度的升高而增大。同时,他们也证明了这种微马达更倾向于酶底物存在的方向进行扩散运动。利用酶分子构建微型马达具有极大的优势:一方面酶分子具有较好的生物相容性,另一方面其扩散运动具有一定的趋向性。因此,如果酶分子具有较大的载体用于携带药物,原理上能够应用于定向药物输送。这种可以对特定化学信号响应的微型马达可用于构建在生理环境下执行特定功能的多功能复合马达。
3.2 酶的分离纯化
从复杂的生物样品中分离出具有生物活性的特定成分的研究具有重要意义。对于生物大分子的分离纯化,通常采用较温和的纯化条件,以保证其活性。现有的一些非标记的分离技术主要依赖于被分离物质的物理性质,如形状[26]、密度[27]、粘性[28]、介电常数[29]及扩散性质[30]等。因此,如果存在与待分离的目标物质物理性质相似的物质时,就很难保障分离效率。基于酶分子对其底物浓度梯度的趋向性,宾夕法尼亚州立大学的Cremer课题组[31]提出了一种自发的分离方法,可以从酶分子的混合物中分离出能够催化某种特定底物的酶分子。如图7所示,他们设计了具有2个进口和5个出口的微流控通道,一个进口用于通入含有了特定底物的缓冲液,另一个进口用于通入两种带有不同荧光标记的酶溶液。两种溶液同时通入时发生层流,底物的扩散在通道中形成横向的浓度梯度,由于能够催化该底物的酶扩散变快,在通道中横向分布变宽,表现出所谓的“趋化性”,最后在底物浓度高的一侧的出口处,流出的可催化反应的酶的浓度高于无催化活性的酶。与其它非标记技术相比,趋化分离主要是基于有活性的酶分子扩散系数的底物浓度依赖性,是一种自发、简单且对酶分子无损伤的分离方式。这种分离技术可以推广应用于分离其它活性催化剂及活性极低或无活性的催化剂。
4 展 望
酶分子可以利用酶促反应过程中释放的能量驱动自身发生运动,即自驱动。酶分子的自驱动作用对从生物转运到酶分子驱动的纳米或微米智能马达的设计等方面的研究产生非常重要的影响。利用环境中底物催化所释放的能量可实现微米或纳米尺度物体的自驱动,通过底物转化产生的能量驱动不对称颗粒在微米或亚微米尺度物体的运动已多有报道。酶分子的自驱动能力、多样性和高效性必将极大地扩展和丰富利用酶分子构建纳米和微米马达的新方法,为新型马达的发展奠定了坚实的基础。此外,如果将这些酶分子催化体系固定到界面上,产生的机械力将会转移到周围的液体,基于此可设计各种各样的酶分子微型泵,用于药物、小分子或胶体的运输,而且可以很好地避免非酶类生物催化剂所引起的生物相容性差的问题。最后,利用酶分子的生物“趋化性”行为,还可以在酶分子各自的活性底物存在时,无标记且无损地对酶分子及其它活性催化剂进行分离。然而,将基于酶分子的人工合成马达或泵真正用于生物体系中,实现特异性的、定点的分子传送或药物运输,还存在巨大的挑战,需要对激活机制、运动的精确控制、生物稳定性等因素进行严密评估。
References
1 Riedel C, Gabizon R, Wilson C A, Hamadani K, Tsekouras K, Marqusee S, Presse S, Bustamante C. Nature, 2015, 517(7533): 227-230
2 Yadav V, Duan W, Butler P J, Sen A. Annu. Rev. Biophys., 2015, 44(1): 77-100
3 Puchner E M, Gaub H E. Annu. Rev. Biophys., 2012, 41(1): 497-518
4 Goel A, Vogel V. Nat. Nanotechnol., 2008, 3(8): 465-475
5 Sengupta S, Dey K K, Muddana H S, Tabouillot T, Ibele M E, Butler P J, Sen A. J. Am. Chem. Soc., 2013, 135(4): 1406-1414
6 Lipowsky R, Beeg J, Dimova R, Klumpp S, Liepelt S, Muller M J I, Valleriani A. Biophys. Rev. Lett., 2009, 4(01n02): 77-137
7 Adler J. Science, 1969, 166(3913): 1588-1597
8 Berg H C, Brown D A. Nature, 1972, 239(1): 500-504
9 Sengupta S, Patra D, OrtizRivera I, Agrawal A, Shklyaev S, Dey K K, Co′rdovaFigueroa U, Mallouk T E, Sen A. Nat. Chem., 2014, 6(5): 415-422
10 Yu H, Jo K, Kounovsky K L, de Pablo J J, Schwartz D C. J. Am. Chem. Soc., 2009, 131(16): 5722-5723
11 Muddana H S, Sengupta S, Mallouk T E, Sen A, Butler P J. J. Am. Chem. Soc., 2010, 132(7): 2110-2111
12 Dey K K, Zhao X, Tansi B M, MendezOrtiz W J, CordovaFigueroa U M, Golestanian R, Sen A. Nano. Lett., 2015, 15(12): 8311-8315
13 Wang W, Duan W, Ahmed S, Sen A, Mallouk T E. Acc. Chem. Res., 2015, 48(7): 1938-1946
14 Sengupta S, Ibele M E, Sen A. Angew. Chem. Int. Ed., 2012, 51(34): 8434-8445
15 Sanchez S, Soler L, Katuri J. Angew. Chem. Int. Ed., 2015, 54(5): 1414-1444
16 Wang H, Pumera M. Chem. Rev., 2015, 115(16): 8704-8735
17 Campuzano S, Kagan D, Orozco J, Wang J. Analyst, 2011, 136(22): 4621-4630
18 Guix M, MayorgaMartinez C C, Merkoci A. Chem. Rev., 2014, 114(12): 6285-6322
19 Hong Y, Blackman N M, Kopp N D, Sen A, Velegol D. Phys. Rev. Lett., 2007, 99(17): 178103
20 Baraban L, Harazim S M, Sanchez S, Schmidt O G. Angew. Chem. Int. Ed., 2013, 52(21): 5552-5556
21 Bunea AI, Pavel IA, David S, Gaspar S. Biosens. Bioelectron., 2015, 67: 42-48
22 Baraban L, Tasinkevych M, Popescu M N, Sanchez S, Dietrich S, Schmidt O G. Soft. Matter., 2012, 8(1): 48-52
23 Patra D, Sengupta S, Duan W, Zhang H, Pavlick R, Sen A. Nanoscale, 2013, 5(4): 1273-1283
24 Wang W, Duan W, Ahmed S, Mallouk T E, Sen A. Nano Today, 2013, 8(5): 531-554
25 Zhang H, Duan W, Liu L, Sen A. J. Am. Chem. Soc., 2013, 135(42): 15734-15737
26 Masaeli M, Sollier E, Amini H, Mao W, Camacho K, Doshi N, Mitragotri S, Alexeev A, Di Carlo D. Phys. Rev. X, 2012, 2(3): 031017
27 Ito Y, Shinomiya K. J. Clin. Apheresis, 2001, 16(4): 186-191
28 Kwon K W, Choi S S, Lee S H, Kim B, Lee S N, Park M C, Kim P, Hwang S Y, Suh K Y. Lab Chip, 2007, 7(11): 1461-1468
29 Cui H, Voldman J, He X, Lim K. Lab Chip, 2009, 9(16): 2306-2312
30 Weigl B H, Yager P. Science, 1999, 283(5400): 346-347
31 Dey K K, Das S, Poyton M F, Sengupta S, Butler P J, Cremer P S, Sen A. ACS Nano, 2014, 8(12): 11941-11949
Abstract It is traditionally assumed that enzymatic reaction does not perturb the diffusion of an enzyme iteself. Recent studies have shown that the diffusivity of enzymed increased in a substratedependent manner during catalysis. Thus, the energy released during enzyme catalysis can be used to propel nanoscale objects, e.g. molecule motors driven by enzymatic reactions. Although the dependence of enzyme diffusion on substrate has been reported in several different enzyme systems, the precise origin of this phenomenon is still unknown yet. However, sevral possible mechainsms have been proposed for the enhanced diffusion. This review illustrates recent progresses in the research on the influences of enzymatic reaction on the diffusivity of enzyme, including the change of diffusion coefficient of enzymes, potential mechanisms and related applications.
Keywords Enzyme reaction; Diffusion coefficient; Chemotaxis; Selfpropelled; Nanomotor; Review
- 政务微博的有效传播
- 苏俄媒体研究是中国发展的镜鉴
- 延伸纸媒价值,产业反哺报业
- 节目主持人的危机管理与危机教育
- 社会性突发事件中媒介传播的误区与对策
- “舆论场、宣传场与舆论机构”的种种悖论
- 从责任意识和社会担当论传统纸质媒体的未来
- “ALS冰桶挑战”事件的传播学思考
- 用互联网思维加强和改进舆论引导的思考
- 与新兴媒体融合 发地市党报强音
- 当前我国传统媒体融合发展的问题、目标与路径
- “全媒体”难以拯救报业
- 媒介融合:从政策到生产与消费的关系转型
- 魏晋风骨与民国报人
- 探索提升博士生科研能力之路
- 当下高校校园媒体的资源融合途径探析
- 米德的符号互动论思想以及对美国传播学研究的影响和贡献
- 新闻教育要注重实践品格
- 论电视新闻的形象化运用
- 从受众变化看信息时代电视新闻的创新
- 农村热点问题透视与舆论引导
- “主旋律”“正能量”和党报的历史使命
- 政府与媒体良性互动的技巧和原则
- 省级党报官方微博的内容分析与思考
- 地市党报如何服务党委中心工作
- self-transcendences
- self-transcending
- self-transformation
- self-transformations
- self-transformed
- self-treated
- self-trial
- self-trials
- self-troubled
- self-troubling
- self-trusting
- self-tuition
- self-tuitions
- self-unconscious
- self-understandings
- self-understood
- self-undoing
- self-uniform
- self-uniforms
- self-union
- self-unions
- self-unities
- self-unity
- self-unloading
- self-usurp
- 毛雨
- 毛青白色相杂的马
- 毛面东家
- 毛面畜生
- 毛颖
- 毛颖氏
- 毛驴
- 毛驴不戴笼嘴套——占了嘴的便宜,也吃了嘴的亏
- 毛驴备上银鞍——不配
- 毛驴子烂蹄子——家里外头乱刨圈
- 毛驴拉磨——光转圈
- 毛驴拉磨——兜圈子
- 毛驴拉磨——出不了圈
- 毛驴拉磨——原地打转
- 毛驴撞草垛没有长眼
- 毛驴穿大褂——假充大圣人
- 毛驴背上的银鞍子——有点不配
- 毛驴蛋子不戴笼嘴套——占了嘴的便宜也吃了嘴的亏
- 毛驴跳过一条沟,就说自己是一匹马
- 毛骨
- 毛骨俱竦
- 毛骨悚然
- 毛骨悚然毛骨耸然
- 毛骨森然
- 毛骨森竖