杨茵 吴星


摘要: 通过对教学中常见的质料类推、形式类推、模型类推三大类推中具体事例“反常”现象的分析和讨论,提出类比推理具有或然性,在高中化学教学应谨慎应用类比推理。
关键词: 或然性; 质料类推; 形式类推; 模型类推; 化学教学
文章编号: 10056629(2019)10008605中图分类号: G633.8文献标识码: B
培养学生化学核心素养是新一轮课程改革的核心,教师通过教学活动要帮助学生逐步形成正确价值观、必备品格和关键能力。要提高学生化学的学习能力,必须重视对化学思维能力的培养。而类比推理(简称类推或类比)是培养学生思维能力的有用工具。运用类推,可以使抽象的概念变得易于理解,可以使陈述性知识变得程序化、复杂的问题变得简单化。
1 类比推理的内涵
类比推理是人类核心的认知能力之一,类推思想由来已久,普遍存在于探索现实世界的过程中。类比推理在上个世纪70年代获得长足的发展[1]。
迄今为止,国内外对类比推理的研究不仅涉及理论的研究,深入到教学过程的研究也越来越多,尤其对理科教学的研究最为突出。
不同时代和不同研究领域,对类推定义有所不同,目前比较认可的类比推理定义是根据两个(或两类)对象之间在某些方面的相同或相似点从而推断出它们在其他方面也可能相同或相似的一种逻辑推理方法。其逻辑形式如下: 因为A对象具有属性a、 b、 c、 d, B对象具有属性a、 b、 c,所以B对象也可能具有属性d。类推过程也就是问题解决的过程,一般分为三个阶段: 首先,寻找合适的类推情境(也叫源问题);其次,找到并分析命题之间、对象之间及关系之间的对应或映射;最后,以某种方式应用于新情境,用来描述或解释新的情境(即靶问题)。在类推的过程中,有许多因素影响类推,如相似性和结构。在类推中,相似性是基础,是表层的,而结构的一致性是深层次的,它在类推理论分析中占重要地位[2]。
在化学教学中,类推思想也是一种常用的思维方法。在概念学习中,类推可以帮助学生利用已有的知识形成并完善对新概念的理解。在题目解答中,类推可以以“旧”推“新”,把知识进行迁移运用。但类比推理把化学知识从一种情境(或叫源问题)迁移至另一种情境(或叫目标问题),依据的是两个情境间有某种相似性[3]。问题之间具有相同点或相似点,这使类推成为可能,但问题之间必有差异,这就使类推的结论带有或然性[4],也就是说类比推理具有可能推出不必然结果的缺陷。
2 高中化学教学中谨慎应用类比推理
根据类推的分类再结合化学学科的特点,笔者认为类比推理在高中化学中有三种较为常用的方式,本文将结合自己的教学实践和体会,通过讨论试题或教学中的具体实例,阐述在处理常见三类类比推理方式中运用类推存在的误区,和同行们讨论。
2.1 质料类推中谨慎应用类比推理
所谓质料类推,就是根据类比物的性质与应予解释的系统的性质之间的类似性所进行的类推[5]。化学中的质料类推就是依据两种研究物质结构和性质在某些方面的相似之處,推断这两种物质在其他方面也存在相似之处,如图1所示。
质料类推是类推方法中比较简单的类型,这种类推仅以两种研究物质结构和性质在某些方面的相似之处为依据,所以这种类推相对肤浅,具有或然性。
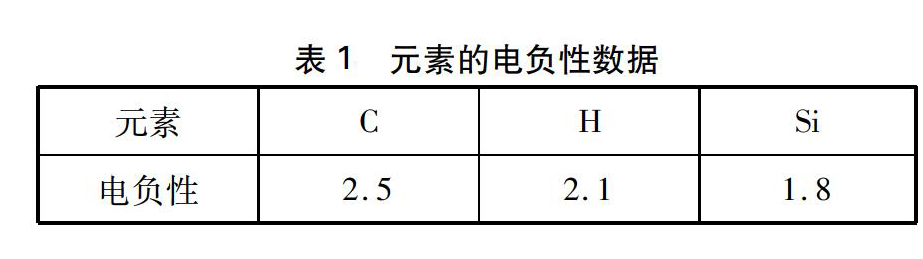
同族元素化学性质相似是学习元素化合物知识进行类推的一个重要依据,但类推时反常也非常多,教师教学中要引起重视。例如碳与硅是同族元素,甲烷是一个稳定的分子,不能与水反应。那么能否类推出硅烷不与水反应呢?实验证明硅烷能与水发生反应。苏教版的《物质结构与性质》提供的C、 Si、 H三种元素的电负性数据如下(见表1)。
在有机化学的教学中,教师常会强调具有相同官能团的物质化学性质相似,可见类推在有机化学的教学中是一个典型的教学策略。醛基能使新制氢氧化铜还原生成氧化亚铜,那么由此能否类推所有含醛基的物质都有相似性质呢?苯甲醛也能与新制氢氧化铜反应吗?在2018年江西省九所重点中学高三联合考试理综试卷中就出现了对这个知识点的考查:
某抗肿瘤药物中间体的合成路线如下。下列说法正确的是()
A. 吲哚的分子式为C8H6N
B. 苯甲醛中所有原子不可能全部共平面
C. 可用新制氢氧化铜悬浊液区分苯甲醛和中间体
D. 1mol该中间体,最多可以与9mol氢气发生加成反应
提供的答案是C,理由是苯甲醛有醛基,而中间体没有醛基,所以可用新制氢氧化铜悬浊液来区分两者。但查阅《有机化学》,书中这样解释,苯甲醛中醛基的碳发生sp2杂化,碳氧键中存在一个σ键和一个π键,其中的π键能和苯环的大π键发生共轭效应,分子内能低、稳定性高,导致苯甲醛中的醛基非常牢固,不易被氧化。若进行试验,在苯甲醛中加入新制氢氧化铜悬浊液,加热后,并没有砖红色沉淀出现,这也证实了苯甲醛不能与新制氢氧化铜悬浊液反应。有机物的教学中教师一定要注意基团间的相互影响造成有机物性质的变化,如乙醇没有酸性,而苯酚有酸性,这是苯环影响了羟基,在的共轭体系中,电子云向苯环偏移,使得羟基氧上的电子云密度降低,使O—H中的氢酸性增强。
我们在教学生运用性质进行类推时,一定要强调,不仅要关注两种物质结构和性质的相似处,更要关注两种物质属性间的必然联系,也就是造成它们结构和性质相似的本质原因是否相同,这样的类推才有的放矢,类推的结论更可靠。
2.2 形式类推中谨慎应用类比推理
形式类推是依据类比物与应予解释的系统两个领域的因果关系或规律性相似而进行的类比[6]。化学中的形式类推就是将解决某一类化学问题的方法以及经验移植到类似化学问题的处理过程中,最终实现类似问题的解决,如图2所示。
形式类推是以相似的因果关系成规律性为依据的,较质料类推可靠性增强,但也不是不存在或然现象。例如,氢氧化铝的两性的教学,教师对于酸性或碱性的常见经验就是酸碱电离理论,所以这个问题常处理成氢氧化铝在溶液中既存在酸式电离,又存在碱式电离:
按照教师的讲解,学生很容易误会Al(OH)3水溶液既显酸性又显碱性,好像很矛盾,学生顿时糊涂了。在这里我们需要弄清楚两个问题。第一,氢氧化铝溶液究竟显酸性还是碱性?第二,氢氧化铝溶液存在酸式电离吗?这样的类推合适吗?
查阅资料可知,Al(OH)3的Ka=6×10-12, Kb=5×10-9,由酸式电离常数和碱式电离常数的相对大小可看出碱式电离程度较酸式电离程度大,其溶液碱性强于酸性。正如武汉大学《无机及分析化学》2008年2月第3版第249页中所说,氢氧化铝是典型的两性氢氧化物,其碱性略强于酸性但仍属弱碱[7]。熊绍良在“实验探究氢氧化铝水溶液的酸碱性”一文中指出,室温下,他用二氧化碳蒸馏水溶解分析纯的氢氧化铝固体,通过pH计测定其饱和溶液pH约为8.26,过饱和溶液pH约为9.02。实验检测结果也表明氢氧化铝饱和溶液呈现弱碱性。
既然氢氧化铝溶液显弱碱性,那么氢氧化铝溶液存在酸式电离吗?查阅了多本大学的无机化学书,只有Al(OH)3能碱式电离,并没有Al(OH)3能酸式电离的说法。《无机化学》中对Al(OH)3能与OH-反应的解释是生成了[Al(OH)4]-,即: Al(OH)3+H2O +H+,如此就可以解释氢氧化铝的酸性了。根据酸碱电子理论,凡能接受电子对的物质(分子、离子或原子团)都称为酸,凡能给出电子对的物质(分子、离子或原子团)都称为碱。也就是说,酸是电子对的受体,所以氢氧化铝的酸性表现为它能接受氢氧根,而不是电离出氢离子。由此可见,用一般的酸碱电离理论来进行形式类推会出现科学性的错误。同样道理,我们在判断含氧酸[(HO)mROn]属于几元酸时,常用电离出H+的个数也就是羟基的个数来进行判断。如果用这种方法对硼酸(H3BO3)进行类推,那么,硼酸(H3BO3)分子有三个羟基,它就是三元酸。但事实上,H3BO3是一元酸。因为H3BO3的酸性不能用酸碱电离理论解释,而是要用酸碱电子理论解释。因为一分子H3BO3能与一分子水电离出的一个OH-反应生成H4BO -4,即: BOHHOOH+H2O+H+,所以H3BO3是一元酸。
元素周期律的學习中常要比较非金属元素气态氢化物的稳定性,通常用“同一周期从左到右,元素的非金属性逐渐增强,非金属元素的气态氢化物稳定性逐渐增强”这样的规律来类推。根据规律,稳定性: CH4
通过上述例子可以看到,形式类推也存在或然性。鉴于化学问题的复杂性,解决某类问题的经验或方法并不能完全迁移应用,需要我们加强专业学习,拓宽专业视野,提高类推的可靠性。
2.3 模型类推中谨慎应用类比推理
质料类推和形式类推的源问题和靶问题都是化学中的同质问题,而模型类推中的源问题往往不带化学属性,可能只是和靶问题具有某些相似性的实物模型。在化学中的模型类推就是用宏观的模型来代替或描述微观的物质或性质,说明它的存在,如图3所示。
化学是在原子、分子等水平上研究物质的组成、结构和性质,在原子、分子等微观世界中,很多抽象的信息让学生难以理解,如果教师将之与一些生活中的宏观物质、宏观现象相比较,用适当的模型代替,就会变得生动和具体,易于学生理解和掌握。但在类推时也要注意适用性,要不然容易出现问题。如在讲解碰撞理论时,常用“投篮”类比微粒间的碰撞。这样的类推的确能让学生理解有效碰撞需要一定运动取向和能量。但这个类推存在一个问题,就是“投篮”和微粒运动的本质不一样,投篮是主动有目的的行为,而微粒运动是杂乱无序的。因此,容易让学生误会微粒发生的有效碰撞也是微粒间运动有序的行为。
教学中常用水池蓄水或进出展览馆的人数来类推平衡,水池蓄水如图4所示。显然,当V1(H2O)=V2(H2O)时,水池中水的体积保持不变,达到了“平衡状态”。这样的类推容易使学生以为化学平衡也是这种“收支平衡”。其实,两者本质不同。化学平衡只有在封闭系统里才能达成,收支平衡却是一个开放系统。 化学平衡是平衡态,而收支平衡却是稳定态。试想,若我们减少入水管的流量,该系统会不会自发地减少出水管的流量来维持收支平衡呢?显然不会。 但化学平衡却是个自发的动态平衡,两者在本质上是有差异的,教师在类推时一定要告知学生两者本质上的差异,帮助学生从本质上理解化学平衡。
- “师生学习共同体课堂”——和谐课堂新境界
- 论校长在学校文化建设中的角色
- 海外新书概览
- 国外教育动态
- 教科文组织研讨全球金融经济危机对多边合作及教育的影响
- 美国教育部长:抓住机遇,推动教育改革
- 浅谈初中生英语听力能力的培养
- 浅谈作文教学的生活化
- 幽默——让学生爱上课堂
- 构建“适应性”课堂教学
- 关于新课改下的课堂教学
- 罗恩·克拉克的家庭作业管理经验及其启示
- “反串”彰显个性 “互动”孕育成功
- 做好区域教育规划 办出区域教育特色
- 韩国20世纪80年代以来课程改革的主要特征探析
- 友善用脑学习 促进教师职业发展
- 日本“宽松教育”黯然收场及其原因
- 数字时代的足迹
- 为学生营造丰富的数字学习环境
- 中外基础教育信息化规划与实践综览
- 为区域教育注入“自主”之魂
- 建设数字化校园 提升学校管理品质
- 数字化校园建设的一些思考
- “建设数字化校园,践行素质教育”的实践探究
- 推进数字化校园建设 服务区域教育发展
- entomologies
- entomologist
- entomologists
- entomology
- entourage
- entourages
- entrail
- entrails
- entrance
- entranced
- entrancement
- entrancements
- entrance's
- entrances
- entrancing
- can openers
- canopies
- canopy
- canopying
- can read
- can rely/depend on sth
- cans
- can see
- can see/can tell
- cansful
- 白皙的肌肤
- 白皙的脸
- 白皮书
- 白皮猪
- 白皮货
- 白盐
- 白盛
- 白相人
- 白相人嫂嫂
- 白眉
- 白眉人
- 白眉公子
- 白眉名
- 白眉扯眼
- 白眉良
- 白眉赤眼
- 白眉赤脸
- 白眉郎
- 白眉长
- 白眼
- 白眼儿
- 白眼儿狼
- 白眼狼
- 白眼狼戴眼镜
- 白眼狼戴草帽