徐汪华

摘要: 正二十面体及其衍生物是中学化学竞赛的热点,甚至在高考试题中也常出现。介绍了正二十面体的衍变过程,对硼二十面体B12、足球烯C60、复杂阴离子[CB11H6Cl6]-等的结构进行了探讨,并提出了一些教学建议。
关键词: 化学竞赛; 发散思维; 正二十面体
文章编号: 1005-6629(2019)11-0093-04? ? ? ? ? ? 中图分类号: G633.8? ? ? ? ? ? 文献标识码: B
引言
“证据推理与模型认识”是化学学科核心素养[1]五个方面之一,它反映的是化学学科思维方法。在教学中,如果引入一些模型,往往可以使问题的处理大为简化,从而便于我们去认识、掌握并应用它们。在化学教学中,模型的建立,具有十分重要的意义。本文从正二十面体出发,对硼二十面体B12、足球烯C60、复杂阴离子[CB11H6Cl6]-等的结构进行探讨,以期拓展教学思路,提高教学效率。
1? 初步认识正二十面体
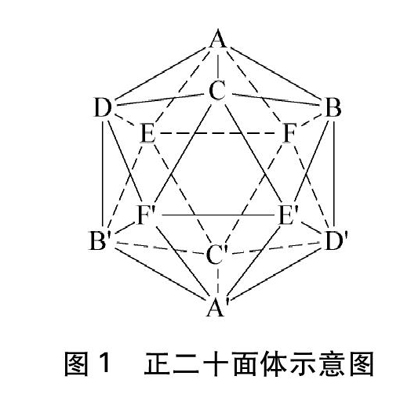
正二十面体是由20个全等的等边三角形所围成的凸正多面体,共有20个面,12个顶点(5个正三角面围出一个正五重顶),30条棱,6条C5旋转轴(通过每一对相对着的五重顶有一个五重旋转对称轴),如图1和表1所示。
图1? 正二十面体示意图
为便于理解和记忆,从C5(A-A′)方向看,我们把正二十面体看作是“雨伞A-BCDEF”(记作:“雨伞A”;其中A看作是“伞顶”;B、 C、 D、 E、 F看作是“伞扣”;△ABC、 △ACD、 △ADE、 △AEF和△AFB看作是“伞面”;正五边形BCDEF看作是“伞边”;A-A′看作是“伞柄”;其余依此类推)和“雨伞A′-B′C′D′E′F′”交错“相扣”,中间夹着“平台BCDEF-B′C′D′E′F′”(正五边形BCDEF看作是该平台的“上底面”;正五边形B′C′D′E′F′看作是该平台的“下底面”;2个正五边形的每一条边都可以看作是等邊三角形的底边,该平台的侧面共由10个等边三角形构成)。
表1? 正二十面体的结构说明
名? ? 称数目
顶点A、 A′、 B、 B′、 C、 C′、 D、 D′、 E、 E′、 F、 F′12
面△ABC; △ACD; △ADE; △AEF; △AFB;
△A′B′C′; △A′C′D′; △A′D′E′; △A′E′F′;
△A′F′B′;
△BCE′; △CDF′; △DEB′;
△EFC′;
△FBD′; △B′C′E; △C′D′F;
△D′E′B; △E′F′C; △F′B′D20
棱AB; AC; AD; AE; AF; A′B′; A′C′;……30
C5轴A-A′、 B-B′、 C-C′、 D-D′、 E-E′、 F-F′? 6
2? 从正二十面体出发,进一步认识硼二十面体
若图1正二十面体中12个顶点分别被1个B原子所占据,则得到如图4-(a)的硼二十面体B12。
单质硼有多种复杂的晶体结构,其中最普通的一种是σ-菱形硼,其基本结构单元为正二十面体的对称几何构型[2],每个面近似为一个等边三角形,20个面相交成12个顶角,每个角顶为一个硼原子所占据,然后由B12的这种20面体配布起来组成六方晶系的σ-菱形硼。
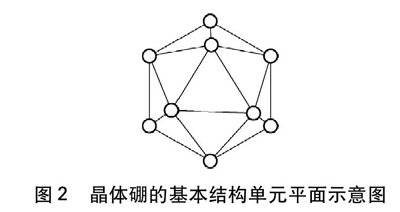
例题1? 晶体硼的基本结构单元都是由硼原子组成的正二十面体,其中含有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子,其平面示意图如图2所示,请回答:
图2? 晶体硼的基本结构单元平面示意图
(1) B—B键键角为? ? ? ? ;
(2) 晶体硼中硼原子的个数为? ? ? ? ;B—B键有? ? ? ? 条。
[答案](1)60°;(2)12;30。
[解析]“晶体硼的基本结构单元都是由硼原子组成的正二十面体,其中含有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子”B—B键键角为60°。
由图2可以看出,每个顶点为5个等边三角形的面所共有每个顶点只有1/5属于该等边三角形的面由20个全等的等边三角形所围成的正二十面体的顶点数=晶体硼中硼原子的个数=3×20×1/5=12。
由图2还可以看出,每条边为2个等边三角形的面所共有每条边有1/2属于该等边三角形的面由20个全等的等边三角形所围成的正二十面体的棱边数=晶体硼中B—B键数=3×20×1/2=30。
3? 从正二十面体出发,进一步认识C60
碳足球也叫足球烯,是一种球碳分子C60,如图3。对于这种复杂的结构,教师往往感到不好讲解,学生往往感到不好理解。面对这些困惑,如果我们从正二十面体出发,用“发展”的眼光来看,问题就可迎刃而解。
图3? C60结构示意图
若将图1正二十面体中每个顶点按一定比例且同等程度地削去(切点不重合),即可得到像足球一样的三十二面体,此三十二面体含12个正五边形(正二十面体中由5个正三角面围成的每个顶点被削后变成1个正五边形),20个正六边形(正二十面体中每个正三角形面被削后变成1个正六边形),60个顶点[正二十面体有30条棱,每条棱有2个三等分点(如图1中的棱AB上有2个三等分点,其中靠近A的三等分点记作AB,靠近B的三等分点记作BA,其余依此类推),共得到60个点],正二十面体切割前后点、线和面衍变的情况参见表2。若此三十二面体中每个角顶为一个C原子所占据,则得到C60。
表2? 正二十面体切割前后衍变情况对比
切割前的正二十面体切割后的三十二面体(C60)
12个顶点12个正五边形
20个正三角形面20个正六边形
30条棱60个顶点
例题2? (1997年全国高考化学试题第36题)
1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图3),该结构的建立基于以下考虑:
① C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
② C60分子只含有五边形和六边形;
③ 多面体的顶点数、面数和棱边数的关系,遵循欧拉定理: 顶点数+面数-棱边数=2。
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
请回答下列问题:
(1) 固体C60与金刚石相比较,熔点较高者应是? ? ? ? ,理由是:? ? ? ? ? ? ? ? ?。
(2) 试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)? ? ? ? ,并简述其理由:? ? ? ? ? ? ? ? ?。
(3) 通过计算,确定C60分子所含单键数为? ? ? ? 。
(4) C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形的数目。C70分子中所含五边形数为? ? ? ? ,六边形数为? ? ? ? 。
[答案](1) 金刚石;金刚石属原子晶体,而固体C60不是,故金刚石熔点较高。(答出“金刚石属原子晶体”即给分)
(2) 可能;因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60。(只要指出“C60含30个双键”即给分,但答“因C60含有双键”不给分)
(3) 依题意,C60分子形成的化学键数为: 12×(3×60)=90,
也可由欧拉定理计算键数(即棱边数): 60+(12+20)-2=90,
C60分子中单键为: 90-30=60。
(4) 设C70分子中五边形数为x,六边形数为y。依题意可得方程组:
12(5x+6y)=12(3×70)? ? ? (键数,即棱边数)
70+(x+y)-12(3×70)=2(欧拉定理)
解得: 五边形数x=12,六边形数y=25。
[解析](1) 固体C60为分子晶体,而金刚石为原子晶体。一般来说,分子晶体的熔点低,而原子晶体的熔点高。所以,固体C60与金刚石相比较,熔点较高者应是金刚石。
(2) 已知“C60分子所含的双键数为30”即每个C60分子含30个双键C60跟F2在一定条件下,能发生加成反应生成C60F60: C60+30F2C60F60。
(3) 方法一: 将化学问题抽象成数学问题求化学键总数。已知:“C60分子只含有五边形和六边形”,且“C60分子有12个五边形和20个六边形”球状多面体的顶点数=碳原子数=60;面数=碳原子形成的五边形数+六边形数=12+20=32;棱边数=碳原子间的共价键数(包括单、双键)。欧拉定理: 顶点数+面数-棱边数=2共价键总数=棱边数=顶点数+面数-2=60+32-2=90。又已知“C60分子所含的双键数为30”C60分子所含单键数为90-30=60。
方法二: 借助多面体的顶点数与棱边数的关系求化学键总数。“C60分子中每个碳原子只跟相邻的3个碳原子形成化学键”顶点数为60,且每个顶点连线三条边。每条边有两个顶点每个顶点占每条边的1/2C60分子形成的化学键数(棱边数)为: 60×3×1/2=90。又已知“C60分子所含的双键数为30”C60分子所含单键数为90-30=60。
方法三: 借助多面体的面数与棱边数的关系求化学键总数。已知:“C60分子只含有五边形和六边形”,“C60分子有12个五边形和20个六边形”且每条棱边为两个面共用棱边数=(12×5+20×6)×1/2=90。又已知“C60分子所含的双键数为30”C60分子所含单键数为90-30=60。
方法四: 由碳原子成键规律直接求单键数。“C60分子中每个碳原子只跟相邻的3个碳原子形成化学键”,且碳原子又必须是4个价键每个碳原子只含一个双键,两个单键单键数为双键数的2倍。又已知“C60分子所含的双键数为30”C60分子所含单键数为: 30×2=60。
4? 从正二十面体出发,进一步认识某些复杂阴离子
若图1正二十面体中A顶点被1个C原子所占据,且C原子上连接1个H原子(“A顶点被1个C原子所占据,且C原子上连接1个H原子”简称“A顶点被C—H所占据”,下面依此类推),A′顶點被B—Cl所占据,B、 C、 D、 E、 F分别被B—Cl所占据,B′、 C′、 D′、 E′、 F′分别被B—H所占据,则得到有一根C5旋转轴的[CB11H6Cl6]-,如图5-(a)。
例题3? (2001年全国高中化学竞赛初赛试题第10题)
最近有人用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离于化合物[HC60]+[CB11H6Cl6]-。回答如下问题:
(1) 以上反应看起来很陌生,但反应类型上却可以跟中学化学课本中的一个化学反应相比拟,后者是:? ? ? ? ?。
(2) 上述阴离子[CB11H6Cl6]-的结构可以跟图4-(a)的硼二十面体相比拟,也是一个闭合的纳米笼,而且[CB11H6Cl6]-离子有如下结构特征: 它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过。请在图4-(b)上添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子。
(a)
(b)
图4? B12及其骨架结构示意图
[答案](1) NH3+HClNH4Cl。(注: 答其他非质子转移的任何“化合反应”得1分)
(2) 参考图形: 图5-(a)。(注: 硼上氢氯互换如参考图形仍按正确论,但上下的C、 B分别连接H和Cl,不允许互换)
[解析](1) H(CB11H6Cl6)+C60[HC60]+[CB11H6Cl6]-,显然,这是质子转移的反应,是两种不带电荷的中性分子相互作用,产生了两种带相反电荷的离子。H(CB11H6Cl6)被称为“超酸”,是质子给予体,失去H+后变为[CB11H6Cl6]-;C60是质子接受体,得到H+后变为[HC60]+。该反应类似于中学化学课本中的反应: HCl+NH3NH4Cl,其中,HCl是酸,失去H+后变为Cl-;NH3得到H+后变为NH? +4。
(2) “[CB11H6Cl6]-的结构可以跟图4-(a)的硼二十面体相比拟,也是一个闭合的纳米笼”[CB11H6Cl6]-的“骨架”也是二十面體。“它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过”[CB11H6Cl6]-有一根C5旋转轴[CB11H6Cl6]-可能的结构如图5所示。
(a)
(b)
(c)
(d)
图5? [CB11H6Cl6]-可能的结构示意图
原答案的参考图形为图5-(a),且原答案注: 硼上氢氯互换如参考图形仍按正确论,但上下的C、 B分别连接H和Cl,不允许互换。原答案的意思是说: 图5-(a)符合题意,图5-(b)也算对,但图5-(c)和图5-(d)就不算对。
有资料说:“B、 C是正二十面体的骨架,但由于B是缺电子原子,而氯是富电子原子,因此C原子上一定要连接H原子,而不能连接Cl原子”。
笔者不以为然。笔者认为: 根据题意,[CB11H6Cl6]-可能的结构应有如图5所示的四种。图5-(a)符合题意,图5-(b)也算对,图5-(c)和图5-(d)也应算对。只不过后两者稳定性稍差些。
5? 两点建议
(1) 巧妙发散,拓展教学思路
如图6这样,从正二十面体出发,能加深我们对硼二十面体B12、足球烯C60、复杂阴离子[CB11H6Cl6]-等的进一步认识。
图6? 以正二十面体为发散点的教学思路
在教学中,倘若我们经常以某事物的结构为发散点,设想出利用该结构的各种可能性,我们的思维能力必将得到训练,思维空间必将得以拓展。
(2) 一题多解,提高教学效率
一题多解是对知识的升华和总结。在教学中,经常像解答例题2中第(3)小题那样,对同一道题目,从不同的角度,运用不同的思维方式,采用不同的解题方法进行解答,我们的教学效率必将得到提高。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版)[S]. 北京: 人民教育出版社, 2018: 3.
[2]武汉大学,吉林大学等校. 无机化学(下)[M]. 北京: 高等教育出版社, 1983: 224.
- 大数据背景下电商精准营销策略分析
- 高校非政府采购项目管理现状及对策研究
- 高校后勤人力资源管理中存在的问题与对策研究
- 新时期高校信息化教学建设的探索与实践
- 就业竞争力的内涵及维度探讨
- 基于对口单招的中高职会计专业课程柔性衔接问题的探讨
- 医药类高校高质量专利创造与专利运营研究
- 信息化时代高等教育管理创新探讨
- 大数据背景下高校信息化教学模式的构建分析
- 校企合作形势下高职人才培养质量保障体系建设探析
- 城市社区精细化治理内涵及模式研究
- 邻避型环境群体性事件的成因及治理策略分析
- 河南省农业产业化模式创新研究
- 国外科技馆免费开放经验借鉴与启示
- 通航产业发展背景下空域管理改革研究
- 天府新区成都直管区“产城人”融合发展研究
- 基于信息化背景的报社文书档案管理分析
- 基于大数据时代的档案价值及开发利用探究
- 基于用户网络信息行为的高校图书馆信息资源建设研究
- 新闻资料数据库建设开发和利用研究
- 浅议经济新常态下招商引资档案管理与应用的重要性
- 大数据技术时代档案信息管理思维与方式的变革
- 基于IPv6的艺术设计类创作资源共享平台构建研究
- 数据加密技术在计算机网络安全中的应用分析
- 时空信息云平台技术在国土资源信息化中的应用探讨
- discloister
- disclose
- disclosed
- discloser
- disclosers
- discloses
- disclosing
- disclosure
- disclosures
- disclosure's
- disco
- discoed
- discoing
- discolor
- discoloration
- discolorations
- discolorment
- discolorments
- discolour
- discolouration
- discoloured
- discolouring
- discolourment
- discolours
- discomfort
- 旧时对父母的一种孝行
- 旧时对皇帝的称呼
- 旧时对舅家或妻家的代称
- 旧时小儿的金属首饰
- 旧时小说戏曲中对仆人的敬称
- 旧时属下备文向上司呈报
- 旧时属吏对上级长官的通称
- 旧时岁时风俗之一
- 旧时巡夜的人打梆或敲锣报时
- 旧时广东、广西等地区使用的一角、二角、五角的银币
- 旧时广东、广西等地区通行的本位货币
- 旧时庙庵占有的土地
- 旧时形容丈夫气概
- 旧时形容居高位、掌大权的人宾客极多
- 旧时悬于官府大门外、让上诉者敲击的铃
- 旧时成批运输货物的组织
- 旧时打醮向天神奏事的表文
- 旧时拖欠的债务
- 旧时指上级长官
- 旧时指买下出倒的工厂或商店,继续营业
- 旧时指人无耻,行为和猪狗一样
- 旧时指代表本国政府到友邦回访
- 旧时指军队中发给官、兵的口粮或钱
- 旧时指在中央掌军权的大臣
- 旧时指女子受聘