黄熹 刘会会 毛兰群 熊彩侨 聂宗秀

摘?要?大脑是人体内功能最复杂、结构最精细的器官。脑内的化学物质种类众多,含量迥异,分布不一, 对这些重要分子进行分析表征一直颇具挑战性。质谱成像是一种具有高灵敏、免标记、化学专一性且可同时监测多种分子空间分布的新兴成像技术。质谱成像已广泛应用于神经退行性疾病、中枢神经肿瘤及脑中药代动力学的研究。本文简要介绍了质谱成像方法的基本原理和重要技术进展,并着重讨论了近年来质谱成像在上述脑神经科学领域中的代表性应用。
关键词?质谱成像; 脑神经科学; 基质辅助激光解吸电离; 解吸电喷雾电离; 评述
1?引 言
大脑是神经系统的最高级器官,负责支配人的运动、感觉、语言、情感等功能。大脑也是人体内结构最复杂的器官,可被分为两百个多精细亚区。脑神经化学的主要目标是在分子水平上揭示大脑的运行机制及中枢神经疾病的病理。在如此复杂的大脑中研究分子的空间分布和变化非常有挑战性。磁共振成像(MRI)[1]和正电子发射计算机断层显像(PET)[2]常用于研究脑中代谢物的空间分布,它们可以在活体条件下动态监控分子的变化,但其空间分辨率低,可监测物质种类少 [3]。目前,临床上对脑组织生物切片进行研究的手段主要为免疫组织化学技术, 该方法敏感性高、特异性好,但其结果的判别很大程度依赖于医师的诊断经验, 而且该方法耗时较长,难以对多种分子进行同时显色成像。
质谱成像是一种近年来发展迅速的探究分子空间分布的技术。它的工作原理是利用一个聚焦的电离源(激光、带电雾滴、离子源等)在生物组织切片上逐点轰击,切片中的分子解吸并电离,然后传入质谱仪中进行检测,将组织切片中所有点位的质谱图进行整合,即可得到分子在该切片中的二维分布图(图1)。目前,适用于组织切片的质谱成像的电离方式主要是基质辅助激光解吸电离(MALDI)和解吸电喷雾电离(DESI)[4]。不同于MRI和PET的实时活体成像, 质谱成像的优势在于可对组织切片中上百种分子同时进行高空间分辨的成像, 并兼有分析流程耗时短和误诊率低的优势。因此, 质谱成像技术在脑神经科学的研究及临床诊断方面均具有广阔的应用前景。本文将简要评述两种质谱成像的原理及质谱成像方法学的进展,然后着重介绍近年来质谱成像在神经退行性疾病与中枢神经肿瘤研究中的应用。
2?质谱成像原理
2.1?質谱成像的重要指标
在质谱成像技术中,以下指标相当关键:(1)空间分辨率:质谱成像通常采用逐点轰击的方式进行,相邻像素点的中心距离即为设定的空间分辨率,常以μm为单位, 该数值越小,代表空间分辨率越精细。空间分辨率精细度的上限主要取决于电离源的聚焦程度和质谱仪器的灵敏度, 电离源的聚焦区域直径通常要求小于设定的空间分辨率。(2)检测通量:指在一次质谱成像中所能检测出的不同分子种类的总量,通量决定于方法的灵敏度和质谱仪的质量分辨率。方法灵敏度越好, 质谱仪的质量分辨率越高,所能检测的分子总量越多。(3)分析时间:与所设置的空间分辨率及质谱仪的扫描速度有关。对于给定面积的切片,空间分辨率设置越精细,所需要的分析时间越长。设定的空间分辨率缩小1倍, 分析时长将增加至4倍(平方关系)。(4)质谱相关指标: 作为质谱分析方法,质谱中通用的指标(如质量准确度、质量分辨率、采集速度、灵敏度和检出限等)在成像实验中也较重要, 高性能的质谱仪常可提供更加丰富、准确的成像结果。
2.2?MALDI质谱成像
MALDI质谱成像首先需要将吸收紫外光的有机小分子基质均匀地沉积在待分析的组织切片上,常用的方法有升华法、电喷雾法、二流体雾化法和超声喷雾法等。 将已沉积基质的切片送入装有MALDI离子源的质谱仪后,使用紫外波长的激光对切片轰击。切片表面的有机基质吸收紫外光的能量,并将能量和电荷传递给生物分子,辅助它们解吸电离。在MALDI成像中,基质的种类、基质沉积的过程、激光的参数以及质谱仪的性能都会对成像图的效果产生影响[5]。MALDI成像的优势如下:(1)成像空间分辨率较高,可到达细胞级(小于5 μm)的水平; (2)可适用于不同种类分子(包括代谢物、脂类、蛋白、核酸及药物)的分析。目前,最先进的商品化仪器可达到40个像素点/秒的分析速度[6],大大缩短了MALDI质谱成像的分析时间,现在MALDI成像的局限性主要在于上机前的前处理耗时, 以及激光器维护费用昂贵。
2.3?DESI质谱成像
DESI质谱成像使用电喷雾产生的高速带电雾流斜向轰击组织切片,带电雾滴会萃取并电离生物切片中的分子,并与其一同进入质谱离子传输管[7]。DESI质谱成像的主要优势是:(1)不需要外加基质辅助电离,分析流程更迅速; (2)不需要激光,离子源构造简单, 维护成本低; (3)对质谱仪的要求较低, 简单的离子阱质谱仪就可支持DESI成像。与MALDI成像相比,DESI成像的工作流程便捷,因而在实时临床病理诊断上更有优势。然而,DESI成像的空间分辨率精度较低,且很难对大分子量的化合物(如多肽、蛋白及核酸等)进行分析。
3?质谱成像技术进展
脑部区域结构精细且生物分子种类繁多, 因此对质谱成像仪器及样品处理方法等都提出了很高的要求。本节简要概述近年来质谱成像技术的重要进展。
3.1?仪器研究进展
近年来,已有研究组将高质量分辨率的质谱仪(如傅里叶粒子回旋共振质谱(FTICR)和轨道阱(Orbitrap)质谱)应用于质谱成像中。高质量分辨率的仪器可比一般的仪器提供更丰富、更准确的分子质量信息,有助于脑部代谢组学和蛋白组学的研究。离子迁移谱作为质量分析器的前级分离装置, 可有效分离分子量相近而立体结构有所差异的分子。通过使用离子迁移谱串联的质谱仪进行成像分析,可大幅提高检出分子质谱峰的数量。在离子源方面, MALDI?激光后电离技术使用比解吸激光波长略长的第二束激光促进已被解吸气化的分子电离, 大幅提高了MALDI成像的灵敏度[8]。传统的MALDI成像采用的是光源不动、样品靶逐点移动的工作模式,一些仪器厂商通过不断改变激光入射位置的方法[8]或者使样品靶快速线式移动的方法[9], 大幅提高了质谱成像的分析速度。Kompauer等[10]开发的AP?SMALDI成像系统采用了大气压MALDI离子源以及Orbitrap质量分析器,实现了MALDI质谱的亚细胞级别成像(空间分辨率1.4 μm)。在DESI离子源方面, He等[11]开发了空气动力辅助电离技术,适用于大范围组织切片的成像,可在一次成像中识别上千种代谢物分子。
3.2?前处理方法研究进展
脑部中的重要化学物质包括无机盐、代谢物、脂类、多肽、蛋白和核酸等,分子量范围为101~106Da, 且电离行为迥异,因此,选择合适的MALDI基质对于MALDI成像结果至关重要。1,5?二羟基苯甲酸(DHB)、α?氰基肉桂酸(CHCA)对磷脂和多肽有较好的检出效果。对于分子量更大的蛋白质,常使用芥子酸(SA)作为基质。1,5?萘二胺[12]、去甲哈尔满[13]、槲皮素[14]等基质在正负离子工作模式下均可较好地检测磷脂分子。9?氨基吖啶(9?AA)[15]、盐酸1,5?萘二胺[16]、盐酸萘乙二胺[17]等基质适合在负离子模式下检测金属离子、寡糖、酸性代谢物以及磷脂等物质。对于某些较难电离或者含量较低的分子,则需要加入衍生化试剂以提高检测灵敏度。
由于脑部区域结构精细,很多时候需要高空间分辨率(小于20 μm)的质谱成像进行研究,这要求在前处理基质喷涂过程中,基质晶粒的尺寸也要足够细小。为制得精细的基质涂层, 常采用升华法[18]、鞘气辅助喷雾法[19]、电喷雾法[20]喷涂基质。本研究组提出使用加湿器产生细小的雾滴制备基质涂层,该方法检测灵敏度好、空间分辨率高[21]。
4?质谱成像用于研究神经退行性疾病
神经退行性疾病(如帕金森病、阿尔茨海默症(AD)、脑缺血等)会导致病人的认知和运动功能障碍,严重危害了中老年人的生命质量。目前,针对中枢神经系统的分析方法多使用脑组织匀浆或者脑脊液, 然而这种匀质的样本不能提供分子在解剖学位置上或特定细胞中的原位信息。质谱成像作为一种新兴技术, 可直观地表征蛋白、代谢物、脂质等分子在脑组织中的空间分布,从而为神经退行性疾病的分子机制提供更全面的解释。
帕金森病是一种导致运动性残疾的神经退行性疾病,其神经病理学特征为黑质致密部中多巴胺能神经元的丧失[22]。由于神经递质(如多巴胺、γ?氨基丁酸、5?羟色胺等)在脑内浓度低,电离效率差,常规的质谱检测手段很难对其进行原位检测。Shariatgorji等[23]采用2,4?二苯基吡喃鎓衍生这类伯胺神经递质,由于衍生化产物在紫外区有吸收, 而且以阳离子形式存在,神经递质以衍生化的形式被MALDI?FTICR质谱高效检测。在单边脑注射神经毒素6?羟基多巴胺的小鼠帕金森模型中, 在注射盐水的脑侧纹状体中含有多巴胺、3?甲氧酪氨及酪氨酸; 而在注射毒素的一侧中,上述神经递质浓度大幅下降。随后,他们将该方法用于1?甲基?4?苯基?1,2,3,6?四氢吡啶诱导的猴脑帕金森模型中。在注射神经毒素的猴脑中,5?羟色胺在麦纳尔底核、丘脑下区及黑质中含量比对照组高40%, 这可能是脑部对多巴胺缺失的补偿机制引起的。在该工作中,除了使用衍生化方法检测伯胺类神经递质,还对乙酰胆碱和甘油磷脂酰胆碱进行了研究。利用氘代的α?氰基?4?羟基肉桂酸作为基质,首次在胆碱能神经元中观察到了乙酰胆碱。当给小鼠注射乙酰胆碱酶抑制剂他克林后,被注射的小鼠脑中乙酰胆碱含量增加到对照组的7倍,而甘油磷脂酰胆碱的含量随之下降。该衍生化方案对于DESI成像也有较好的效果[24], 其它研究组用不同的试剂(如4?羟基?3?甲氧基肉桂醛[25]和对?三甲基铵基苯胺琥珀酰亚胺甲酸酯碘化物[26])对伯胺类神经递质衍生化,并进行MALDI质谱成像。
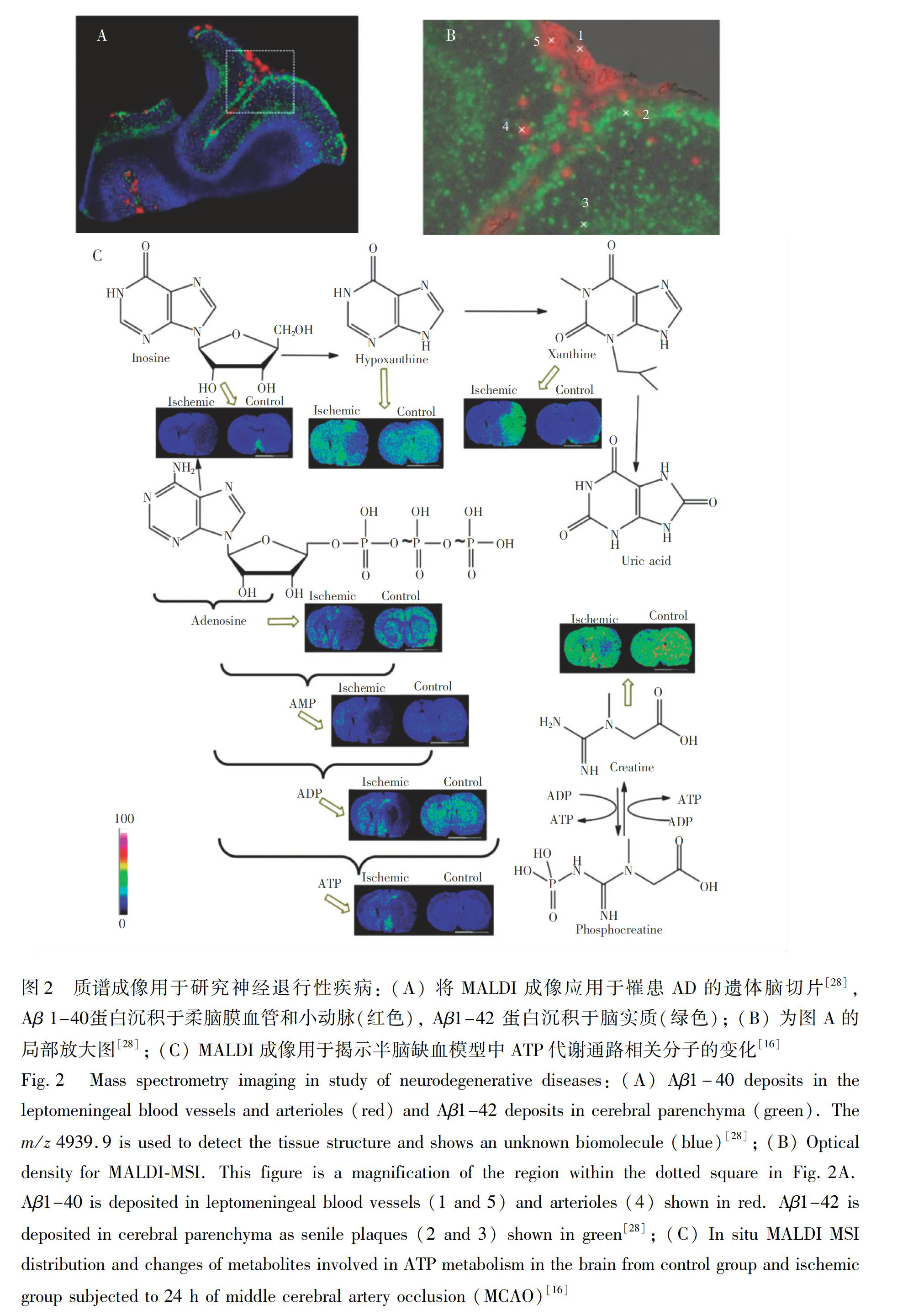
β?淀粉样多肽在脑部中聚集沉积是AD的早期重要特征[27]。β?淀粉样蛋白(Aβ)是由β淀粉样前提蛋白经β?或者γ?分泌酶酶切产生的拥有40个左右氨基酸的多肽。Kakuda等[28]利用MALDI质谱对遗体捐献的大脑样本进行成像, 研究了不同种类的淀粉样多肽在罹患AD和大脑淀粉样血管病的老年人脑中的分布。质谱成像结果表明,Aβ1-42和Aβ1-43多肽主要沉积在大脑的老年斑中,而Aβ1-36、Aβ1-37、Aβ1-38、Aβ1-39、Aβ1-40、Aβ1-41多肽則在柔脑膜中的血管内聚集(图2A和2B)。尽管Aβ1-42和Aβ1-41仅有一个碳末端氨基酸的差异,它们在脑中的空间分布却截然不同, 这可能由于这些多肽的自聚集能力差异。MALDI质谱成像中的空间特征和免疫组化染色结果吻合良好, 且拥有分析时间短、数据通量高的优势,是一种研究淀粉样蛋白沉积疾病的有潜力的技术。Kaya等[29]使用MALDI质谱成像对小鼠AD模型做了较全面的研究,
利用MALDI成像分析了转基因AD小鼠大脑内β?淀粉样斑中鞘脂的种类和分布特征,发现神经节苷脂和神经酰胺在β?淀粉样斑中聚集,而硫苷脂的含量在其中相对减少,该研究揭示了鞘脂类化合物的代谢在AD的发病机制中可能起到重要的作用。2017年,Kaya等[30]对转基因AD小鼠的大脑进行多工作模式的MALDI质谱成像。采用1,5?萘二胺作为基质, 对极性脂类分别进行了正、负离子工作模式的成像, 随后又用2,5?二羟基苯乙酮对蛋白进行分析。通过多工作模式的高空间分辨率(10 μm)成像,可以很好地研究蛋白和脂类的空间分布特征。该研究揭示了神经酰胺Cer(18∶0)、磷脂酰肌醇PI(38∶4)、硫苷脂ST(24∶0)和溶血磷脂酰胆碱LPC(16∶0)、LPC(18∶0)与β?淀粉样多肽Aβ 1-37、 Aβ 1-38和 Aβ 1-40的共定位关系。
继癌症和心脏病后,脑卒中成为致死数量第三位的疾病,脑缺血占脑卒中80%的病例[31]。脑缺血并发的症状可能有环境酸化、发炎、坏死直至神经元死亡。在脑缺血情况下,氧气和葡萄糖的供应被限制,糖酵解和三羧酸循环等相关代谢物都会发生显著变化。为了理解脑缺血中代谢通路的异常变化, 本研究组采用盐酸1,5?萘二胺作为新型基质, 对半脑缺血的大鼠进行MALDI质谱成像[16]。该基质作为一种铵盐,在负离子检测模式及基质背景干扰下,检测灵敏度高,在鼠脑切片中可得到氨基酸、有机酸、脂肪酸、寡糖、核昔类似物和膦脂等分子在鼠脑中的空间特异性分布。在执行脑缺血模型手术24 h后的大鼠体内,直接供能分子(如三磷酸腺苷、二磷酸腺苷和单磷酸腺苷)的含量显著降低, 其它代谢物(如腺苷、肌酐、次黄嘌呤、肌酸)含量也随之降低(图2C)。此外, 在半脑缺血区域中还可观察到钠钾平衡紊乱、抗氧化小分子减少等现象。
5?质谱成像用于研究中枢神经系统肿瘤
外科手术是治疗脑部肿瘤的关键步骤。成功的外科手术需要完全清理脑部肿瘤, 以免复发,但又需尽可能少地损伤正常脑组织。脑部组织功能重要且结构复杂,目前在脑科手术中, 常规的辅助成像手段(如MRI)很难将肿瘤组织与正常组织区分开来。病理染色方法仅限于一些核酸突变的样品,很难提供代谢物层面的信息。
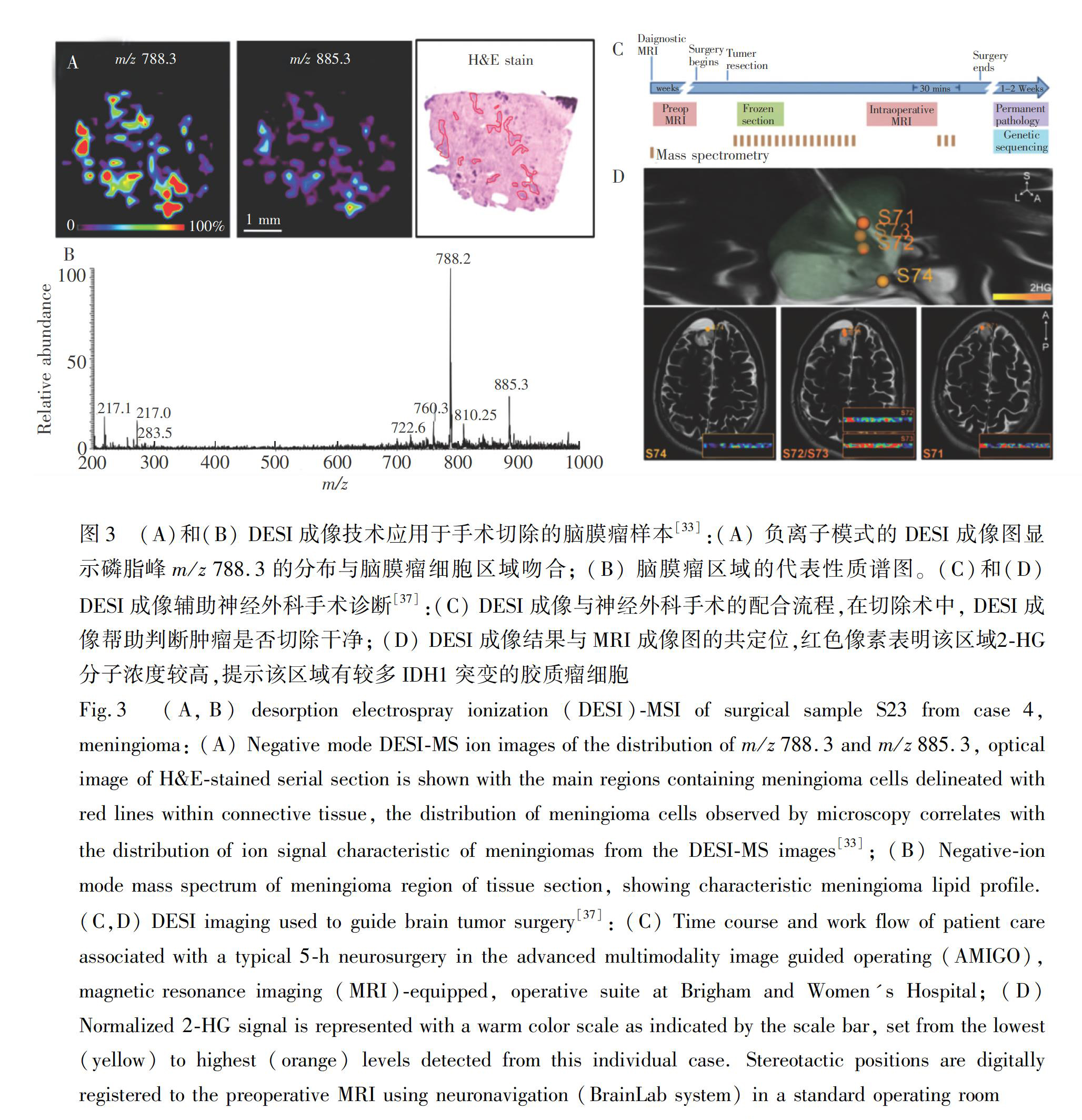
人脑组织中有丰富的磷脂,正常组织和肿瘤组织在细胞膜上表达的磷脂常有明显的差异。基于此,利用DESI技术对组织中的磷脂进行成像,可区分正常和肿瘤组织[32]。2013年, Ebrlin等[33]使用DESI成像结合支持向量机深度学习的方法,成功地将15例神经胶质瘤和8例脑膜瘤样本区分。在脑膜瘤样本中,主要的质谱峰有磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)和磷脂酰肌醇(PI),而且未出现神经胶质瘤中常见的硫苷脂(ST)(图3A和3B)[33]。 随后,该工作将DESI成像用于5个立体定位手术案例。通过DESI成像与MRI成像进行3D共定位,该方法可以很好地对肿瘤进行分型和分级, 并通过癌细胞浓度识别肿瘤边界。
除了脂质外,一些重要的小分子代谢物也可作为肿瘤的特异性生物标志物。异柠檬酸脱氢酶(IDH)突变常发生于低级别胶质瘤和继发性胶质母细胞瘤中[34]。IDH突变会导致柠檬酸转化为2?羟基戊二酸(2?HG)[35]。2?HG的积累会影响DNA甲基化模式、脯氨酰水解酶活性及细胞生长和分化。2?HG在正常细胞中含量极少,但在IDH1和IDH2突变的神经胶质瘤中大量积累, 因此可作为IDH突变神经胶质瘤的生物标志物。2014年,Santagata等[36]采用DESI技术在21个IDH1(R132H)突变的胶质瘤样本中检测出了2?HG, 而且2?HG的信号与肿瘤细胞密度正相关。在一个实时手术案例中, 他们利用DESI技术对手术切除的胶质瘤涂片进行成像。结合MRI的立体造影,DESI成像可以清晰地揭示出肿瘤中心和边缘区域的癌细胞浓度(图3C和3D)[37]。值得注意的是,通过后续免疫染色发现,该案例中的IDH突变位点为R132C,而非R132H。相比于免疫染色只能识别单一的突变位点, DESI成像表征2?HG浓度的方法对许多种IDH突变都有效。
6?质谱成像用于研究药物在脑中的药代动力学行为
血脑屏障是脑部毛细血管壁与神经胶质细胞形成的在血浆与脑细胞之间的屏障。血脑屏障的生理学意义在于将有毒物质或病原体阻隔在中枢神经系统之外。然而, 血脑屏障的致密结构以及较差的通透性会阻碍治疗中枢神经疾病的药物进入脑间隙。因此, 药物对血脑屏障的渗透率是药物筛选的重要指标[38]。在药物设计过程中, 针对脑部疾病的药物应尽可能有效地透过血脑屏障,而其它药物则应有低的渗透率,以减轻毒副作用。目前,观测药物分布的办法主要是放射性标记成像法, 然而放射性试剂价格昂贵,而且易造成假阳性和假阴性结果。质谱成像作为一种免标记高通量的成像方法, 非常适合观测药物是否能有效通过血脑屏障,从而发挥药效。2013年,Liu等[39]提出使用血红蛋白的辅基血红素标记血脑屏障的位置。血红素作为一种卟啉铁阳离子,在正离子模式的MALDI成像中可高灵敏地被检测出。通过与荧光标记比对,血红素的空间分布可与脑中血管腔的位置良好吻合; 在质谱成像中发现,治疗神经胶质瘤的小分子药物BKM120的信号与血红素并不重合, 而是弥散于整个脑部, 显示该药物已经有效透过血脑屏障。在另一组实验中, 研究了治疗星形细胞瘤的药物RAF265分别在颅内移植肿瘤模型(PVL311)中的分布。与血红素分布比对发现,RAF26大部分留存于肿瘤块的毛细血管内,而在正常脑组织中RAF26却未在血管内聚集(图4)。这可能是因为肿瘤区内的血管系统血流较慢,导致药物较难对外扩散。
Pokorny等[40]随后利用该方案研究了Wee1抑制剂MK?1775和替莫唑胺联合给药治疗神经胶质瘤的功效。在细胞实验中, GBM22神经胶质瘤细胞对MK?1775非常敏感。然而,在体内试验中,该方案治疗效果不佳。采用MALDI质谱成像比较MK?1775在颅内原位肿瘤模型和皮下肿瘤模型的分布, 皮下肿瘤模型的MK?1775质谱信号较均匀明显; 受血脑屏障影响, 在颅内原位模型中MK?1775的质谱信号较差,且在瘤内分布不均匀。
7?总结与展望
质谱成像法因其免标记、高通量、高灵敏的优势,已成为脑神经化学研究的有力工具。目前,质谱成像法在空间分辨率、分析通量以及分析速度方面已经有了显著进步。质谱成像对脑神经化学的研究在空间分辨率方面已可达到细胞级水平, 分析物质种类可涵盖金属离子、代謝物、多肽、蛋白和药物等多种类分子。质谱成像已被广泛应用于研究神经退行性疾病、中枢神经肿瘤及脑部药物代谢过程等方向。其中,质谱成像为临床手术提供快速活检数据,更是该技术近年来的亮点。在未来,质谱成像法技术应着重于定量方法学的发展。尽管不同研究组开展了质谱成像对药物或内源分子绝对浓度的测量方法,利用质谱成像定量分析依然没有统一、稳定的方案。另外, 目前质谱成像法还较少探索各种分子在中枢神经系统内的作用机制。通过结合多组学分析及分子生物学技术, 质谱成像将有望为脑神经化学的分子机制研究提供更大助力。
References
1?Fox M D, Raichle M E. Nat. Rev. Neurosci., 2007, 8(9): 700-711
2?Price C J. Neuroimage, 2012, ?62(2): 816-847
3?Ganesana M, Lee S T, Wang Y, Venton B J. Anal. Chem., 2017, ?89(1): 314-341
4?Buchberger A R, DeLaney K, Johnson J, Li L J. Anal. Chem., 2018, ?90(1): 240-265
5?Norris J L, Caprioli R M. Chem. Rev., 2013, ?113(4): 2309-2342
6?Potocnik N O, Porta T, Becker M, Heeren R M. A, Ellis S R. Rapid Commun. Mass Spectrom., 2015, ?29(23): 2195-2203
7?Takats Z, Wiseman J M, Cooks R G. J. Mass Spectrom., 2005, ?40(10): 1261-1275
8?Soltwisch J, Kettling H, Vens?Cappell S, Wiegelmann M, Muthing J, Dreisewerd K. Science, 2015, ?348(6231): 211-215
9?Spraggins J M, Caprioli R. J. Am. Soc. Mass Spectrom., 2011, ?22(6): 1022-1031
10?Kompauer M, Heiles S, Spengler B. Nat. Methods, 2017, ?14(1): 90-96
11?He J M, Sun C L, Li T G, Luo Z G, Huang L J, Song X W, Li X, Abliz Z. Adv. Sci., 2019, ?5(11): 1800250
12?Thomas A, Charbonneau J L, Fournaise E, Chaurand P. Anal. Chem., 2012, ?84(4): 2048-2054
13?Scott A J, Flinders B, Cappell J, Liang T, Pelc R S, Tran B, Kilgour D P A, Heeren R M A, Goodlett D R, Ernst R K. Pathog. Dis., 2016, ?74(8): ftw097
14?Wang X D, Han J, Yang J C, Pan J X, Borchers C H. Chem. Sci., 2015, ?6(1): 729-738
15?Dekker T J A, Jones E A, Corver W E, van Zeijl R J M, Deelder A M, Tollenaar R A E M, Mesker W E, Morreau H, McDonnell L A. Anal. Bioanal. Chem., 2015, ?407(8): 2167-2176
16?Liu H H, Chen R, Wang J Y, Chen S M, Xiong C Q, Wang J N, Hou J, He Q, Zhang N, Nie Z X, Mao L Q. Anal. Chem., 2014, ?86(20): 10114-10121
17?Wang J N, Qiu S L, Chen S M, Xiong C Q, Liu H H, Wang J Y, Zhang N, Hou J, He Q, Nie Z X. Anal. Chem., 2015, ?87(1): 422-430
18?Fernandez R, Garate J, Martin?Saiz L, Galetich I, Fernandez J A. Anal. Chem., 2019, ?91(1): 803-807
19?Chen Y F, Allegood J, Liu Y, Wang E, Cachon?Gonzalez B, Cox T M, Merrill A H, Sullards M C. Anal. Chem., 2008, ?80(8): 2780-2788
20?Li S L, Zhang Y Y, Liu J A, Han J J, Guan M, Yang H, Lin Y, Xiong S X, Zhao Z W. Sci. Rep., 2016, ?6: 37903
21?Huang X, Zhan L P, Sun J, Xue J J, Liu H H, Xiong C Q, Nie Z X. Anal. Chem., 2018, ?90 (14): 8309-8313
22?Dauer W, Przedborski S. Neuron, 2003, ?39(6): 889-909
23?Shariatgorji M, Nilsson A, Goodwin R J A, Kallback P, Schintu N, Zhang X Q, Crossman A R, Bezard E, Svenningsson P, Andren P E. Neuron, 2014, ?84(4): 697-707
38?Deli M A, Abraham C S, Kataoka Y, Niwa M. Cell Mol. Neurobiol., 2005, ?25(1): 59-127
39?Liu X H, Ide J L, Norton I, Marchionni M A, Ebling M C, Wang L Y, Davis E, Sauvageot C M, Kesari S, Kellersberger K A, Easterling M L, Santagata S, Stuart D D, Alberta J, Agar J N, Stiles C D, Agar N Y R. Sci. Rep., 2013, ?3: 2859
40?Pokorny J L, Calligaris D, Gupta S K, Iyekegbe D O, Mueller D, Bakken K K, Carlson B L, Schroeder M A, Evans D L, Lou Z, Decker P A, Eckel?Passow J E, Pucci V, Ma B, Shumway S D, Elmquist W F, Agar N Y R, Sarkaria J N. Clin. Cancer Res., 2015, ?21(8): 1916-1924
Progress of Mass Spectrometry Imaging in Neuroscience
HUANG Xi1,2, LIU Hui?Hui1,2, MAO Lan?Qun1,2, XIONG Cai?Qiao1,2, NIE Zong?Xiu*1,2
1(Beijing National Laboratory for Molecular Sciences, Key Laboratory of Analytical Chemistry for Living Biosystems,
Institute of Chemistry, Chinese Academy of Sciences, Beijing 100190, China)
2(University of Chinese Academy of Sciences, Beijing 100049, China)
Abstract?Brain is the central organ of the human nervous system with complex functionality and complicated structure. The chemicals in brain play important roles in metabolism and signal transduction. It is a challenge for scientists to characterize and analyze these chemicals due to their diversity in chemical property and concentration. Mass spectrometry imaging as a new technique is able to screen the spatial distribution of various molecules simultaneously without labeling and has been broadly applied in the study of neurodegenerative disease, brain tumor and pharmacokinetic in brain. This review introduces the principle and new technique of mass spectrometry imaging, ?and focuses on its typical applications in neuroscience published in recent years.
Keywords?Mass spectrometry imaging; Neuroscience; Matrix?assisted laser desorption ionization; Desorption electrospray ionization; Review
- 畜牧业健康养殖与可持续发展
- 观赏鱼养殖主要技术措施
- 动物产地检疫对疫病防控的意义
- 稻田养鱼技术推广的现存问题及对策
- 加强动物调运管理 预防输入性疫病发生
- 探讨保育猪的饲养技术与疾病防治对策
- 关于加强生物安全措施是养猪场防控非洲猪瘟的关键
- 绿色畜牧养殖技术推广
- 沁水县生猪产业发展的思考与建议
- 商品猪屠宰检疫常见疫病症状及处理
- 中小养殖场户非洲猪瘟防控及生猪复养技术探究
- 霍山县草地畜牧业的发展现状及对策
- 中小养猪场对非洲猪瘟的防控措施初探
- 饲料工业标准化的发展建议
- 探究肉羊养殖技术与疾病防治技术
- 如何做好产地检疫确保畜产品质量安全
- 当前动物防疫工作的几点思考
- 猪肺炎性疾病的症状、诊断与防控
- 浅析种猪饲养管理的技术要点
- 羊布鲁氏菌病不同血清学检测方法的比较
- 浅谈加强蚕桑技术推广工作的对策
- 畜牧养殖动物疾病病因及防控措施 *
- 肉鸭养殖技术及疫病防控研究
- 绿色畜牧养殖技术的推广应用
- 生态猪的健康养殖与疾病预防技术
- bobbin
- bobbing
- bobbing up
- bobbing-up
- bobbins
- bobby
- bobby pin
- bobby pins
- bobbys
- bobo
- bobos
- bobsled
- bobsleigh
- bobsleighed
- bobsleighing
- bobsleighs
- bobs up
- bob up
- bob-up
- bob²
- bob¹
- bode
- boded
- boder
- bodes
- 蒋子文
- 蒋常留妪
- 蒋干上东吴
- 蒋干保曹操——各为其主
- 蒋干劝周瑜
- 蒋干盗书——上了大当
- 蒋干过江——上不完的当
- 蒋干过江——尽干失着的事
- 蒋干过江——成事不足,败事有余
- 蒋廷黻
- 蒋径
- 蒋梦麟
- 蒋玉菡
- 蒋生
- 蒋生径
- 蒋经国
- 蒋翊武
- 蒋草
- 蒋诩三径
- 蒋诩径
- 蒋防
- 蒋防集
- 蒌
- 蒌叶
- 蒌蒿