骆明飞+罗俊标+张建东+陈刚
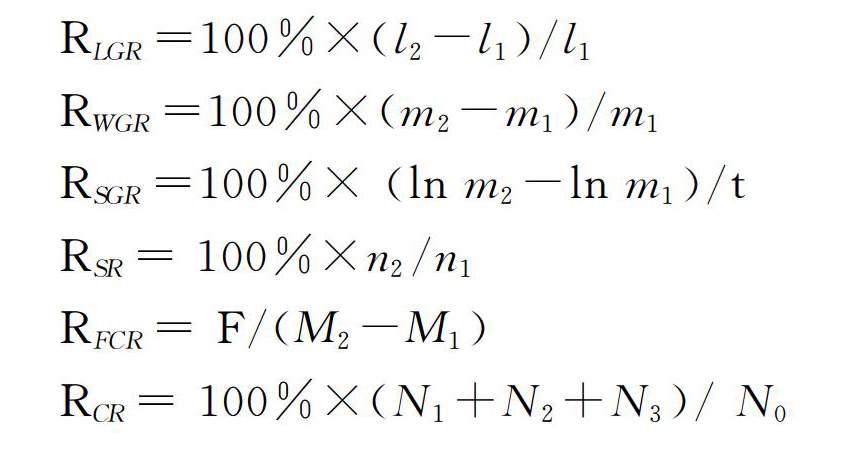
摘 要:本试验由云斑尖塘鳢、线纹尖塘鳢的自交、杂交及其回交试验组合及其子一代在同一环境条件下进行持续360 d养殖试验,通过测量各组试验鱼的形态性状和生产性能,并进行比较分析。试验结果表明,无论正反杂交还是回交,其子代在形态性状和生产性能方面均出现较大变化,通过杂交子一代与云斑尖塘鳢亲本进行回交所得到的回交杂种在体色上得到改良,成活率、生长速率、起捕率、饵料转化率等各项生产性能也得到较好的巩固。
关键词:尖塘鳢;杂交;回交;形态性状;生产性能
尖塘鳢属鱼类(Oxyeleotris),俗名笋壳鱼(Marble Goby),其肉质细嫩、味道鲜美且刺少,是名贵的食用鱼,深受我国和日本、东南亚及港澳台地区消费者喜爱。我国没有尖塘鳢属鱼类的记载,从东南亚引进的尖塘鳢有云斑尖塘鳢(O.marmoratus)和线纹尖塘鳢(Oxyeleotris line-olatus)。两者在形态性状、生产性能、养殖效率等方面存在较大差异。云斑尖塘鳢体色常为黄褐色,体侧具云状斑块,市场上售价较高,但生长速度较慢,养殖效率较低;线纹尖塘鳢体色为灰褐色,体侧具不明显纵向线纹,耐粗饲,生长速度较快,养殖效率高,但市场上售价一般仅是云斑尖塘鳢的50%~60%。与此同时,尖塘鳢属鱼类种质资源多样,亚种繁多,我国所引进的繁育亲本自身纯合度无法保证,且亲缘关系杂乱。目前有关尖塘鳢方面的研究多集中在尖塘鳢鱼类形态生物学、核型、DNA序列、人工繁育和养殖技术等[1-6]方面。而有关尖塘鳢杂交选育方面的报道较少[7-9],特别是有关尖塘鳢杂交、回交子一代形态性状和生产性能方面的比较研究报道更少。本研究通过对云斑尖塘鳢、线纹尖塘鳢自繁及其不同杂交、回交组合的子一代在同一养殖条件下形态性状和生产性能的比较研究,以期为开展尖塘鳢杂交选育相关研究,建立优良的本土化尖塘鳢品系提供理论基础,为尖塘鳢人工杂交繁殖生产提供生产依据和实践经验,为改良尖塘鳢的养殖性能寻求一种有效途径。
1 材料与方法
1.1 试验条件
1.1.1 人工育苗设施的准备 每组配对亲鱼分别放入不同室内水泥繁殖池(2.0 m×3.5 m×10 m),每池投入人工鱼巢10个;另外准备6个水泥池(2.0 m×3.5 m×1.0 m)作为稚幼鱼培育池,并配好培育用水。各池均设有增氧、微流水装置,同时在室外土池培育浮游生物作为稚幼鱼开口和培育的饵料。
1.1.2 养殖试验设施的准备 每组幼鱼饲养在同一池塘(面积1/3 hm2)的不同网箱(2.0 m×40 m×2.0 m,水体12 m3 ),网目40,网箱底部离池底大约10 cm,网箱高出水面50 cm,网箱分布在池塘两列,每列9个网箱,两列之间通道约2 m以方便划船投喂,池塘四周通道保持3~5 m,且在池塘東北、西南角各安装一台水车式增氧机使水体按顺时针流动,同时试验采用鼓风机连续充气系统,每网箱安装4个气石;池塘内放养清洁水质鱼类如金钱鱼1 000尾、鲫鱼500尾、鳙鱼250尾,每15~30 d擦洗网箱一次,并视水质情况适当换水;试验到了11月初搭建简易温棚过冬,次年4月底拆除越冬棚。试验过程最低水温205 ℃,最高水温33.5 ℃,pH 值7.9~8.7,溶解氧保持在5 mg/L以上。
1.1.3 起捕试验设施的准备 养殖试验结束时,租用珠海市容壹水产研究所恒丰虾苗标粗场6口露天水泥池(18.0 m×10.0 m×1.5 m)作为起捕试验池,要求池底较平整,并铺上5~10 cm沙泥底。
1.2 试验材料
本试验用云斑尖塘鳢、线纹尖塘鳢和正交(云斑尖塘鳢♀×线纹尖塘鳢♂)子1代、反交(线纹尖塘鳢♀×云斑尖塘鳢♂)子1代亲本均选自珠海市容壹水产研究所,并进行生物学测量记录,其中体长、全长等用直尺测量,精确到0.01 cm,体质量用DJ1000电子天平称量,精确到0.01 g。各亲本体重在511.2~565.7 g之间。云斑尖塘鳢亲本为选育F4代,雌鱼体重为511.6~549.3 g,平均(523.8±4.5)g,雄鱼511.2~560.3 g,平均(532.5±7.4) g;线纹尖塘鳢亲本为选育F3代,雌鱼体重为508.4~545.3 g,平均(521.7±65) g,雄鱼521.4~565.7 g,平均(547.8±6.7) g;正交(云斑尖塘鳢♀×线纹尖塘鳢♂)子1代亲本雄鱼体重为518.3~553.6 g,平均(529.9±72) g;反交(线纹尖塘鳢♀×云斑尖塘鳢♂)子1代亲本雌鱼体重为510.8~544.3 g,平均(530.1±8.1) g。
1.3 试验方法
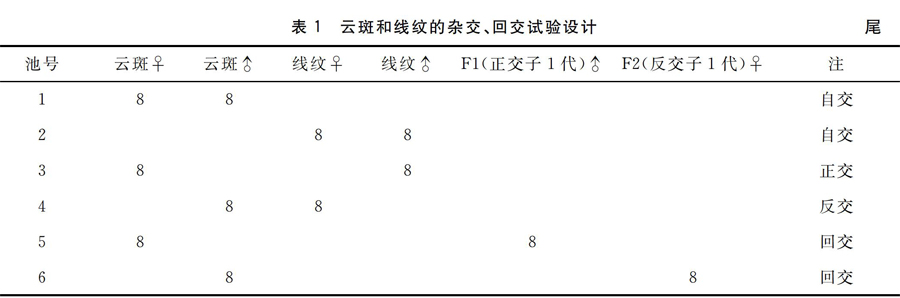
1.3.1 亲鱼配组和苗种培育 试验在珠海市容壹水产研究所种苗场进行。于2012年4月19日开始,此时室内温度已稳定在25 ℃以上。挑选形态特征明显、成熟度好的健康亲鱼(各组雌雄比为1∶1),经人工催产(采用一针注射法HCG用量850 IU/kg,雄鱼减半)后放入不同繁殖池内,不同杂交组合及亲鱼数量见表1。4月24日在各繁殖池内捞取24~48 h的仔鱼3万~4万尾分别转入稚幼鱼培育池,次日开始投喂小轮虫,逐步投喂较大轮虫、枝角类和桡足类,15 d后稚鱼长成规格1.2~1.5 cm的稚鱼,逐步转入投喂水蚯蚓,再经20 d发育成早期幼鱼,全长2.5~3.0 cm。7月1日排水收获各池幼苗,为转入网箱养殖试验作准备。
1.3.2 养殖对比试验
由自交组M(云斑尖塘鳢♀×云斑尖塘鳢♂)、L(线纹尖塘鳢♀×线纹尖塘鳢♂)和杂交组F1(云斑尖塘鳢♀×线纹尖塘鳢♂)、F2(线纹尖塘鳢♀×云斑尖塘鳢♂)以及回交组H1(云斑尖塘鳢♀×F1♂)、H2(F2♀×云斑尖塘鳢♂)6个试验组组成,每组设3个重复,共用18个网箱。每组都随机挑选健康、活力好的早期幼鱼1 500尾,要求全长和体质量相近。初始全长和体质量分别为(2.60±0.12)cm和(0.22±0.02)g。每组1 500尾试验鱼平均分配到3个网箱(各500尾)中饲养。试验前期60 d,投喂饵料以水蚯蚓为主,冰鲜鱼糜为辅,投饵量以幼鱼湿体质量的8%为基准,每天18:00左右投喂,在次日上午8:00左右收集网箱内的残饵。试验60 d后,投喂以冰鲜鱼糜为主,并适量添加维生素、鳗鱼料等作为营养增强剂,每天2次,分别在6:00和18:00,投饵量以试验鱼湿体质量的5%为基准,控制在1 h内摄食完。试验期间发现死鱼及时清理,不作为试验结束时的数据参考。养殖持续360 d(2011年7月2日至2012年6月25日),每60 d随机抽取试验鱼各30尾,饥饿24 h后分别称量每尾试验鱼的全长、体长、体高和体质量,试验结束时统计每组试验鱼的存活数。
1.3.3 形态性状和肠长比比较试验 在养殖试验结束时,对所有试验鱼进行观察体色、花纹特征并统计记录。区分体色参照李家乐等[10]的方法,同时,为了凸现杂交后的体色变异,对此种方法略作修改,即仅按试验鱼的体表颜色、体侧花纹与鳍跨将试验鱼划分为三个群体:“花斑”(体色黄褐色,腹部淡黄,体侧具明显的纵向云状褐色斑块,头背部具近箭头状褐色斑块,近似云斑尖塘鳢体色)、“杂色”(体色呈浅黄褐色、斑块不明显或呈黑褐色,体色介于云斑尖塘鳢与线纹尖塘鳢之间)、“灰色”(体色呈灰褐色或浅灰色,近似线纹尖塘鳢体色)。同时随机抽取每个重复试验鱼10尾共180尾,饥饿24 h后分别测量每尾试验鱼的体长、体高以及观察记录可数的形态性状背鳍、腹鳍、臀鳍、胸鳍、尾鳍等;随机抽取每个重复试验鱼5尾共90尾,饥饿24 h后分别测量其体长和体高,并解剖观察内部结构,测量肠长。
1.3.4 起捕试验 起捕试验在珠海市容壹水产研究所恒丰虾苗标粗场进行。养殖试验结束后,于2012年6月28日从各试验组抽取150尾试验鱼(即每个重复抽取50尾),分别放入6口露天池中,各池水深保持在1.0 m。次日,2人分别在池的两边用鱼网(15.0 m×3.8 m)进行刮网起捕,每池连续刮网起捕3次,记录每次起捕渔获数量,统计并计算起捕率。
1.4 数据处理
1.4.1 生长和生产性能指标的测定 在试验结束后饥饿24 h,对试验鱼进行称量,计算全长增长率(length growth rate, LGR)、增重率(weight growth rate, WGR)、特定生長率(special growth rate, SGR)、成活率(survival rate,SR)、饵料转化率(feed conversion ratio ,FCR)、起捕率(catching rate,CR)的计算公式如下:
式中:l1和l2分别表示试验鱼起始和终末平均全长(cm);m1和m2分别表示幼鱼起始和终末平均体质量(g);n1和n2分别表示幼鱼起始和终末数量(w);F、M1 和M2分别表示为总投饵量(g)、幼鱼起始和终末均重(g);t表示试验持续时间(d);N0 表示起捕前试验鱼在池中总数,N1 、N2和N3分别表示起捕第1、2、3网试验鱼的数量。
1.4.2 体色分类以及主要的形态指标、消化道指数的测定 试验结束时按试验鱼的体色、体侧花斑与鳍跨等将试验鱼划分为“花斑”、“灰色”、“杂色”三类,并计算其比例。
试验结束后饥饿24 h,每组重复随机抽取5尾试验鱼测量体长体高比和肠长比,相应计算公式如下:
体长体高比=体长(cm)/体高(cm)
肠长比=肠长(cm)/体长(cm)
其中体长为自吻端至尾鳍基部的垂直距离;体高为鱼体最高处的垂直距离;肠长为自胃末端到肛门的垂直距离。
1.4.3 统计分析 本试验数据均以平均值±标准误差(X±σX)表示,试验数据用Microsoft Excel作初步处理,然后用SPSS13.0进行处理,在ANOVA单因子方差分析的基础上采用Duncans多重比较检验组间差异,以P<0.05作为差异显著水平。
2 结果与分析
2.1 尖塘鳢杂交、回交子代体色差异的比较
云斑尖塘鳢与线纹尖塘鳢自繁个体与亲本体色没有明显差异。云斑尖塘鳢试验鱼个体体色为黄褐色,腹部淡黄色,体侧具5~6个纵向深褐色斑块,斑块之间或边缘常呈金黄色,头背部具1个(近)箭头状褐色斑块,鳍上常有纵向的深褐色条纹或小的深褐色斑点,背鳍有褐色骑跨;线纹尖塘鳢试验鱼个体体色为微蓝,腹部浅灰色;背部隐有8~9条横向不明显的斑状条带;体两侧各具10~11条纵条纹。背鳍、胸鳍和尾鳍灰色,腹鳍、臀鳍浅灰色,边缘稍带黄色。
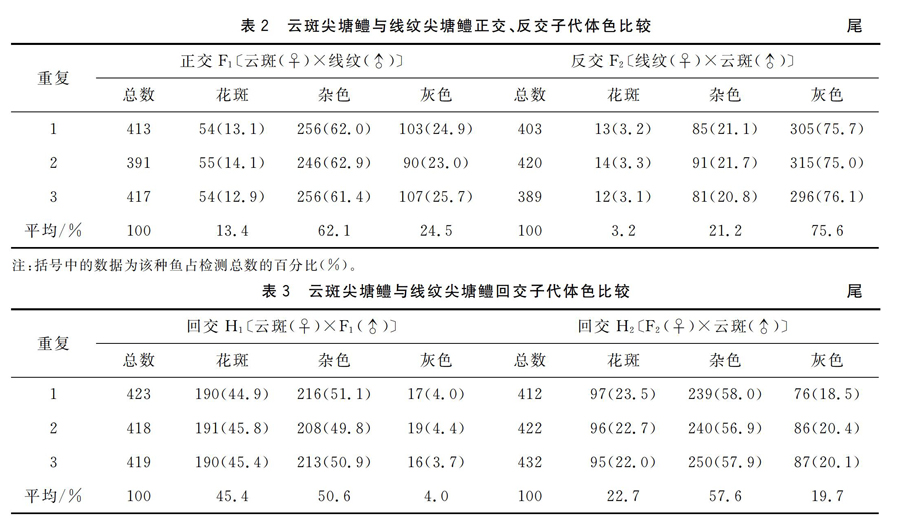
而云斑尖塘鳢与线纹尖塘鳢杂交、回交子代的体色出现较明显的分离,出现“花斑”、“杂色”、“灰色”三大类,但不符合孟德尔的分离规律。其中“花斑”个体黄褐色,颜色较鲜艳,体侧褐色斑块明显,与云斑尖塘鳢体色很相近,“灰色”个体体色通常为灰色或浅灰色,无云状斑块,与线纹尖塘鳢体色较相近,而“杂色”个体体色常呈青色,伴有褐色或灰色,斑块不明显或呈黑褐色,介于“花斑”和“灰色”个体之间。从表2和表3可以看出,云斑尖塘鳢与线纹尖塘鳢正交后代F1以杂色(62.1% )为主,其次为灰色(24.5%)和花斑(13.4%);反交后代F2以灰色 (75.6% )为主,其次为杂色(21.2%),花斑仅为3.2%;回交后代H1以杂色(50.6% )和花斑(45.4%)为主,灰色仅为4.0%;回交后代H2以杂色(57.6% )为主,其次为花斑(22.7%)和灰色(19.7%)。回交后代子1代H1的花斑个体明显多于回交后代子1代H2的花斑个体,也多于正交后代子1代F1花斑个体,更多于正交后代子1代F2花斑个体。从图1更直观看到不同组合尖塘鳢杂交、回交子1代个体体色差异。
2.2 尖塘鳢及其正反杂交、回交子1代其它主要形态性状比较
云斑尖塘鳢自交M组试验鱼体长体高比在4.31~4.87之间,肠长比为0.39±0.05,背鳍Ⅵ,Ⅰ-10-11;腹鳍Ⅰ-5-6;臀鳍Ⅰ-9-10;胸鳍P16-18;尾鳍C18-22。
线纹尖塘鳢自交L组试验鱼个体体长体高比在4.46~4.98之间,肠长比为0.63±0.11,背鳍Ⅵ,Ⅰ-9-10;腹鳍Ⅰ5;臀鳍Ⅰ-8-10;胸鳍P16-17;尾鳍C20-24。
正交F1组个体体长体高比在4.18~4.70之间,肠长比为0.57±0.03,背鳍Ⅵ,Ⅰ-10-11;腹鳍Ⅰ-5;臀鳍Ⅰ-9-10;胸鳍16-18,软条数通常左右不对等;尾鳍C18-24。
反交F2组个体体长体高比在4.74~5.49之间,肠长比为0.79±0.02,背鳍Ⅵ-Ⅶ,Ⅰ-9-10;腹鳍Ⅰ-5;臀鳍Ⅰ-9-10;胸鳍16-19,软条数通常左右不对等;尾鳍C19-24。
回交H1组个体体长体高比在4.30~4.77之间,肠长比为0.64±0.06,背鳍Ⅵ,Ⅰ-10-11;腹鳍Ⅰ-5;臀鳍Ⅰ-9-10;胸鳍17-18,软条数通常左右不对等;尾鳍C18-24。
回交H2组子1代个体体长体高比在4.68~5.02之间,肠长比为0.68±0.05,背鳍Ⅵ-Ⅶ,Ⅰ-9-10;腹鳍Ⅰ-5;臀鳍Ⅰ-Ⅱ-9-10;胸鳍软条数通常左右不对等,左胸鳍14-18,右胸鳍16-18;尾鳍C20-24。
从表4和图2可以看出,6个不同组合个体体长体高比差异不明显。在肠长比方面,云斑尖塘鳢为(0.39±0.02)和线纹尖塘鳢为(0.63±002),两者差异显著,杂交个体肠长比均显著大于云斑体肠长比;正交F1个体肠长比明显小于线纹尖塘鳢,反交F2组个体肠长比明显大于线纹尖塘鳢,而回交个体与线纹尖塘鳢体肠长比差异不显著。在各鳍方面,杂交回交子代个体的腹鳍、臀鳍较稳定,无明显变化,但胸鳍变化最大,且常常出现左右胸鳍数目不对等情况,同时第一背鳍棘数也出现较大变化,在反交F2组个体或回交H2组个体通常出现6根棘条。
2.3 尖塘鳢及其正反杂交、回交子1代的生长和生产性能比较
各组幼鱼的体质量和全长在试验开始时基本一致,但在试验结束时,各组的全长和体质量均出现显著差异(P<0.05)。如表 2-表5 所示,云斑尖塘鳢的全长为(29.12±0.11)cm,线纹尖塘鳢的全长为(30.76±0.28)mm,两者不同杂交组合子1代全长最短为(32.02±0.07)cm,最长为(33.11±0.10)cm,证明杂交尖塘鳢在全长上较云斑尖塘鳢有优势,而与线纹尖塘鳢相比优势不明显。
云斑尖塘鳢体质量为(325.53±1.16)g,线纹尖塘鳢的体质量为(361.10±1.12)g,正交F1组的体质量为(465.21±1.62)g,相对云斑尖塘鳢和线纹尖塘鳢分别提高了42.9%和 28.8%,且差异显著;反交F2组的体质量为(494.13±1.51)g,相对云斑尖塘鳢和线纹尖塘鳢分别提高了518%和 36.8%,并且差异显著;回交H1组的体质量为(445.53±1.10)g,相对云斑尖塘鳢和线纹尖塘鳢分别提高了36.9%和 28.8%,且差异显著;回交H2组的体质量为(459.52±1.12)g,相对云斑尖塘鳢和线纹尖塘鳢分别提高了41.2%和27.3%,且差异显著;证明杂交和回交尖塘鳢在体重上较双亲都有优势。
6组幼鱼的全长增长率(LGR)、增重率(WGR)、特定生长率(SGR)、饵料转化率(FCR)也表现出显著差异(P<0.05)。
从表5可见,F1、F2、H1、H2四组的LGR显著高于M组和L组(P<0.05)M组的LGR最小;F1、F2、H1、H2四组中,H2组的LGR较小,其余三组的SGR差异性不大(P>0.05)。
从表6可见,F1、F2、H1、H2四组的WGR显著高于M组和L组(P<0.05),M组的WGR最小;F1、F2、H1、H2四组中,F2组的WGR最大,其次为H2和F1组,H1最小;F1、F2、H1、H2四组的SGR差异性不大(P>0.05),但均显著高于M组和L组(P<0.05);F1、F2、H1、H2四组的FCR差异性不大(P>0.05),但均显著小于M组和L组(P<0.05),M组的 FCR高于L组,差异性大(P<0.05)。
6组养殖成活率(SR),从表5可以看出,F1、F2组的SR明显低于其它四组,显著差异(P<005),L组最高达86.6%,M、H1以及H2组的SR差异性不大(P>0.05)。
6组起捕率(CR),从表7可以看出,M组CR最低仅32.7%,L组CR最高达74.7%,F1、F2、H1、H2四组的CR差异性不大,介于M、L两组之间。
3 讨论
3.1 不同雜交组合尖塘鳢体色的变异和体色遗传的初步探讨
体色是鱼类一种较为独特的表型性状。鱼类体色变异是遗传学、进化生物学和系统发育学的重要研究主题[11]。不同种类的鱼有着不同的体型和体色,体色是受遗传基因控制的,这是对自然界长期适应的结果。目前,人们可以利用生物技术和杂交选育来从基因水平上改变鱼类的体色,得到具有优良遗传形状的品种,如锦鲤、荷包红鲤、金鱼等都是长期定向选育的观赏鱼品种,血鹦鹉是红魔鬼父本和紫红火口母本杂交所得的F1子代[12]。
本试验中,云斑尖塘鳢与线纹尖塘鳢自繁子代个体与亲本体色没有明显差异,而云斑尖塘鳢和线纹尖塘鳢不同杂交、回交组合的子1代的体色出现较明显的分离,为了区分它们和研究方便,本研究者将其划分为“花斑、杂色、灰色”三类,其中“花斑”个体黄褐色,颜色较鲜艳,体侧褐色斑块明显,与云斑尖塘鳢体色很相近,“灰色”个体体色通常为灰色或浅灰色,无云状斑块,与线纹尖塘鳢体色较相近,而“杂色”个体体色常呈青色,伴有褐色或灰色,斑块不明显或呈黑褐色,介于花斑和灰色个体之间。在试验结果看,云斑尖塘鳢母本与线纹尖塘鳢父本进行正交的子1代F1个体体色为花斑(13.4%)、杂色(62.1% )、灰色(24.5%);云斑尖塘鳢父本与线纹尖塘鳢母本进行反交的子1代F2个体体色为花斑(3.2%)、杂色(21.2%)、灰色 (75.6% );正交子1代F1父本与云斑尖塘鳢母本进行回交的子1代H1个体体色为花斑(45.4%)、杂色(50.6% )、灰色(4.0%);反交子1代F2母本与云斑尖塘鳢父本进行回交的子1代H2个体体色为花斑(22.7%)、杂色(57.6% )、灰色(19.7%)。由于本试验是在同一养殖水体、投喂同质量的饵料条件下进行的,即可以忽略外部环境和营养物质对体色的影响,因此本试验得到的个体体色变异结果主要受是亲本遗传的结果,而且从不同杂交组合子1代个体体色分离变化情况来看,无论正交、反交还是回交,其子1代 “杂色”个体比例均在50%以上;同时“花斑”个体数正交子1代F1显著多于反交子1代F2,“灰色”个体数反交子1代F2极显著多于正交子1代F1,回交的子1代H1“花斑”个体显著多于回交子1代H2的“花斑”个体,也显著多于正交后代子1代F1“花斑”个体,极显著多于正交后代子1代F2“花斑”个体,从而表明云斑尖塘鳢与线纹尖塘鳢杂交、回交的子1代个体体色由父本和母本的遗传基因共同控制的,但并非对等的,可能更多来自母本。
而范小勇等[9]人应用RAPD技术研究云斑尖塘鳢、线纹尖塘鳢及其杂交子一 代(F1)间的遗传关系,结果表明正反交子代在遗传关系上均偏向各自的母本,所获得的遗传信息可能更多来自母本;朱晓平等[8]人用20对微卫星引物对线纹尖塘鳢(♀)、云斑尖塘鳢(♂)及其杂交、回交子代的遗传变异进行分析研究,试验结果表明无论是杂交还是回交均表现了一定的母本效应,但他们仅是分别对正交、反交子1代2个群体(范小勇等)以及对反交子1代、反交子1代(♀)与云斑尖塘鳢(♂)的回交子1代2个群体(朱晓平等)与亲本群体展开的遗传方面研究,而本研究是对不同杂交、回交组合子1代4个群体与亲本在同一养殖水体、投喂相同质量饵料的条件下进行的同一年龄段的个体体色比较研究,具有更广泛的实践意义。
然而,在试验过程中发现尖塘鳢不仅会随着水色的改变出现体色深浅的变化,而且在生长过程中存在变色现象,无论杂交还是回交,鱼苗早期表现为黄褐色,且颜色较鲜艳,斑块明显,长至3~5 cm后,才开始出现明显的体色分离,部分个体由黄褐色逐渐转变成灰色,褐色斑块消失或变成黑褐色;与此同时,尖塘鳢无论杂交还是回交的子一代“花斑”和“灰色”群体中,很难发现与亲本体色完全一致的个体,而且“杂色”个体体色更是复杂,没有规律。由此可见,尖塘鳢的体色遗传规律相当复杂,也不符合孟德尔的分离规律,可能是多基因决定的结果,同时还可能受亲本本身纯合度不够的影响,还需要深入研究。
3.2 不同杂交组合尖塘鳢主要形态性状和肠长比的差异
云斑尖塘鳢与线纹尖塘鳢两种之间有形态相似,也存在差别。从报道的文献来看,研究者对2尖塘鳢鱼类的形态性状和肠长比等方面观察研究存在一定的差别,主要集中在臀鳍、胸鳍、尾鳍数目以及体长体高比、肠长比方面[1-3,5]。本研究中观察到云斑尖塘鳢自交M组试验鱼体长体高比在4.31~4.87之间,肠长比为0.39±0.05,背鳍Ⅵ,Ⅰ-10-11;腹鳍Ⅰ-5-6;臀鳍Ⅰ-9-10;胸鳍16-18;尾鳍18-22;线纹尖塘鳢自交L组试验鱼个体体长体高比在4.46~4.98之间,肠长比为0.63±0.11,背鳍Ⅵ,Ⅰ-9-10;腹鳍Ⅰ5;臀鳍Ⅰ-8-10;胸鳍16-17;尾鳍20-24。
而本试验观测到云斑尖塘鳢与线纹尖塘鳢及其不同杂交组合的子1代的体长体高比差异不明显,在各鳍和肠长比方面出现较大差异。
3.2.1 不同杂交组合尖塘鳢子1代个体各鳍的变化和鳍式 本试验中,观测到杂交回交子1代个体的腹鳍、臀鳍较稳定,仅是回交H2组子1代个体臀鳍棘数出现1~2根的变化,其它各组均无明显变化;但胸鳍变化最大,无论正反杂交还是回交,其子1代个体常常出现左右胸鳍数目不对等情况,第一背鳍棘数也出现较大变化,在反交F2组个体或回交H2组个体通常出现6根棘条,而云斑尖塘鳢与线纹尖塘鳢第一背鳍仅有5根棘条。同时,从试验实际观测结果,分别得出4 个杂交、回交子1代群体的鳍式。正交F1组个体:DⅥ.Ⅰ-10-11,VⅠ-5,AⅠ-9-10,PLR16-18,C18-24;反交F2组个体:DⅥ-Ⅶ.Ⅰ-9-10,VⅠ-5,AⅠ-9-10,PLR16-19,C19-24;回交H1组个体:DⅥ.Ⅰ-10-11,VⅠ-5,AⅠ-9-10,PLR17-18,C18-24;回交H2组个体:DⅥ-Ⅶ.Ⅰ-9-10,VⅠ-5,AⅠ-Ⅱ-9-10,PL14-18.PR16-18,C20-24。
鳍是鱼类的主要运动器官和平衡身体器官。杂交可以增加物种变异性、异质性、综合双亲的优良性状,出现可利用的杂种优势,也可出现某些双亲所没有的新性状[13]。本研究者研究观测尖塘鳢鱼类多年,均无发现云斑尖塘鳢与线纹尖塘鱧出现第一背鳍棘数为6条或左右胸鳍数目不对等的现象,国内外也暂未见相关文献报道,故可以认为该现象是云斑尖塘鳢与线纹尖塘鳢杂交后出现变异的结果。因此,可以将出现胸鳍数目不对等或第一背鳍棘数为6根的现象作为区别杂交后代与云斑尖塘鳢、线纹尖塘鳢主要判断依据之一。
3.2.2 不同杂交组合尖塘鳢子1代个体肠长比的变化 尖塘鳢属鱼类为典型的肉食性鱼类,颌齿发达,上、下颌齿多行,颌齿细小;犁骨及腭骨均无齿;胃发达,I型,胃壁厚,贲门部、幽门部分界不明显,无幽门盲囊,食道粗短,发达。本试验中,6个不同组合个体在肠长比方面,云斑尖塘鳢为(0.39±0.02)和线纹尖塘鳢为(0.63±0.02),两者差异显著;正反交子1代和回交子1代的个体肠长比均显著大于云斑体肠长比;正交F1个体肠长比(0.57±0.03)小于线纹尖塘鳢,反交F2组个体肠长比(0.79±0.02)明显大于线纹尖塘鳢肠长比,而回交H1组和回交H2组的个体肠长比与线纹尖塘鳢个体肠长比差异不显著。
肠管是鱼类消化系统的重要部分,鱼类所摄取的食物主要在肠管中消化和吸收,而没有胃的鱼类其消化和吸收则完全在肠管中进行,可见,鱼类肠管在它的生命活动中起着重要的作用[14]。而肠长比是鱼类消化道指数重要指标,且与鱼类食性息息相关。王迎春[15]等通过对牙鲆等8种肉食性海产硬骨鱼类消化系统的比较解剖研究,发现这8种鱼类胃肠分化均较明显,肠长与体长比较在0.34~1.23之间。肠的长短实际上从一个侧面反应消化食物的难易[15]。本试验研究表明,与云斑尖塘鳢和线纹尖塘鳢肠长比相比,无论杂交或回交子1 代个体的肠长比均发生了改变,表明其肠道的消化吸收能力也有所变化,从而影响个体生长性能。
3.3 不同杂交组合尖塘鳢生产性能的变化和杂交优势的分析
3.3.1 不同杂交组合尖塘鳢生长性能的影响 本试验中,6组试验鱼(3个重复)在相同的养殖条件下,经过360 d的对比养殖,正交F1、反交F2、回交H1和回交H2等4组的个体在全长上较云斑尖塘鳢有优势,而与线纹尖塘鳢相比优势不明显;4组的体质量相对云斑尖塘鳢分别提高429%、51.8%、36.9%、41.2%,相对线纹尖塘鳢分别提高28.8%、36.8%、28.8%、27.3%,表明杂交和回交尖塘鳢子1代在体质量上较双亲都有优势。
正交 F1、反交F2、回交H1和回交H2等4组试验鱼个体在全长增长率(LGR)、增重率(WGR)、特定生长率(SGR)上与云斑尖塘鳢和线纹尖塘鳢相比,均有显著提高(P<0.05),表明云斑尖塘鳢和线纹尖塘鳢杂交和回交均使后代提高了生长速率,杂种优势显著,也证明了杂交可以提高尖塘鳢鱼类生长性能的可行性。
3.3.2 不同杂交组合尖塘鳢饵料转化率的影响 在本试验过程中,各试验组鱼类在养殖密度、生存生态条件、投饵质量一致、投饵率相同的条件下,正交F1、反交F2、回交H1和回交H2等4组试验鱼饵料转化率(FCR)与云斑尖塘鳢和线纹尖塘鳢相比均显著降低(P<0.05),表明无论杂交还是回交,其子代在摄食水平和饵料利用率上得以提高,这可能与杂交、回交后代的主要消化道指数肠长比发生变异有关。
3.3.3 不同杂交组合尖塘鳢养殖成活率的影响 在本试验过程中,各试验组鱼类生存生态条件一致,养殖密度相同,饵料充足,而且没有出现明显的病害,但出现成活率(SR)不同。我们分析出现这种结果的最主要原因是:云斑尖塘鳢是一种肉食性鱼类有互相残食现象[6]。群体中如果个体差异越大,大吃小的现象就越明显,从而最终影响养殖成活率。从各试验组成活率(SR)来看,正交F1、反交F2组与云斑尖塘鳢和线纹尖塘鳢相比,SR明显偏低,而回交H1和回交H2组的SR明显提高,与云斑尖塘鳢和线纹尖塘鳢差异性不大(P>0.05),表明云斑尖塘鳢和线纹尖塘鳢正交和反交后代群体发育差异性较大,而经过回交后,子代的群体发育差异性缩小,这与本试验实际测到的数据相符。
3.3.4 不同杂交组合尖塘鳢起捕率的影响 云斑尖塘鳢为典型的底栖穴居性鱼类,在自然环境中,常栖息在水质较清或有微流水的江河、湖泊、水库、塘堰近岸底部、草丛、砂石缝隙、洞穴,特别喜欢贴附在悬崖绝壁狭缝间,在人工池养条件下喜欢栖息于池塘的底部沙泥、草丛中或其它可以遮阴的杂物下面,因此起捕率极低,而在养殖生产中收获时常常只能用地笼装或干塘活捉;线纹尖塘鳢底栖穴居在人工池养条件下表现没有云斑尖塘鳢明显,常常生活在水体中下层,起捕率较高(70%以上)。在本试验过程中,云斑尖塘鳢和线纹尖塘鳢杂交和回交后代群体的起捕率(60%以上)与云斑尖塘鳢相比显著提高(P<0.05),表明后代群体生活习性可能受线纹尖塘鳢遗传影响,底栖穴居生活习性有所改变,常常生活在水体中下层,接近线纹尖塘鳢生活习性。
3.4 尖塘鳢杂交育种的意义。
杂交是最经典的育种方法之一。杂交育种是人类有目的地使杂交亲本的遗传基础通过重组、分离和后代选择,培育出有利基因更加集中的新品种的育种方法[16]。至目前为止,鱼类的杂交育种已经取得了相当大的成就。罗非鱼极易在种间甚至属间杂交,而且很多杂交组合后代的雄性率很高[17]。Lahav等[18]用三杂交的方法培育出了耐盐性较好的红罗非鱼。王佳等[19]比较了黄金鲈(Perca flavescens)与伊犁鲈(P.schrenki)杂交后代及自繁F1 代的生长情况,结果表明杂交鲈相对于黄金鲈在生长上有很强的杂种优势,也证明了杂交可以提高黄金鲈生长性能的可行性。这些成功的事例表明,杂交是一种极其有效的育种手段,如果利用得当,会产生显著的经济和社会效益。
在本试验中,在相同的养殖条件下,正交子代与反交子代群体的体质量相对云斑尖塘鳢分别提高42.9%、51.8%,相对线纹尖塘鳢分别提高288%、36.8%,在全长增长率、增重率、特定生长率上与云斑尖塘鳢和线纹尖塘鳢相比,均有显著提高(P<0.05),同时与云斑尖塘鳢和线纹尖塘鳢相比饵料转化率显著降低,而起捕率与云斑尖塘鳢相比有极显著的提高,生产性能有了较大的提高。但正交子代与反交子代群体成活率相对较低以及群体体色较差(正交子代群体中”花斑”个体占13.4%,而反交子代群体中“花斑”个体仅占3.2%),对于目前以体色决定商品价格的尖塘鳢鱼类而言,杂交的结果未能如愿。因此本研究采用了让其分别与体色鲜艳的云斑尖塘鳢母本和父本进行回交的方式,稳定杂种优势的同时以期改善其体色。实践证明,回交H1和回交H2群体中出现与云斑尖塘鳢体色相似的“花斑”个体明显增多(分别为45.4%和22.7%),且“杂色”个体均在50%以上,回交使体色得以较大改善。同时,回交H1和回交H2组群体的成活率得以提高,在生长速度、遗传多样性等方面得到了较好的巩固。综合体色和生产性能这两方面的因素,不难看出,回交 H1组即〔云斑尖塘鳢(♀)×线纹尖塘鳢(♂)〕×云斑尖塘鳢(♀)的子代具有“花斑”个体比例高、生产性能优势突出等较多育种目标性状,可使尖塘鳢鱼类的遗传性状得到一定改良。若继续对其进行选育,其养殖性能有可能进一步提高。
4 结论
本研究结果表明,云斑尖塘鳢与线纹尖塘鳢种间可以进行杂交、回交,且无论正反杂交还是回交,其子代在形态性状和生产性能方面均出现较大变化。通过杂交子一代与云斑尖塘鳢亲本进行回交所得到的回交杂种在体色上得到改良,在成活率、生长速率、起捕率、饵料转化率等各项生产性能也得到较好的巩固。综合体色和生产性能这两方面的因素,不难看出,回交 H1组即〔云斑尖塘鳢(♀)×线纹尖塘鳢(♂)〕×云斑尖塘鳢(♀)的子代具有“花斑”个体比例高、生产性能优势突出等较多育种目标性状,可使尖塘鳢鱼类的遗传性状得到一定改良。若继续对其进行选育,其养殖性能有可能进一步提高。
参考文献:
[1]朱新平,刘毅辉,陈永乐,等.尖塘鳢的形态生物学与细胞核型[J].中国水产科学,2003,10(1):85-86
[2] 张邦杰,梁仁杰,张瑞瑜,等.尖塘鳢(笋壳鱼)的生物学及养殖概况[J].淡水渔业,2004,36(6):58-61
[3] 陳永乐,刘毅辉,陈昆慈,等.线纹尖塘鳢的形态生物学与核型[J].水产学报,2006,30(4):562-565
[4] 梁仁杰,陸昌胜,张邦杰,等.澳洲线纹尖塘鳢的繁殖与培育技术[J].淡水渔业,2004,34(1):53-55
[5] 张邦杰,李春枝,钟良民,等.线纹尖塘鳢的形态特征染色体核型及分类学地位[J].海洋湖沼通报,2008(02):82-88
[6] 陈永乐,刘毅辉,朱新平,等.泰国尖塘鳢的生物学及其养殖[J].淡水渔业,2005,35(1):59-62
[7] 李 敏,李春枝,黄永强,等.云斑尖塘鳢和线纹尖塘鳢自交与杂交子一代幼鱼生长性状及杂交优势分析[D].广州:广东海洋大学,2010(2): 64-67
[8] 朱晓平,骆剑,尹绍武,等.线纹尖塘鳢(♀)、云斑尖塘鳢(♂)及其杂交、回交子代遗传变异的微卫星分析[J].中国农学通报,2012,28(17):147-153
[9] 范小勇,王茜,齐兴柱,等.云斑尖塘鳢、线纹尖塘鳢及其杂交子一代(F1)间的遗传关系[J].海洋渔业,2009,31(2):128-133
[10] 李家乐,李思发. 台湾红罗非鱼子代体色分离及与生长繁殖相关的初步研究[J].水产科技情报, 1997, 24(2):17-21
[11] 王成辉.鱼类体色变异的遗传基础研究进展简述[J].上海海洋大学学报,2012,21(5):737-742
[12] 张晓红,吴锐全,王海英,等.鱼类体色的色素评价及人工调控[J].饲料工业,2008(4):58-61
[13] 吴仲庆.水产生物遗传育种学[M].厦门:厦门大学出版社, 1991:102
[14] 米强.广西常见鱼类比肠长与食性的关系[J].广西水产科技,1983(3): 14-18
[15] 王迎春,周勤,段晓英.8种肉食性海产硬骨鱼类消化系统的比较解剖研究 [J].海洋湖沼通报,1997,7(3):46-51
[16] 尾崎久雄.鱼类消化生理学(上下)[M].上海:科技出版社,1993:28-33
[17] 楼允东.鱼类育种学[M].北京:中国农业出版社,1999
[18] Lahav, E.& Raanna, Z..Saline tolerance of genetically produced tilapia (oreochromis)hybrids.Bamidgeh, 1997, 49(3): 160 -165
[19] 王佳,刘青华,施志仪.黄金鲈与伊犁鲈杂交后代生长性能及杂交鲈性腺发育分析[J].淡水渔业,2009,39(5):7-12
(收稿日期:2016-04-18)
- 366例颈性眩晕经筋辨证分布规律的临床研究
- 昆明与南通地区代谢综合征中医证候比较分析
- 原发性胃癌中医证候病性分布特点研究
- 骨筋肉运动康复操配合中医五音疗法对腰椎间盘突出症患者的疗效观察
- 白芥子敷背治疗小儿肺炎喘嗽病后期痰鸣音吸收不良疗效观察
- 浅析宣清降浊汤治疗反流性食管炎体会
- 中医药治疗绝经综合征的优势探讨
- 云南彝族医药活态传承现状调查
- 黄芪桂枝五物汤化裁内服、熏洗结合功能训练对手外伤患者术后康复的影响
- 身痛逐瘀汤加减治疗单纯骨质疏松型椎体压缩性骨折的临床观察
- 射干麻黄汤联合西药治疗支气管哮喘的临床观察
- 参苓白术颗粒联合匹维溴铵治疗腹泻型肠易激综合征的临床观察
- 真武汤合桂枝茯苓丸治疗水瘀互结型糖尿病肾病的临床研究
- 肥胖并发高脂血症的中医药治疗进展
- 针灸治疗老年性痴呆的研究现状
- 硒制剂及含硒中药治疗Graves眼病的研究进展
- 中医膏方治疗糖尿病临床研究进展
- 三七粉口服的临床应用研究进展
- 红藤虎杖复方免煎剂治疗急性痛风性关节炎的实验研究
- 四制香附调经止痛物质基础研究
- 壮骨止痛方对骨质疏松大鼠血清BGP、TRAP、SOD含量的影响
- 三七总皂苷对大鼠急性重症胰腺炎钙超载中CaMKⅡ-γ表达的影响
- 灯盏花素软袋大输液质量标准研究
- 刘瑞芬教授治疗子宫内膜息肉经验
- 李琦教授治疗过敏性紫癜性肾炎的经验
- mulches
- mulching
- mule
- muled
- mules
- mules'
- muling
- mull
- mullah
- mullahism
- mullahisms
- mullahs
- mullas
- mulling
- mull over
- mull-over
- mulls
- mull sth over
- mull sth ↔ over
- multi
- multi-
- multiage
- multiagency
- multi-angular
- multiarmed
- 析词格
- 析辩诡词
- 析辩诡辞
- 析骨以炊
- 析骨而炊
- 析骸以爨
- 析骸易子
- 析骸而爨
- 析麻捻接成线
- 枑
- 枓
- 枓拱
- 枓栱
- 枕
- 枕上诗书闲处好,门前风景雨来佳
- 枕上黄粱
- 枕中书
- 枕中鸿宝
- 枕书
- 枕侧
- 枕借
- 枕借经史
- 枕借诗书
- 枕冷衾寒
- 枕函书