隋鑫 刘丽 贾美清 宋洋 王嘉宝 刘美琪 张国刚
摘 ? ?要:氣候“变干”和“变暖”是影响内蒙古草原生态系统的2个关键气候限制因子。为了明确气候变化对荒漠草原土壤微生物群落数量及多样性的影响,本研究在荒漠草原开展大面积人工增温及干旱模拟,应用稀释平板法及微生物PCR分子鉴定技术,研究不同土壤深度可培养细菌的数量以及多样性。结果表明:温度增加会使0~30 cm土壤细菌数量减少,且表层数量变化强烈,中深层相对稳定。干旱缺水同样使0~30 cm土壤细菌数量减少,但水分增加后,土壤细菌数量快速上升,表层变化更为明显。气候变干变暖对土壤细菌的群落多样性影响较轻微,无显著差异。不同处理的土壤细菌群落物种多样性指数和均匀度指数均呈现出:增温处理>温度对照处理;减水处理>水对照处理>增水处理的趋势,均匀度指数呈现出增温处理>温度对照处理;减水处理>水分对照处理>增水处理的趋势。这主要是因为高温和缺水的环境中激发了一些土壤细菌的生长,使分布较均匀,这可以作为指示细菌为以后深入研究荒漠草原的微生物变化提供一定的资料。
关键词:人工增温;干旱模拟;土壤细菌;群落多样性
中图分类号:S812.2 ? ? ? ? ?文献标识码:A ? ? ? ? ? DOI 编码:10.3969/j.issn.1006-6500.2019.05.006
Responses of Soil Bacteria Quantity and Diversity to Drought and Warming in ?Stipa breviflora Desert Steppe
SUI Xin1,LIU Li1,JIA Meiqing2,SONG Yang1,WANG Jiabao1,LIU Meiqi1,ZHANG Guogang1
(1.Life Science College, Tianjin Normal University, Tianjin 300387, China;2.Tianjin Key Laboratory of Water Resources and Environment, Tianjin Normal University, Tianjin 300387, China)
Abstract: Drying and warming are two key climatic limiting factors affecting grassland ecosystem in Inner Mongolia. In order to clarify the effects of climate change on the quantity and diversity of soil microbial communities in desert steppe, large-scale artificial warming and drought simulation were carried out in desert steppe. Dilution plate method and PCR molecular identification of microorganisms were used to study the number and diversity of soil bacteria in different soil depths after drying and warming. The results were as follows: the increase of temperature reduced the quantity of bacteria in 0~30 cm soil, and the quantity of surface layer changed strongly, and the deeper layer was relatively stable. Drought also reduced the number of soil bacteria in 0~30 cm soil, but the number of soil bacteria increased rapidly with the increase of water content, especially in the surface layer. Climate warming and drying had little effect on soil bacterial community diversity. The species diversity index and evenness index of bacterial community in different treatments showed the following trends: warming treatment > temperature control treatment; reducing water treatment > water control treatment > increasing water treatment; evenness index showed the trend of warming treatment > temperature control treatment; reducing water treatment > water control treatment > increasing water treatment. The main reason was that high temperature and lack of water environment stimulated the growth of some soil bacteria, so that the distribution was more uniform, which could be used as indicator to provide information in further study of soil bacteria in Stipa breviflora desert steppe.
Key words: ?artificial warming; drought simulation; soil bacteria; community diversity
在全球气候变暖的大背景下,中国草原区近50年气候日趋变暖,以冬季升温幅度最大[1-3];增温和降水变异增大,导致草原牧区干旱化加剧,近90%的草原出现了不同程度的退化[3]。中国的荒漠草原主要分布在北部的干旱和半干旱区,是对气候变化最为敏感的草原类型。从20世纪后40年间气象站记载的气温和降水变化特征分析,处于中国北方中纬度区域的荒漠草原区年平均气温表现出上涨趋势, 是北半球中纬度地区升温的一个非常好的例子。降水则表现为长年波动状态,春季、冬季降水有明显减少的趋势[4]。20世纪50年代以来,气温升高、降雨量减少,造成了严重的水分亏损,正在明显地影响着草原生态系统。气候变化的“变干”和“变暖”是草原生态系统中两个关键限制因素[5]。因此,气候变化对草原生态系统的影响已经成为研究焦点。但当前的研究多为气候变化对草原生产力、植被及群落组成等的影响[6],而对草原区土壤微生物与环境变化的研究相对较少[4,6-8]。
草原是以土-草-畜为主体构成的一个相对独立的生态系统,土壤微生物在草地农业生态系统的恢复中有很重要的作用,也是反应环境变化的敏感指示生物,其数量和种群组成是评价草地土壤环境质量的重要参数之一[9]。土壤中微生物数量繁多,种类丰富,而土壤细菌相对其他微生物来说其数量和种类更多。土壤微生物是土壤有机质的主要分解者,同时许多微生物具有固氮、溶磷、分解钾素等作用,因此,土壤微生物在草地生态系统中营养元素循环、有机物质的形成和分解、土壤肥力的保持和提高方面具有十分重要的作用。由于微生物的微观性,结构简单、繁殖速度快,缺少准确的基线用于种群数量统计等原因,人们对它们的研究远没有像宏观生物那样受到重视,而对于草地土壤微生物的研究就更加滞后,1980年以前关于草地土壤微生物研究报道极少,近20多年来,才受到一些学者的关注。因此,加强对草地微生物多样性和功能的研究,特别是加强气候变化与微生物关系研究,对恢复草地生态系统的生物学功能,实现草地农业生态系统的可持续发展具有重要的意义。
1 材料和方法
1.1 研究区概况
试验地设在内蒙古自治区中部、乌兰察布市西北部的四子王旗,地处北纬41°10′~43°22′,东经110°20′~113°,属温带大陆性季风气候区,年平均氣温1~6 ℃,1月最冷,平均气温自北向南由-14 ℃递降到-17 ℃。极端最低气温-39 ℃,7月最热,平均气温自南向北由16 ℃递升到24 ℃。极端最高气温35.7 ℃。积年平均降水量110~350 mm。四子王旗以畜牧业为主,资源丰富,植被类型为典型的荒漠草原,建群种为短花针茅(Stipa breviflora),优势种为冷蒿(Artemisia frigida)和无芒隐子草(Cleistogenes songorica),伴生种主要有木地肤 (Kochia prostrata)、阿氏旋花(Apgar bindweed)、细叶葱(Allium tenuissimum)、羊草(Leymus chinensis)、狭叶锦鸡儿(Caragana stenophylla)和小叶锦鸡儿(Caragana microphylla)等。
1.2 试验设计
1.2.1 增温试验 如图1A所示,增温试验是在荒漠草原上建立12个3 m×4 m的小区,其中6个小区上方2.25 m高处放置红外加热器;红外加热器所放高度保证其不会对土壤微生物产生影响;每个小区的间隔为4 m,避免重复加温;每个小区不同的土壤深度设置土壤温度测定仪,根据土壤及地表温度确定加热强度。试验设增温处理(T)及增温对照处理(Tck),6次重复,小区随机分布。增温灯管长边方向为南北方向,灯管离地面高度为2.25 m。利用灯管加热保证增温处理区地表温度增温1.5 ℃。
1.2.2 干旱模拟试验 如图1B所示,干旱模拟试验与增温试验在相同的地点,保证相同的草原类型及气候条件,建立12个6 m×15 m小区,其中在对照处理区每一个重复内设1个2 m×4 m的旱棚,旱棚顶部的开放面积为总面积的一半,用来模拟干旱的气候条件;旱棚收集的雨水用于增水处理区。每一小区土壤中设立自动水分测定仪,动态测定不同土壤深度的水分含量改变情况。每一试验都设有空白对照区,并保证对照及各处理区间在年内据有相同的农事活动。控水试验设对照处理(WCK)、增水处理(+W)、减水(-W)处理,6次重复,各小区随机分布。其中增水处理为增加当年自然降雨量的一半水量,减水处理为减少到年度自然降雨量的一半。
1.3 主要仪器和试剂
主要仪器:天马牌TD型电子天平、50 mL离心管、SW-CJ-1F双人单面净化工作台、Finn pipette单道移液器、YX280B手提式不锈钢压力蒸汽灭菌器、HY-4多用调速振荡器、JCZ-GPL050B智能程控型干燥/培养两用箱、Tocan透射防护盖紫外分析仪及成像系统、Blue Marlin TC-960F PCR仪等。
主要试剂:pH试纸、Para film PM-996封口纸、牛肉膏、蛋白胨、琼脂、NaCl、无水乙醇、KH2PO4、MgSO4·7H2O、孟加拉红、青霉素、可溶性淀粉、KNO3、K2HPO4、NaCl、FeSO4·7H2O、1 mol·L-1NaOH溶液、EB染液、超纯水等。
1.4 试验方法
1.4.1 土样采集 本研究地点选在内蒙古农牧科学院四子王旗野外定位站,在荒漠草原上进行人工增温水分控制试验,即采用红外加热器和人工化旱棚模拟不同气候变化,并设置空白对照区进行对比。本研究土样采自2012年8月初,包括增温处理、增温对照处理、增水处理、减水处理和水分对照处理。每处理随机选取多个样点,用土钻在每一个点取0~2,2~5,5~10,10~20,20~30 cm 5层土样各约30 g,用封口塑料袋密封,并在最短时间内带回实验室放于冰箱中,在冷冻条件下保存备用。
1.4.2 土壤细菌的培养方法 采用稀释平板法对土样进行分离,计数。采用牛肉膏蛋白胨培养基[10]对土样细菌进行培养,经过预试验确定细菌计数在30~300菌落数的稀释浓度是4~10 g·mL-1,此时不仅菌落利于计数,而且分离充分、特征明显。每个处理的土样稀释液设3个重复,涂布均匀后,将平板倒置放在温度为28 ℃的恒温培养箱中培养1~3 d,根据菌落特征进行初步分类、拍照和编号并进行菌落计数,最后挑选生长良好、有代表性的菌落进行分离与纯化。
1.4.3 土壤细菌的分子鉴定 用土壤DNA提取试剂盒提取菌落的DNA,以其为模板进行PCR扩增,所用的引物序列为341F-GC (5′-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GCG AGG CAG CAG-3′) 57 bp和 534R (5′-ATT ACC GCG GCT GCT GG-3′) 17 bp。
PCR反应体系为50 μL:10×Es Buffer(含Mg2+) 5 μL;dNTP 4 μL(各2.5 mmol·L-1),上游引物2 μL,下游引物2 μL,Tap Es DNA聚合酶0.5 μL(5 U·μL-1),模板1 μL(10 ng·μL-1),加超纯水至50 μL。PCR反应程序:94 ℃预变性5 min,30次循环:94 ℃变性 1 min,55 ℃退火45 s,72 ℃延伸45 s,最后72 ℃下延伸10 min。扩增后的PCR产物用1.5%琼脂糖凝胶电泳检测。
细菌16sDNA电泳检测出条带的PCR产物送交北京六合华大基因科技股份有限公司测序。将测序结果在NCBI中的BLAST里面的GenBank数据库进行比对分析,找出相似度最高的序列,使用CLASTALX进行比对,根据其与已知菌种16S DNA序列的相似性来进行菌种分类与鉴定。
1.5 数据处理
采用Sigmaplot13.0进行数据的图表处理, 利用SPSS13.0进行单因素方差、(One-Way ANOVA)分析。
2 结果与分析
2.1 气候变干、变暖条件下土壤细菌数量的变化
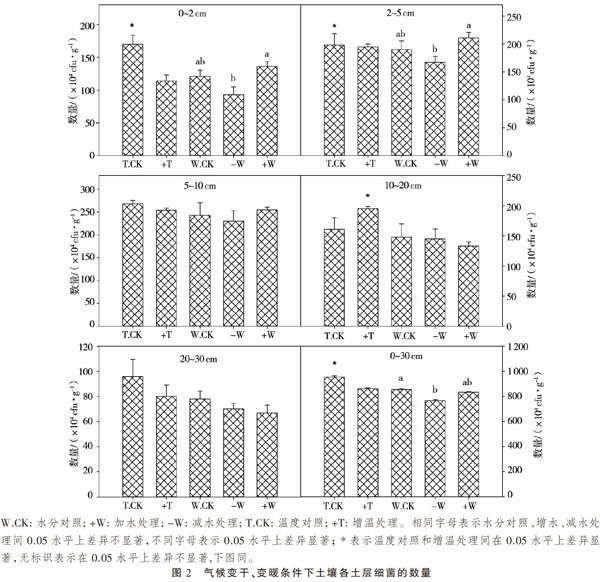
为了明确增温对草原土壤细菌数量的影响,比较了温度对照处理与增溫处理土壤细菌在不同土壤深度的差异。由图2可知,在土层0~2,2~5,5~10和20~30 cm中,增温组的土壤细菌数量低于空白对照组。其中仅在表层土壤0~2 cm和2~5 cm存在显著性差异,分别下降了32.94%,1.52%。在0~2 cm土层中温度对照处理细菌数量较多,与增温处理细菌数量相差最大。究其原因,可能是0~2 cm表层土受温度影响最大,由于人工增温导致0~2 cm表层土的温度超过部分细菌的最适生长温度,从而细菌数量迅速减少。在10~20 cm中,增温反而增加了土壤中细菌的数量,且存在显著性差异。综合考虑,增温处理后该土层深度的土壤温度比对照处理的稍高,其正好适宜细菌生长。20~30 cm土层中二者相差较小,可能是深层土壤的温度及理化性质比较稳定。整体来看,在0~30 cm土壤中,增温显著降低了土壤细菌数量。与空白对照相比,增温组土壤细菌数量下降了8.40%。说明,在人工增温的试验条件下,高温会对土壤部分细菌的生长产生抑制,造成其数量相对较少。
在水分试验中,对比3个处理结果可见:在5个土层中,0~2,2~5,5~10 cm土壤细菌数量均呈现:增水处理>水分对照处理>减水处理。增水处理增加了土壤表层的细菌数量,对中深层影响不显著。其中,0~2,2~5,5~10 cm土层中,与空白对照组相比,增水组土壤细菌数量分别增加了12.40%,11.05%,4.94%。随着土层加深,增水对土壤细菌数量的影响逐渐减弱。整体来看,0~30 cm中增水组的土壤细菌数量增加了2.82%,差异不显著。0~2,2~5,5~10 cm中,减水组的土壤细菌数量与对照相比分别下降了23.14%,12.11%和5.35%。原因可能是表层土壤中干旱缺水会影响部分细菌的生长,导致数量较少,且0~2 cm土壤层的水分相差最显著。在10~20,20~30 cm土层中,3个处理的细菌数量差别较小,趋于平衡,主要是由于随着土层深度的增加,土壤中的水分状况比较稳定,3个处理的差别较小。整体来看,0~30 cm土壤细菌总量在降雨量减少一半之后下降了9.62%。
总体而言,高温和缺水会对土壤细菌的生长条件产生很大的负面作用,导致其数量与对照区相比有所下降。首先,温度增加会使土壤可培养细菌减少约5.5×106 cfu·g-1,与对照相比降低6.16%;而干旱缺水土壤可培养细菌数量将减少7.5×106 cfu·g-1,与对照相比降低9.62%。对比发现缺水对于土壤可培养细菌数量的影响稍大一些,主要因为缺水对细菌数量影响较大。同时发现在人工增水处理情况下,与减水处理相比,土壤可培养细菌数量会有一定的恢复,并且稍多于水分对照处理。可见干旱情况在增水处理之后,土壤可培养细菌会得到相应的改善,其恢复力也较强。
2.2 土壤细菌种属鉴定结果
经过鉴定,取样土壤中的土壤细菌类群包括芽孢杆菌属、节杆菌(Arthrobacter spp.)、黄杆菌(Flavobacterium sp.)、耐盐节杆菌(Arthrobacter pascens)、枯草芽孢杆菌(Bacillus subtilis)、萎缩芽孢杆菌(Bacillus atrophaeus)、金色杆菌(Chryseo bacterium sp.)、双歧杆菌属(Bifido bacterium sp.)、污泥颗粒菌(Sludge granule bacterium)、产氢菌(Clostridium sp.)。其中芽孢杆菌属包括嗜碱芽孢杆菌(Bacillus alcalophilu)、腊状芽孢杆菌(B.cereus)、球形芽孢杆菌(B.spaericus)、泛酸芽孢杆菌(B.pantothenticus),且在各处理中芽孢杆菌属均占绝对优势,占细菌总量的80%。
2.3 气候变干、变暖条件下土壤细菌多样性的变化
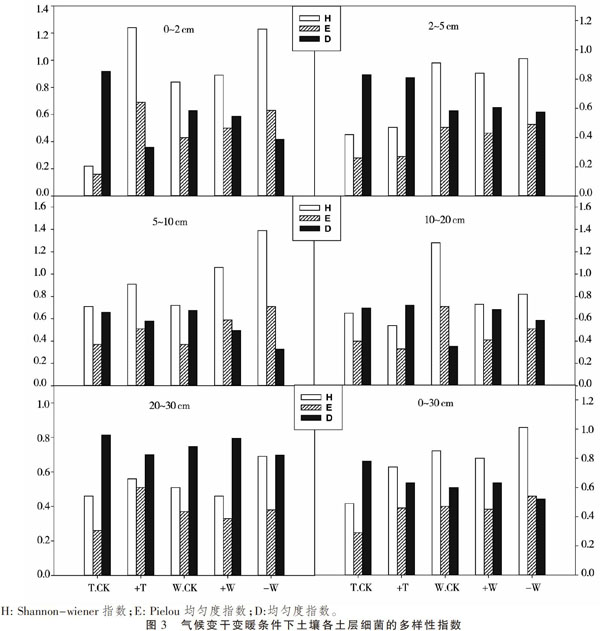
图3说明,气候变干变暖条件下不同土层细菌群落的多样性。其中增温处理中,除10~20 cm土层外,其余土层土壤中细菌群落的Shannon-wiener指数和Pielou均匀度指数均高于空白对照,优势度指数低于空白对照。说明增温使土壤细菌群落多样性略微增高,但差异不显著。但是在20~30 cm的深层土壤中细菌群落的物种多样性都趋于相似。这主要与表层土壤环境受外界环境影响较大,尤其是在温度升高的情况下,会刺激一些细菌类群的生长,而深层土壤理化性质相对稳定有关。
在减水处理中,土壤表层即0~2, 2~5, 5~10 cm中,土壤细菌群落的Shannon-wiener指数和Pielou均匀度指数均高于空白对照和增水处理,优势度指数均低于空白对照和增水处理。说明减水处理使土壤细菌群落的多样性有增高的趋势,且高于增水处理的效果,但差异不显著。随着土壤深度的增加,3个处理之间的多样性指数差距相对较小。说明土壤表层受土壤水分的影响比较明显,深层土壤受其影响较小。
在增水处理中,除0~2, 5~10 cm外,其余土层土壤中细菌群落的Shannon-wiener指数和Pielou均匀度指数均低于空白对照,优势度指数均高于空白对照。在0~30 cm土层中,土壤细菌群落的Shannon-wiener指数和Pielou均匀度指数均低于空白对照,优势度指数高于空白对照。说明增水处理对中深层土壤细菌群落的多样性有轻微的负面影响,但差异不显著。
3 结论与讨论
在本研究中,气候变化对内蒙古荒漠草原土壤细菌的数量产生了一定的影响。增温和干旱导致0~30 cm深度土壤细菌数量有所下降,而水分增加一半后,土壤细菌数量快速增加。研究表明,土壤微生物具有很强的恢复力,能在加水后的几天甚至几小时内快速恢复[11]。还有研究表明,适当的温度升高会增加土壤细菌的数量,但是超过其最适生长温度范围,土壤细菌数量就有一些种类的细菌数量稍有一些减少[12]。水分条件充足有利于土壤细菌的生长繁殖。因而,随着近年来内蒙古地区荒漠草原环境的恶化,尤其是缺水严重,会影响土壤中细菌的数量,使其有一定程度的减少。本研究还发现在五区样地的0~20 cm土层土壤细菌数量明显多于20~30 cm土层,二者相差10倍左右。表现为随土层深度的增加,土壤细菌数量呈明显下降的趋势,这与大多数的研究结果相一致[13],主要因为土壤表层牧草根系分布密集,根系分泌物和枯枝落叶积累多,营养和水热条件比深层土壤好,有利于细菌的生长和繁殖。
四子王旗试验样地的不同处理中土壤细菌的Shannon-Wiener指数、Pielou均匀度指数和优势度指数都有一定的差异。该区土壤细菌种类多,各样点差异不大。温度对照处理比增温处理的细菌优势度指数略高,而细菌物种多样性指数和均匀度指数增温处理高于对照处理,但差异不显著。类似的结果在其他研究中也有发现,短期的增温对土壤细菌的群落结构影响较为明显,但多样性和丰富度影响不大[14]。
增減水与对照区相比,细菌物种多样性指数和均匀度指数大致呈现:减水处理>对照处理>增水处理的趋势,水分对照处理优势度指数最高,增减水两区差别不显著。说明在内蒙古荒漠草原,减水区土壤中物种多样性指数相对较高,表层更为明显,随土层加深各指数也是趋于相同。可能是因为干旱会导致某些细菌种类数量分布较均匀。
参考文献:
[1]赵吉,廖仰南,张桂枝,等.草原生态系统的土壤微生物生态[J].中国草地,1999 (3): 57-67.
[2]王家玉.浙江稻田土坡的微生物区系研究闭[J].土壤通报,1984,15(6):274-278.
[3]ZHAO Q G, XU M J. Sustainable agriculture evaluation for red soil hill region of southeast China[J].Pedosphere,2004,14(3):313-321.
[4]JENKINSON D S,DAVIDSON S A,POWLSON D S. Adenosine triphosphate and microbial biomass in soils[J].Soil biology & biochemistry,1979,11(5):521-527.
[5]GUO J, ZHU T. Study on the relationship between microorganisms and ecological environment in Leymus chinesis grassland[J].Acta agerstia sinica,1996(4): 240-245(in chinese).
[6]ANDERSON T H, DOMSCH K H. A physiological method for the quantitative measurement of microbial biomass in soils[J].Soil biology and biochemistry, 1978,10:215-222.
[7]VAN VEEN J A, LADD J N, AMATO M. Turnover of carbon and nitrogen through the microbial biomass in a sandy loam and a clay soil incubated with 〔14C(U)〕glucosc and [15N](NH4)2SO4 under different moisture regimes[J]. Soil biology and biochemistry,1985,17(6):747-756.
[8]FIERER N, SCHIMEL J P, HOLDEN P A. Variations in microbial community composition through two soil depth profiles[J].Soil biology and biochemistry, 2003,35:167-176.
[9]龙健, 黄昌勇, 腾应, 等.我国南方红坡矿山复垦土壤的微生物特征研究[J].水土保持学报,2002,16(2): 126-128,132. [10]中国科学院南京土壤研究所微生物室.土壤徽生物研究法[M].北京:科学出版社,1985.
[11]LANDESMAN W J, DIGHTON J.Shifts in Microbial Biomass and the Bacteria: Fungi Ratio Occur Under Field Conditions Within 3 h After Rainfall[J]. Microbial ecology,2011,62(1):228-236.
[12]黄文华, 王树彦, 韩冰,等.草地生态系统对模拟大气增温的响应[J].草业科学,2014, 31(11):2069-2076.
[13]李志辉,李跃林,杨民胜,等.按树人工林地土坡徽生物类群的生态分布规律[J].中南林业学院学报,2000, 20(3):24-27.
[14]熊金波, 孙怀博, 彭飞,等.青藏高原短期增温实验引起土壤细菌群落的快速响应[C]// 中国土壤学会.面向未来的土壤科学(中册)——中国土壤学会第十二次全国会员代表大会暨第九届海峡两岸土壤肥料学术交流研讨会论文集,2012.
- 陕西水彩·粉画学术双年展:小画种呈现大力量
- 陕美博:安塞农民画作品展二玄社精制台北故宫博物院珍藏作品展
- 木木美术馆推出虚拟群展艺术还在:一场闭馆期间的展览
- 足不出户看展览陕西美博特别推出馆藏安塞农民画作品线上展
- 国宝扎堆:2020年看尽两岸故宫清明上河图里的“盛世”
- 苏富比2020年纽约艺术周日程调整
- “向往经典——中国当代著名艺术家邀请展”亮相国博
- 苏州美术馆线上展:又见依依江南
- “做一天马可·波罗:发现丝绸之路的智慧”主题展览
- 渡海三家春令特展
- 高丽莉作品赏析
- 韩承熹作品赏析
- 散乱星辰
- 家乡的月亮来看我
- 抱石
- 八公操
- 中式琴房设计方案
- 艺术与生活
- 优秀作品赏析
- 人物素描
- 山东工艺美术学院作品赏析
- 山东工艺美术学院学生作品赏析③
- 山东工艺美术学院学生作品赏析②
- 山东工艺美术学院学生作品赏析①
- 山东工业美术学院学生作品赏析
- outbulk
- outbulked
- outbulking
- outbulks
- outburst
- outbursts
- outbuy
- outbuying
- outbuys
- out-by
- outcamp
- outcant
- outcarol
- outcaroled
- outcaroling
- outcarolled
- outcarolling
- outcarols
- outcarry
- outcast
- outcasting
- outcasts
- outcatch
- outcatches
- outcatching
- 门神卷灶爷——画里有画
- 门神卷灶爷——画(话)里有画(话)
- 门神对子——两边贴
- 门神店里失火——人财两空
- 门神爷绷脸——不笑
- 门神爷绷脸——不笑出来
- 门神的大刀——净吓唬人
- 门神老了不捉鬼
- 门神里边卷灶爷——画(话)里有画(话)
- 门票
- 门祸
- 门禁
- 门禁森严
- 门秤
- 门窗
- 门窗上的搭扣
- 门窗上端遮雨的遮檐
- 门窗箱柜上的插关
- 门童
- 门符
- 门第
- 门第与身份
- 门第乌衣
- 门第低微的人
- 门第卑下