殷少文 叶世芸 王维
摘要:采用高效液相色谱法,研究不同生长年限及炮制方式对黔产青钱柳中槲皮素和山柰素含量的影响,确定最佳的干燥温度,考察种植年限对其品质的影响。通过正交试验,确定样品处理条件为用80%甲醇回流1 h,4 mL盐酸水解1 h。采用Agilent C18(250 mm×4.6 mm,5 μm)色谱柱,柱温30 ℃,流动相为甲醇:0.4%磷酸(65 ∶ 35),进样量10 μL,流速1 mL/min,在360 nm检测波长下建立槲皮素和山柰素的含量测定方法,以槲皮素和山柰素含量的总和为指标,确定最佳的干燥温度和生长年限。通过对样品提取条件和色谱条件的优化,槲皮素和山柰素分别在 3.12~99.8 μg/mL(r=0.999 8),3.23~103.4 μg/mL(r=0.999 9)內呈良好的线性关系,并且该方法稳定,结果可靠。对样品的测定结果进行系统聚类和方差分析,结果表明,青钱柳的最佳干燥温度为70~80 ℃,生长年限在3~5年内,其成品性状最佳。
关键词:青钱柳;干燥温度;生长年限;槲皮素;山柰素;高效液相色谱
中图分类号: S718.43 ?文献标志码: A ?文章编号:1002-1302(2019)02-0189-05
青钱柳[Cyclocarya paliurus (Batal.) Iljinsk.]系胡桃科(Juglandaceae)青钱柳属(Cyclocarya Iljinsk.),别称摇钱树或青钱李,是我国特有的单种属高大速生乔木[1],于冰川世纪保存至今,是国家重点保护的濒危植物之一。据《中国中药资源纪要》记载,其树皮树叶具有清热解毒、祛痈止痛之功效,其根、茎、枝均可入药[2]。青钱柳以茶饮为现代的主要应用方式。青钱柳茶是以青钱柳的初春嫩叶作为原料,经过简单的炮制工艺制成的原叶茶形态的保健品。现代科学研究发现,青钱柳叶含多糖、三萜、酚酸、皂苷、黄酮等多种有效成分,同时还含有氨基酸、维生素、锗、硒、铬、钒、锌、钙等多种微量元素[3],能够增强人体免疫力,抗衰老抗氧化,特别适宜于现代三高类慢性疾病人群的饮用[4-7]。
青钱柳广泛分布于我国贵州、云南、四川、湖南、湖北、福建等地。青钱柳是继被人们誉为医学界的第1棵树——柳树与第2棵树——红豆杉之后的医学界第3棵树,是大自然珍贵的宝藏[8]。在贵州省黔东南苗族侗族自治州地区,人们有长期饮用青钱柳茶的习惯,其茶饮气清香、色泽鲜亮呈浅红棕色、味甘如饴,具有生津止渴,清热解暑功效,当地俗称青钱柳为“甜茶树”。研究发现,青钱柳中黄酮类化合物可清除人体内自由基,具有抗病毒、抗炎、抗肿瘤、延缓衰老、增强心血管功能等作用[9],还具有抗油脂氧化活性,能降低三高发病率[10-11],因而备受人们关注。青钱柳中黄酮类化合物是青钱柳的有效物质基础之一,本研究通过探讨生长年限及干燥温度对黔产青钱柳中黄酮类化合物含量研究的影响,为青钱柳产业化种植的采摘及加工提供依据。
1 材料与方法
1.1 仪器
高效液相色谱(Agilent型号:1260);Agilent C18柱(规格:250 mm×4.6 mm,5 μm;型号:PN880975-902);超声波清洗器(江苏省昆山市超声仪器有限公司,型号:KQ-100E);鼓风干燥箱(上海跃进医疗器械有限公司,型号:1122815404);电子天平(瑞士梅特公司,型号:XS205)。
1.2 试药
槲皮素对照品(上海金穗生物科技有限公司,批号:20160322);山柰素对照(上海金穗生物有限公司,批号:20160113);色谱级甲醇(天津市科密欧化学试剂有限公司,批号:20130410);石油醚(重庆市川东化工有限公司,批号:20150901);冰乙酸(天津光复科技发展有限公司,批号:20161006);乙腈(天津科密欧化学试剂有限公司,批号:20151014);试验用纯净水。
所用青钱柳样品采自黔东南苗族侗族自治州剑河县雷山镇八万山林场的不同生长年限青钱柳,经贵阳中医学院叶世芸教授鉴定为胡桃科青钱柳属青钱柳[C. paliurus (Batal) lljinskaja]。将不同生长年限新鲜青钱柳分别在阴干、60 ℃、70 ℃、80 ℃、90 ℃、100 ℃条件下干燥。取干燥青钱柳用粉碎机粉碎,过60目筛备用。
1.3 对照品溶液的制备
精确称取槲皮素对照品10.87 mg和山柰素对照品 10.60 mg,置于25 mL容量瓶中,加甲醇定容至刻度,制成混合对照品溶液。可根据试验需求稀释至各不同浓度。
1.4 供试品溶液的制备
取青钱柳粉末约1.5 g,精密称定,置具塞锥形瓶中,精密加入80%甲醇50 mL。密塞,称定质量,加热回流1 h,冷却,用80%甲醇补足减失的重量,摇匀,滤过,精密量取续滤液 25 mL,精密加入盐酸4 mL后置90 ℃水浴中加热水解1 h,取出,迅速冷却,转移至50 mL容量瓶中,用80%甲醇定容至刻度,摇匀,用0.45 μm的滤膜过滤,即得。
1.5 色谱条件
色谱条件为:Agilent C18(250 mm×4.6 mm,5 μm)色谱柱,流动相为甲醇:0.4%磷酸(65 ∶ 35),进样量10 μL,流速 1 mL/min,检测波长360 nm,理论塔板数按山柰素计算,不得低于4 000,2个成分与其他组分之间的分离度均大于1.50。
2 结果与分析
2.1 色谱条件和系统适应性试验与结果
2.1.1 检测波长的选择 将供试品溶液和混合标准品溶液在“1.5”节的色谱条件下进行200~800 nm全波长扫描,以槲皮素和山柰素的峰面积为评价指标,结果表明,360 nm 为最佳扫描波长,结果见图1和图2。
2.1.2 流动相的选择 将保留时间、理论塔板数、对称因子作为流动相选择的依据,通过查阅文献,则可选择流动相有:甲醇 ∶ 0.2%磷酸体积比为55 ∶ 50、60 ∶ 40、65 ∶ 35,甲醇 ∶ 0.4%磷酸体积比为55 ∶ 45、60 ∶ 40、65 ∶ 35、70 ∶ 30。在流动相优化过程中,调整甲醇和0.4%磷酸的体积比例,结果随着甲醇体积分数的降低,槲皮素和山柰素的保留时间延长,并与杂质峰的分离度增大。当甲醇与0.4%磷酸的体积比为65 ∶ 35时,与杂质峰达到基线分离。为获得好的分离效果和适宜的分离时间,最终确定流动相为甲醇 ∶ 0.4%磷酸(65 ∶ 35)。
2.2 样品处理条件的优化
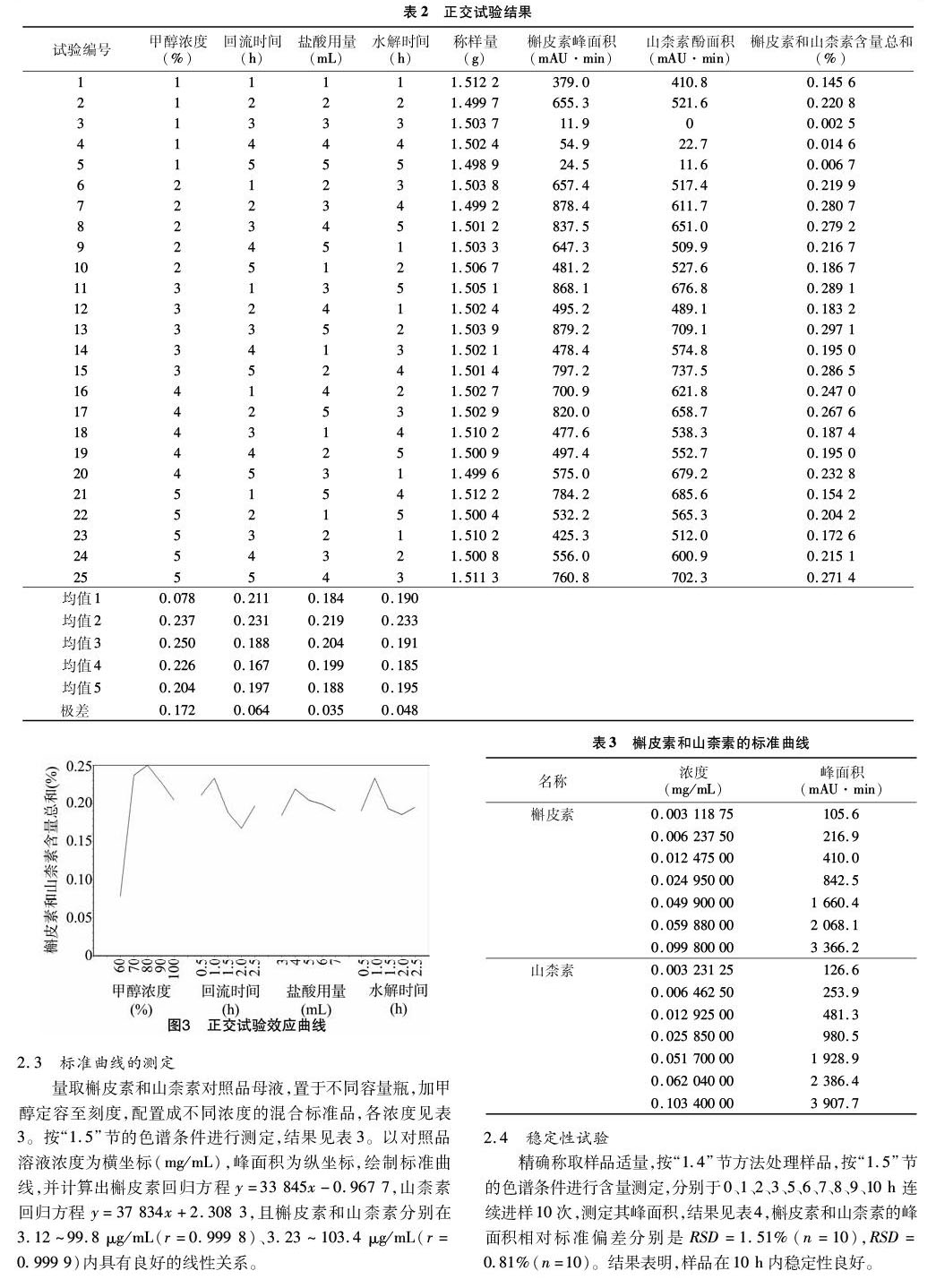
影响样品含量测定的因素有甲醇浓度、回流时间、盐酸用量及水解时间,根据单因素试验结果,确定正交试验水平(表1),结果见表2。
根据方差分析结果,样品处理因素对试验结果影响程度是甲醇浓度>回流时间>水解時间>盐酸用量,并且甲醇浓度F=3.971,P=0.046<0.05,对结果有显著性影响,其余因素的影响均不显著。根据均值、极差和效应曲线(图3),选择最优的样品处理条件:甲醇浓度为80%,回流时间为1 h,盐酸用量4 mL,水解时间1 h。
2.3 标准曲线的测定
量取槲皮素和山柰素对照品母液,置于不同容量瓶,加甲醇定容至刻度,配置成不同浓度的混合标准品,各浓度见表3。按“1.5”节的色谱条件进行测定,结果见表3。以对照品溶液浓度为横坐标(mg/mL),峰面积为纵坐标,绘制标准曲线,并计算出槲皮素回归方程y=33 845x-0.967 7,山柰素回归方程 y=37 834x+2.308 3,且槲皮素和山柰素分别在 3.12~99.8 μg/mL(r=0.999 8)、3.23~103.4 μg/mL(r=0.999 9)内具有良好的线性关系。
2.4 稳定性试验
精确称取样品适量,按“1.4”节方法处理样品,按“1.5”节的色谱条件进行含量测定,分别于0、1、2、3、5、6、7、8、9、10 h 连续进样10次,测定其峰面积,结果见表4,槲皮素和山柰素的峰面积相对标准偏差分别是RSD=1.51%(n=10),RSD=0.81%(n=10)。结果表明,样品在10 h内稳定性良好。
2.5 重复性试验
称取同一批药材6份,每份约1.5 g,精确称定,按“1.4”节方法处理样品,按“1.5”节的色谱条件测定含量(表5),其槲皮素和山柰素平均含量值分别为0.156 4%和0.108 9%,RSD值分别为 1.53%、1.39%,结果表明该方法重复性良好。
2.6 精密度试验
精确吸取10 μL槲皮素和山柰素浓度分别为 0.021 74、0.021 2 mg/mL的混合标准品,连续测定6次,结果见表6,其中槲皮素和山柰素峰面积的RSD值分别为0.17%和0.10%,表明仪器精密度良好。
2.7 加样回收试验
称取同一样品6份,分别精确加入2 mL 0.499 mg/mL 槲皮素和0.517 mg/mL山柰素,按供试品制备方法和色谱条件进行操作,进样10 μL,结果见表7,通过加样回收试验,回收率均在95%~105%的范围内,表明试验过程可靠。
2.8 样品的测定结果与分析
将备用的青钱柳样品按“1.4”节方法处理后,按“1.5”节色谱条件进行测定,结果见表8。
随机区组设计资料的方差分析结果(表9)表明,生长年限F=39.192,P=0.000<0.01,干燥温度F=14.133,P=0.000<0.01,所以生长年限和干燥温度对黔产青钱柳中黄酮类化合物的含量有显著的影响。
基于不同干燥温度下青钱柳中槲皮素和山柰素的总含量均值,采用系统分类的方法,对其干燥温度进行分类,结果见图4,当分为2类时,阴干、60 ℃、90 ℃、100 ℃为1类,70、80 ℃ 为1类。结合多重比较结果,低温和高温干燥对青钱柳的质量均有影响。以同样的方式对生长年限进行聚类分析,其结果无规律可寻,通过均值分析,青钱柳在3年、4年、5年时黄酮类化合物的含量较其他生长年限高。
3 结论与讨论
本研究通过单因素考察及正交试验,优化了样品处理的条件,通过对色谱条件的选择,优选测定条件,以保证测定结果具有较好的稳定性和重现性。
通过对不同生长年限和不同干燥温度的下的60份黔产青钱柳中槲皮素和山柰素的测定结果研究表明,生长年限和干燥温度都会对样品的质量产生显著的影响。青钱柳的最佳干燥温度为70~80 ℃,从本批样品中可以得出,生长年限在3~5年的青钱柳质量较佳。在青钱柳炮制加工过程中也发现,同一时期采摘的青钱柳,生长年限越久,其叶片中木质化部分越高,在加工的过程中容易碎裂,影响成品性状。
通过对贵州省剑河县青钱柳种植基地的考察发现,其加工方式为传统的茶叶炮制工艺,由于工艺简单,效率低,造成很多青钱柳霉变,加工过程中叶片碎裂,造成资源的浪费,并且炒制的过程中无温度控制,本研究的目的旨在解决青钱柳炮制过程中温度的控制。研究发现,高温干燥效率高,但当温度超过80 ℃时,产品颜色加深,容易烤焦,而且影响其黄酮类化合物的含量。低温干燥的效率太低,由于所需时间太长,造成青钱柳的霉变。对于生长年限而言,青钱柳属于多年生植物,在本批采样中,生长年限较长的叶片木质化程度较高,颜色较深,造成这种现象的原因可能是树木过于高大,下面叶片没有得到充分光照,具体因素还有待研究。
参考文献:
[1]《贵州植物志》编委会. 贵州植物志:第一卷[M]. 贵阳:贵州人民出版社,1982.
[2]中国药材公司. 中国中药资源志药[M]. 北京:科学出版社,1994:159-160.
[3]邓佑林,彭继升,李 芳,等. 青钱柳中黄酮成分提取工艺的优化及微量元素分析[J]. 化工技术与开发,2016,45(4):1-4.
[4]叶振南,李 楠,等. 青钱柳多糖对高脂血症大鼠血脂及抗脂质过氧化作用的影响[J]. 现代食品科技,2014,30(4):1-5.
[5]范冰舵,魏 颖,等. 青钱柳化学成分及降血糖活性研究概况[J]. 中国实验方剂学杂志,2014,20(13):239-242.
[6]刘 杰,向燕茹,等. 青钱柳抑制α-葡萄糖苷酶有效成分筛选及其对Ⅱ型糖尿病小鼠血糖的影响[J]. 食品工业科技,2015,36(14):363-369.
[7]Fu X,Yin Z P,Shangguan X C,et al.Stimulation of glucose consumption in 3T3-L1 adipocytes by triterpenoids from cyclocarya paliurus leaves[J]. Modern Food Science and Technology,2014,30(8):31-37.
[8]刘盈盈,张玉武,等. 青钱柳资源培育及其开发利用研究进展[J]. 北方园艺,2015(20):193-196.
[9]柳旭光. 青钱柳黄酮的提取分离、抗氧化活性及其应用研究[D]. 南宁:广西大学,2012.
[10]洑香香,方升佐. 青钱柳次生代谢产物及其生理功能[J]. 安徽农业科学,2009,37(28):3612-3614.
[11]吴 茹. 青钱柳叶总黄酮提取、分离纯化及抗氧化抑菌活性研究[D]. 南昌:江西农业大学,2015.
- 直销模式视角下网上零售企业的空间组织研究
- 特许经营视角下我国社区零售业的发展思路和经营策略探析
- 基于效用论的奢侈品网络消费行为分析
- 基于投入产出法的商贸流通产业链分析
- 基于生态文明的商贸流通业路径选择
- 基于区位选择因素的商贸流通业外商直接投资研究
- 互联网时代我国商贸流通业的融合创新模式研究
- 电子商务时代服务业顾客消费者行为的影响因素探究
- 大数据对我国商业模式创新的“三维”驱动研究
- 产业结构视角下现代商贸流通产业的辐射效应及优化路径
- 我国零售业的发展趋势及发展思路探索
- 土地信托流转对粮食产量影响的定量评估
- 上海期货交易所铜期货的国际价格影响能力研究
- 化妆品消费者冲动性购买行为的心理机制分析
- 顾客双渠道消费选择的影响因素探讨
- 城市综合体的商业模式和城市价值研究
- 粮食储备管理制度建设探讨
- 美国通用航空产业链集群网络化发展的启示
- 珠海名人故居旅游开发与保护研究
- 中小城镇产业升级转型所面临问题的探究
- 辽宁发展文化创意产业的思路及对策研究
- 基于产业融合视角的涪陵区休闲农业旅游发展路径研究
- 辽宁旅游业的发展体系构建研究
- 关于郑州航空港经济产业布局的思考
- 新时期企业人力资源管理发展与创新
- turn sb against sb/sth
- turn sb away
- turn sb on
- turn sb on (to sth)
- turn sb/sth down
- turn sb/sth out
- turn sb ↔ away
- turn signal
- turn-signal
- turn signals
- turn-signals
- turns in
- turns off
- turn somebodyin
- turn somebodyoff
- turn somebody out (of/from something)
- turn somebody/somethingback
- turn somebody/somethingout
- turn somethingin
- turn somethingoff
- turn somethingout
- turn somethingover
- turn somethingup
- turn somewhere inside out/upside down
- turn sour
- 办案
- 办案卷宗
- 办案神速果断的法官
- 办梓
- 办治
- 办法
- 办法、手段
- 办法、计策
- 办法和力量已用尽
- 办法和能力已用尽
- 办法想出三个,筐子也能装下水
- 办法用尽,无计可施,无路可走
- 办济
- 办灯儿
- 办班
- 办理
- 办理丧事
- 办理丧事、埋葬死者等事
- 办理丧事,埋葬死人
- 办理丧事,埋葬死人等事情
- 办理丧事,安葬死者
- 办理事业
- 办理事务
- 办理事务的部门
- 办理公事