曹坤 管明 陈康 胡彤 林赟 罗楚平

摘要:禾谷镰刀菌是引起农作物赤霉病的主要病原菌之一,其次生代谢产物呕吐毒素对人和动物有极大的安全危害,呕吐毒素一旦污染饲料不仅会造成巨额的经济损失,更有可能进入食物链威胁到人與动物的健康安全。目前我国鲜有高效的脱毒方法来应对呕吐毒素对于饲料的安全威胁。为解决上述问题,从江苏省淮安市土壤中筛选出1株同时具有禾谷镰刀菌抗性与呕吐毒素降解能力的解淀粉芽孢杆菌。解淀粉芽孢杆菌本身就是优异的饲料益生菌种,用高效液相色谱和质谱联用的方法分析该菌株后发现其含有杆菌霉素L和泛革素2种脂肽类抗生素,对禾谷镰刀菌的抑菌率达60%;经液相色谱检测后表明该菌在14 d后呕吐毒素转化率达到92.440%。数据表明该菌在饲料防霉与脱毒方面表现出良好的应用前景。
关键词:禾谷镰刀菌;呕吐毒素;解淀粉芽孢杆菌;生物防治;赤霉病
中图分类号:S816.79;S182 文献标志码: A
文章编号:1002-1302(2019)08-0179-05
禾谷镰刀菌是谷物农作物中常见的病原真菌,是主要的饲料污染源之一。在人工培养下主要进行无性繁殖,在作物中寄生时进行有性繁殖,其分生孢子及菌丝体具有典型的镰刀菌特征。当农作物生长遇到持续的阴雨天气时,禾谷镰刀菌表现出比其他寄生型真菌更强的生长优势,在小麦、大麦、燕麦、玉米等谷物农作物中生长、繁殖,导致赤霉病,同时产生毒素,而呕吐毒素就是其产生的主要真菌毒素[1-3]。遇到阴雨天气谷物饲料受潮之后,不仅会造成谷物饲料的霉化,同时也会造成真菌毒素的积累残留。当动物误食了受禾谷镰刀菌污染的饲料后便有可能威胁到动物的生理安全,进入食物链之后可对动物消化道黏膜产生强烈的刺激反射而作用于呕吐中枢,进而引起动物食欲减退、体质量减轻、代谢紊乱等症状而影响其生产性能[4-5],不仅会造成畜牧业的经济损失也有食品安全风险。由于目前市面上鲜有能够同时拮抗禾谷镰刀菌与降解呕吐毒素的方法,寻找一种安全高效的饲料防霉脱毒方法是业界的迫切需求。
呕吐毒素(DON),别称脱氧雪腐镰刀菌烯醇,化学名称为3,7,15-三羟基-12,13-环氧单端孢霉-9-烯-8-酮,主要由禾谷镰刀菌和黄色镰刀菌产生,20世纪70年代初日本Morooka等首次分离出这种真菌毒素,阐明其结构,并将其命名为4-deoxynivalenol(DON)[6-7]。因呕吐毒素容易引起猪呕吐,因此称为呕吐毒素,DON可以影响免疫细胞增殖、凋亡和免疫细胞因子的生成以至于降低机体的免疫力;同时DON具有细胞毒性,能够抑制粒状单核细胞增殖,抑制mRNA翻译和细胞外调节蛋白激酶活性,从而加速细胞死亡[8-9]。目前国内外针对呕吐毒素的降解方法主要有物理处理法、化学处理法及生物转化法。但由于呕吐毒素稳定的结构性质,如在210 ℃持续加热30~40 min条件下其结构才会被明显破坏等[10],传统的物理处理法脱毒效率低,而化学法虽然能达到良好的脱毒效果,但是容易混入其他有毒的化学试剂并且破坏饲料的营养成分。由于生物转化法能在温和的条件下降低或去除呕吐毒素,并且对饲料的感官性状和适口性影响较小,因此生物转化法脱毒便成为人们饲料脱毒的首选方案。本研究筛选出1株解淀粉芽孢杆菌,能够拮抗禾谷镰刀菌与降解呕吐毒素。解淀粉芽孢杆菌在代谢过程中能够产生次生代谢物——抗菌蛋白、脂肽类抗生素等多种抗菌物质[11-12],同时能够分泌多种消化酶或多肽等活性物质,可提高动物对营养物质的消化吸收,维持畜禽肠道菌群平衡,抑制有害病原菌的生长,增强抵抗疾病的能力,被广泛应用于畜牧、水产行业中[13]。毫无疑问解淀粉芽孢杆菌是最适合应用于饲料防霉脱毒的微生物之一。
解淀粉芽孢杆菌属于芽孢杆菌属,是一种具有广谱抑菌活性的革兰氏阳性菌,解淀粉芽孢杆菌最初是由Priest等发现鉴定的,模式菌株为ATCC23350[14]。1980年之前少有研究解淀粉芽孢杆菌的报道。近年来,随着解淀粉芽孢杆菌抑菌能力及产酶特性的发现[15],人们相继从自然界中筛选出各类功能特异的解淀粉芽孢杆菌,并研究其应用价值。Sutyak等从一些乳制品中筛选分离出对李斯特氏菌具有抑菌作用的解淀粉芽孢杆菌[16];计坚研究表明,解淀粉芽孢杆菌可有效缓解大肠杆菌引起的仔猪炎症反应,可一定程度缓解断奶仔猪的腹泻[17];沈勇涛研究报道,母猪饲料中添加解淀粉芽孢杆菌制剂可以改善母猪肠道微生态体系,帮助新生仔猪尽早建立肠道微生态体系,从而显著提高仔猪生长性能[18];解淀粉芽孢杆菌M001(108 CFU/g)作为饲料添加剂可显著提高大比目鱼胰脂肪酶、胰蛋白酶、肠蛋白酶及胃蛋白酶活性[19];解淀粉芽孢杆菌Q-12作为对植物病原菌尖孢镰刀菌具有强烈抗菌活性的生物防治菌被应用于植物病害防治上,同时其在畜牧及水产行业中也得以广泛应用[20]。
本研究从江苏省淮安市小麦田中筛选出1株解淀粉芽孢杆菌。该菌在对禾谷镰刀菌具有明显拮抗作用的同时对禾谷镰刀菌产生的真菌毒素——呕吐毒素具有高效的降解效果。
1材料与方法
1.1试验材料
1.1.1菌种解淀粉芽孢杆菌CPLK1314是在本研究中筛选分离得到。用于测定抑菌谱的禾谷镰刀菌由淮阴工学院生命科学与食品工程学院菌种库提供。
1.1.2培养基分离筛选用培养基为马铃薯葡萄糖固体培养基(PDA),其组成为马铃薯200 g、葡萄糖20 g、琼脂15 g、蒸馏水补足至1 000 mL,pH值自然。Luria-Bertani(LB)培养基,其组成为胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g、蒸馏水补足至1 000 mL,pH 值7.0。水琼脂平板:琼脂20 g、蒸馏水补足至1 000 mL,pH值自然。麦麸培养基:麦麸10 g、蒸馏水补足至10 mL,pH值自然。
1.2菌种的分离纯化
1.2.1菌种的初筛
从江苏省淮安市小麦田收集了200份土壤样品,分别过40目筛后称取0.5 g样品,将样品加入 4.5 mL 的生理盐水中,振荡2 min。将20 mL PDA培养基均匀地注入 9 cm 平皿中,待培养基凝固后,在其中间放置1片圆形滤纸片,然后把20 μL上述土壤样品悬浮液滴入圆形滤纸片中。接着在距平皿中心2.5 cm处对称地接上禾谷镰刀菌,将平板置于28 ℃恒温箱培养3~7 d并观察抑菌圈的形成。挑出有明显抑菌圈的平板,将生长在圆形滤纸片周围的菌落用划线法接种到LB培养基琼脂平板上,通过反复平板划线接种获得单菌落。将单菌落划线接种至LB斜面,分类保存备用。
1.2.2菌种的复筛
将上述保存在斜面中的初筛菌株,接种到液体LB培养基中28 ℃活化48 h,取出后28 ℃、8 000 r/min 离心10 min得上清液,取1 mL上清液加入 5 μg/mL 浓度的呕吐毒素1 mL,28 ℃放置48 h后用高效液相色谱法检测呕吐毒素的峰面积变化[检测条件为色谱柱:Agilent zorbax sb-Aq C18(规格:4.6 mm×250 mm,粒径:5 μm);柱温为29 ℃;进样量为20 μL;流动相为V乙腈 ∶V水= 15 ∶85;流速为0.8 mL/min;检测波长为218 nm)。挑选出峰面积减小的菌株组别。
1.3菌株的生物学鉴定
1.3.1生理生化测定菌株形态以及生理生化特性测定参照参考文献[21]的方法。
1.3.2解淀粉芽孢杆菌的16S rDNA PCR扩增和序列测定
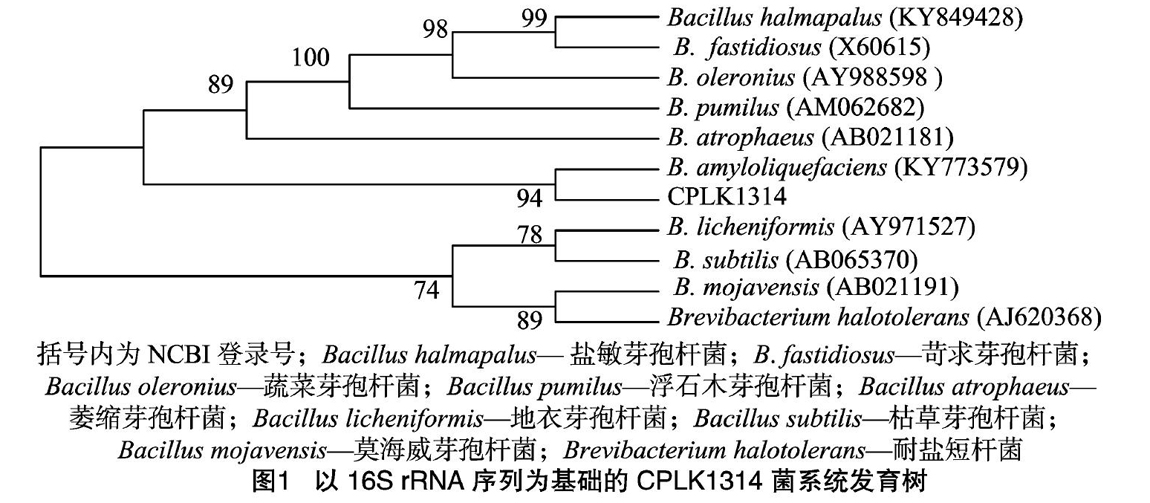
利用16S rDNA通用引物,以菌株CPLK1314的DNA为模板进行PCR扩增,测序得到长度为1 472 bp的16S rDNA基因片段,在NCBI(美国国立生物技术信息中心网站)上经Blast同源性比对,发现菌株CPLK1314基因序列与芽孢杆菌相似度达99%,构建系统发育树。
1.4菌株对禾谷镰刀菌拮抗能力的测定
1.4.1菌株发酵产物的测定
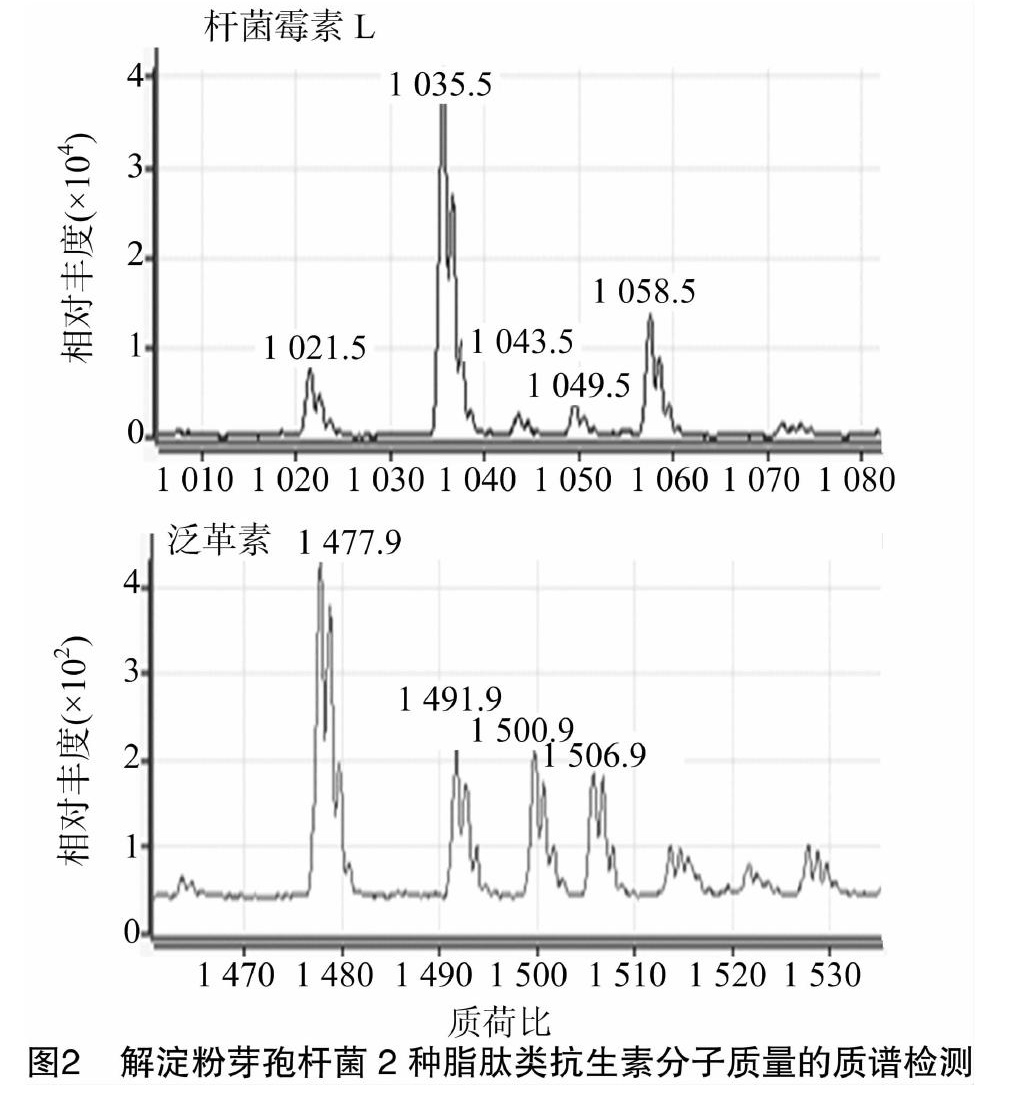
将菌株CPLK1314接种在 1 000 mL LB培养基中培养72 h后离心除去菌体,上清液用浓盐酸(质量分数为37%)调至pH值2.0沉淀过夜,28 ℃、8 000 r/min 离心25 min得到沉淀,沉淀用1/10体积甲醇分2次抽提,每次抽提2 h,合并甲醇抽提物。甲醇抽提物减压浓缩后过0.22 μm微孔滤膜即可进行质谱检测。质谱分析仪器为Agilent 6410三重串联四级杆质谱仪,购自美国安捷伦科技股份有限公司。采用(色谱纯)饱和α-氰基-4-羟基桂皮酸、0.1%三氟乙酸、乙腈和水(体积比3 ∶1)溶液稀释样品1 000倍后,通过注射器直接进样粗制备脂肽类抗生素。采用质谱法测定粗提脂肽类化合物的分子质量,电喷雾条件为毛细管电压32 V、喷雾电压20 kV、毛细管温度320 ℃。检测方式为正离子检测。
1.4.2解淀粉芽孢杆菌CPLK1314对禾谷镰刀菌生长和菌丝与孢子的影响
将解淀粉芽孢杆菌CPLK1314接种于LB液体培养基(g/L)培养72 h后得发酵液,采用平板对峙试验测定解淀粉芽孢杆菌发酵液对禾谷镰刀菌的拮抗作用。具体为将禾谷镰刀菌菌块(直径5 mm)接种在LB平板(直径9 cm)中央,在距离菌块2.5 cm处放置牛津杯并滴加 100 μL 发酵液,于28 ℃培养,待菌丝长至合适位置,观察发酵液对禾谷镰刀菌的抑制活性,测定抑菌带宽。在菌块另一侧以未接种芽孢杆菌的培养基上清液作为空白对照组,每组处理33个重复。抑菌率=(空白对照组菌落直径-处理组菌落直径)/空白对照组菌落直径×100%。于光学显微镜下观察解淀粉芽孢杆菌CPLK1314对禾谷镰刀菌菌丝生长的影响。另外取禾谷镰刀菌菌种接于PDA平板上28 ℃活化 14 d,然后用无菌水将菌种配成1×103 CFU/mL 的孢子悬浮液(血球计数板计数),随配随用。取200 μL孢子悬浮液涂布在水琼脂平板上,定时于显微镜下观察记录禾谷镰刀菌孢子萌发形态。取解淀粉芽孢杆菌CPLK1314划线培养于LB平板培养基上,在28 ℃下培養24 h后转接于LB培养液中,28 ℃、200 r/min培养24 h成种子液。以1 ∶100的比率在LB培养液中扩繁。28 ℃、200 r/min、扩繁72 h后所得菌液在4 ℃、5 000 r/min 离心10 min,取上清。将1 mL上清液与1 mL孢子悬浮液充分混合后取200 μL涂布于水琼脂平板镜检观察禾谷镰刀菌孢子形态。
1.4.3解淀粉芽孢杆菌CPLK1314在饲料中对禾谷镰刀菌的防治能力
取禾谷镰刀菌接于PDA平板上,28 ℃活化 14 d,然后用无菌水将菌种配成1×106 CFU/mL的孢子悬浮液(血球计数板计数),随配随用。将解淀粉芽孢杆菌CPLK1314划线培养于 LB平板培养基上。在28 ℃下培养 24 h 后转接于LB培养液中,28 ℃、200 r/min培养24 h成种子液。以1 ∶100的体积比率在LB培养液中扩繁。28 ℃、200 r/min扩繁72 h后所得菌液在4 ℃、5 000 r/min下离心10 min,离心所得菌体用LB培养液重悬浮并调至所需浓度即得解淀粉芽孢杆菌悬液。取200 μL禾谷镰刀菌孢子液与200 μL解淀粉芽孢杆菌悬液混合于2 mL EP管中,漩涡振荡1 min混匀后用移液枪加入麦麸培养基中,观察孢子萌发与菌丝生长状况。
1.5解淀粉芽孢杆菌CPLK1314对呕吐毒素的降解能力
1.5.1呕吐毒素标准曲线的制作
将呕吐毒素(北京贝纳创联生物技术研究院)用色谱纯甲醇配制成浓度为5、10、25、50、100 μg/mL浓度标准品后用高效液相色谱法检测呕吐毒素在不同浓度下的峰面积[检测条件为色谱柱:Agilent zorbax sb-Aq C18(规格:4.6 mm×250 mm,粒径:5 μm);柱温为 29 ℃;进样量为20 μL;流动相为V乙腈 ∶V水=15 ∶85;流速为0.8 mL/min;检测波长为218 nm]。
1.5.2解淀粉芽孢杆菌CPLK1314对呕吐毒素的降解转化能力
将解淀粉芽孢杆菌CPLK1314接种于LB液体培养基中30 ℃活化培养48 h,取100 mL发酵上清液,放入冰水浴中预冷10 min,将硫酸铵研磨成粉末在搅拌、冰浴条件下缓慢加入,分别加至终浓度为75%(质量分数)。加完后继续搅拌15~20 min。4 ℃冰箱静置过夜,12 500 r/min低温离心 15 min,得到的沉淀用10 mL NaH2PO4缓冲液(pH值6.60)溶解即为胞外酶粗提液。取1 mL胞外酶粗提液加入DON配制成浓度为25 μg DON/mL的试验组。分别用不加胞外酶粗提液只加DON和不加胞外酶粗提液不添加DON的NaH2PO4缓冲液(pH值6.60)作阳性对照和阴性对照,32 ℃、180 r/min摇床培养3、7、14 d,然后用高效液相色谱法根据峰面积检测计算培养基中剩余DON含量[检测条件为色谱柱:Agilent zorbax sb-Aq C18(规格:4.6 mm×250 mm,粒径:5 μm);柱温为29 ℃;进样量为20 μL;流动相为V乙腈 ∶V水= 15 ∶85;流速为0.8 mL/min;检测波长为218 nm]。
2结果与分析
2.1菌种的分离与筛选
从淮安市土壤样品中筛选出10株对禾谷镰刀菌有较明显抑菌圈的菌株,其中菌株CPLK1314对禾谷镰刀菌有明显的拮抗作用且对呕吐毒素具有高效的降解效率。
2.2菌株COLK1314的生物学鉴定
对筛选的菌株CPLK1314进行形态学鉴定和生理生化鉴定:菌株CPLK1314菌体细胞在400倍光学显微镜下呈短杆状,具有运动性;在LB培养基上形成的菌落呈圆形,边缘整齐,中间形成褶皱,淡黄色,不透明(表1)。
构建的系統发育树如图1所示,菌株CPLK1314与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)亲缘关系最近。结合生理生化试验结果(表1)初步鉴定菌株CPLK1314为解淀粉芽孢杆菌。
2.3菌株拮抗禾谷镰刀菌效果
2.3.1菌株CPLK1314的发酵产物
图2采用高效液相色谱和质谱联用的方法分析检测到解淀粉芽孢杆菌的培养液中含有2种脂肽类抗生素,经对比为杆菌霉素L与泛革素。
2.3.2菌株CPLK1314对禾谷镰刀菌的抑菌率及对其孢子、菌丝的影响
菌株CPLK1314对禾谷镰刀菌的抑菌率如表2所示,经3组平行测试后发现该菌对禾谷镰刀菌的平均抑菌率达60%。图3为菌株CPLK1314对禾谷镰刀菌孢子与菌丝的影响,经对比发现,菌株CPLK1314处理后的真菌孢子相较于正常孢子,两端膨大,产生分歧,形状不规则;菌丝则相较于正常菌丝表现为菌丝杂乱,菌丝部分膨大,部分菌丝甚至出现消融现象。表明菌株CPLK1314对禾谷镰刀菌孢子具有明显的致畸作用且对禾谷镰刀菌菌丝具有明显的抑制效果。
2.3.3菌株在饲料储存中的抗菌效果
如表3、图4所示,经3组平行试验证明,在添加相同浓度禾谷镰刀菌孢子的条件下,极短时间内只添加无菌水的对照组孢子迅速萌发并侵染整个三角瓶底部,而加入不同浓度梯度的菌株CPLK1314的发酵液试验组均表现出对外来孢子的萌发抑制能力,并且对后续的禾谷镰刀菌菌丝生长具有不同程度的拮抗效果,菌株CPLK1314浓度越高其效果越明显。而在试验设置最高浓度组106 CFU/g浓度下,至三角瓶中水分自然消失至干竭状态时,瓶中菌丝依旧未完全铺满,甚至部分干瘪消失,表现出优异的禾谷镰刀菌拮抗能力。该试验的实践意义在于,在传统饲料储藏中加入以解淀粉芽孢杆菌CPLK1314为主要成分的防腐剂,预期可有效抑制禾谷镰刀菌的孢子萌发与菌丝生长。
2.4菌株的呕吐毒素降解能力
2.4.1呕吐毒素标准曲线
如表4、图5所示,将各个浓度呕吐毒素标准品的液相色谱图重叠,以呕吐毒素标准品的浓度为横坐标,以高效液相色谱的峰面积为纵坐标绘制标准曲线,得线性回归方程为y=13.950x+30.566,r2=0.998 6。
2.4.2菌株对呕吐毒素降解能力的检测
解淀粉芽孢杆菌CPLK1314对呕吐毒素处理14 d,分别在3、7、14 d时通过高效液相色谱检测得峰面积,再根据呕吐毒素的标准曲线计算出剩余呕吐毒素浓度,进而得出菌株CPLK1314胞外酶粗提液对呕吐毒素的降解转化效果。由表4可知,菌株胞外酶对呕吐毒素的降解转化效率高达92.440%,具有高效良好的呕吐毒素降解能力。
3讨论与结论
禾谷镰刀菌及其次生代谢产物呕吐毒素广泛存在于自然界中,容易对谷物和饲料造成严重的污染,并因此导致巨额的经济损失,人和动物一旦摄入被呕吐毒素污染的粮食或饲料也有可能引起毒素的中毒,因此对于呕吐毒素的防治与研究具有深远且重要的意义。目前关于呕吐毒素的脱毒方法大致分类为物理法、化学法和生物降解法,其中生物降解法以其温和的反应条件和高效的脱毒效率被认为是呕吐毒素脱毒的最佳方案。世界各地的学者都在孜孜不倦地寻求高效、合理、安全、经济的呕吐毒素防治与降解手段。
本研究从淮安市霉化污染严重的小麦田中筛选出1株既可以拮抗禾谷镰刀菌又对呕吐毒素具有一定脱毒能力的菌株。经初步鉴定后判断为解淀粉芽孢杆菌,经高效液相色谱和质谱联用的方法检测出该解淀粉芽孢杆菌的培养液中含有杆菌霉素L和泛革素2种脂肽类抗生素,对禾谷镰刀菌的抑菌率达到60%,对禾谷镰刀菌孢子具有一定的致畸性,对禾谷镰刀菌的菌丝也有较强的抑制干扰作用,在生物防治试验中,浓度达到106 CFU/g的试验组表现出对禾谷镰刀菌优异的生防功效。与此同时,经硫酸铵沉淀后获得的胞外酶粗提液14 d后对呕吐毒素的转化率达到了92.440%。
解淀粉芽孢杆菌在作为优秀的植物病害生防菌的同时也经常被用于作为饲料益生菌群。本研究的解淀粉芽孢杆菌表现出优异的饲料储存防霉应用潜力。其同时具有的禾谷镰刀菌抗性和降解呕吐毒素能力的特性可以一定程度地保证饲料不会被禾谷镰刀菌侵染,并可以消除饲料预先残留的呕吐毒素,又或者可以将其加工制成高效的呕吐毒素脱毒剂应用于饲料食品的加工产业。但是试验表明,只有在达到一定的浓度条件下,该解淀粉芽孢杆菌才能表现出最佳的防霉特性,其在大规模应用的经济性方面还有待商榷。同时,该菌的胞外酶特性尚未被完全解析,其转化呕吐毒素的具体机制与细节具有广阔的研究潜力与意义。本研究筛选出的解淀粉芽孢杆菌CPLK1314为今后的工作打下了基础,今后将对呕吐毒素的具体降解机制进行深入研究,以便更高效、合理、安全、经济地应用于饲料的贮存与脱毒。
参考文献:
[1]方兴洲. 小麦赤霉病研究进展[J]. 现代农业科技,2014(23):134-135.
[2]Cui L,Selvaraj J N,Xing F G,et al. A minor survey of deoxynivalenol in Fusarium infected wheat from Yangtze-Huaihe river basin region in China[J]. Food Control,2013,30(2):469-473.
[3]Pestka J J. Deoxynivalenol:mechanisms of action,human exposure,and toxicological relevance[J]. Archives of Toxicology,2010,84(9):663-679.
[4]Maresca M,Mahfoud R,Garmy N,et al. The mycotoxin deoxynivalenol affects nutrient absorption in human intestinal epithelial cells[J]. The Journal of Nutrition,2002,132(9):2723-2731.
[5]Koch P. State of the art of trichothecenes analysis[J]. Toxicology Letters,2004,153(1):109-112.
[6]Morooka N,Uratsuji N,Yoshizawa T,et al. Studies on the toxic substances in barley in fected with Fusarium spp.[J]. Journal of the Food Hygienic Society of Japan,1972,13(5):368-375.
[7]Yoshizawa T,Morooka N. Biological modification of trichothecene mycotoxins:acetylation and deacetylation of deoxynivalenols by Fusarium spp.[J]. Applied Microbiology,1975,29(1):54-58.
[8]Moss M O,Thrane U. Fusarium taxonomy with relation to trichothecene formation[J]. Toxicology Letters,2004,153(1):23-28.
[9]Thuvander A,Wikman C,Gadhasson I. In vitro exposure of human lymphocytes to trichothecenes:individual variation in sensitivity and effects of combined exposure on lymphocyte function[J]. Food and Chemical Toxicology,1999,37(6):639-648.
[10]吳永宁. 现代食品安全科学[M]. 北京:化学工业出版社,2003:311.
[11]Moe N K T,Su M T,Suzuki K,et al. Production of an antibacterial substance by Bacillus mojavensis strain F412 isolated from a Myanmar shrimp product fermented with boiled rice[J]. Fisheries Science,2015,81(4):795-802.
[12]陈哲,黄静,赵佳,等. 解淀粉芽孢杆菌抑菌机制的研究进展[J]. 生物技术通报,2015,31(6):37-41.
[13]Skadsen R W,Hohn T M. Use of Fusarium graminearum transformed with gfp to follow infection patterns in barley and Arabidopsis[J]. Physiological and Molecular Plant Pathology,2004,64(1):45-53.
[14]Priest F G,Goodfellow M,Shute L A,et al. Bacillus amyloliquefaciens sp. nov.,norn. rev.[J]. International Journal of Systematic Bacteriology,1987,37(1):69-71.
[15]Xu Z H,Shao J H,Li B,et al. Contribution of bacillmoycin D in Bacillus amyloliquefaciens SQR9 to antifungal activity and biofilm formation[J]. Applied and Environmental Microbiology,2013,79(3):808-815.
[16]Sutyak K E,Wirawan R E,Aroutcheva A A,et al. Isolation of the Bacillus subtilis antimicrobial peptide subtilosin from the dairy product-derived Bacillus amyloliquefaciens[J]. Journal of Applied Microbiology,2008,104(4):1067-1074.
[17]计坚. 解淀粉芽孢杆菌SC06介导猪肠道免疫机理的研究[D]. 杭州:浙江大学,2011.
[18]沈勇涛. 芽孢杆菌对母猪仔猪微生态的影响及其生长条件优化[D]. 武汉:华中农业大学,2011.
[19]Chen Y,Li J,Xiao P,et al. Isolation and characterization of Bacillus spp. M001 for potential application in turbot(Scophthalmus maximus L.)against Vibrio anguillarum[J]. Aquaculture Nutrition,2016,22(2):374-381.
[20]权春善,王军华,徐洪涛,等. 一株抗真菌解淀粉芽孢杆菌的分离鉴定及其发酵条件的初步研究[J]. 微生物学报,2006,46(1):7-12.
[21]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
- 捕捉大自然瞬息万变的光影
- 论国画的表现形式与审美特点
- 《洛神赋图》的图像学分析
- 工笔人物画的创作与体悟
- 间析赵佶水墨与工笔赋色花鸟画的异同
- 女性题材系列绘画作品中的情感依赖
- 插画的艺术性与商业性的矛盾统一
- 袁武和他的军旅中国画
- 山水画传统“写生”概念中的审美取向与现代“写生”概念之比较
- 浅谈当代水彩人物画创作的概况
- 《富春山居图》的表现技法研究
- 工笔人物画的历史与当代发展
- 唐代墓室壁画中的花鸟画探究
- 赵孟頫的《鹊华秋色图》赏析
- 以中西(主要以印象派)方绘画色彩为例谈对东方美学品格之理解
- 浅析周臣《流民图》的写实性
- 左权民歌的传播现状初探
- 浅谈口技艺术的创作
- 提高杂技艺术的表现力和感染力的策略分析
- 戏曲青衣行当的人物塑造
- 浅谈杂技艺术的历史现状及特点
- 浅谈京剧丑角独特的艺术风格
- 中国杂技的传承困境与对策分析
- 杂技与跨领域表演的融合与审美
- 茂县地区羌笛音乐的保护与传承
- untolerably
- untolerated
- untolerating
- untolerative
- untombed
- untoned
- untongued
- untooled
- untoothsome
- untopographical
- untopographically
- untopped
- untopping
- untoppled
- untormented
- untormenting
- untormentingly
- untorpedoed
- untortuous
- untortuously
- untortuousness
- untortuousnesses
- untortured
- untossed
- untotaled
- 疏松的土
- 疏松的样子
- 疏松而厚实
- 疏析
- 疏林
- 疏梅映月的景色
- 疏梦
- 疏治
- 疏注
- 疏浅
- 疏浚
- 疏浚水道
- 疏浚江河
- 疏涩
- 疏淡
- 疏深
- 疏渐
- 疏港
- 疏滞
- 疏漏
- 疏漏忽略
- 疏漏错乱
- 疏濬
- 疏瀹
- 疏烟