刘歌畅 王留成 姚旭 张静 李玉灵 徐学华


摘要:以高效固氮菌属Ecl为研究对象,通过对Ecl进行分子鉴定及其在铁尾矿基质下紫花苜蓿上进行接种试验,对植株生长指标、土壤化学性质及土壤酶活性进行测定。结果表明,Ecl属于固氮菌属,16S rDNA PCR扩增产物片段大小为1 600 bp左右,其菌株可以促进紫花苜蓿植株的生长,提高土壤酶活性、土壤养分。被接种的紫花苜蓿植株生长状况均优于未接种的处理,其地下干质量、地上干质量、株高、侧根数、最长侧根长度、主根长度比未接种的植株分别增加91.02%、83.43%、74.08%、56.70%、46.77%、48.54%,表明接种高效固氮菌Ecl可以促进植株的生长。紫花苜蓿接种Ec1,其土壤酶活性与土壤养分均高于对照。接种Ecl的植株比未接种植株的蔗糖酶、脲酶、磷酸酶活性分別增加 0.03 mg/(g·d)、3.95 μg/(g·h)、1.50 μg/(g·h);速效磷、速效钾、碱解氮含量分别增加57.83%、13.22%、29.48%。
关键词:高效固氮菌Ecl;分子鉴定;盆栽;铁尾矿;接种效果
中图分类号: X171.4文献标志码: A
文章编号:1002-1302(2019)08-0279-05
铁矿资源的快速发展使铁尾矿排放量急剧增加[1],而由于其综合利用效率低,堆放面积大,易造成周边环境污染[2],因此必须进行铁尾矿修复。铁尾矿是缺乏土壤元素、生物难以生存的立地类型之一[3],铁尾矿的修复治理是目前人类急需解决的难题。
近年来,铁尾矿修复研究成为热点,植物生态恢复是铁尾矿修复的重要途径。马云波等通过对人工与自然植被恢复下尾矿土壤微生物及酶活性时空变化的研究,表明人工林的土壤微生物数量种类及酶活性均显著高于自然恢复模式[4];可见,植物恢复可明显改善矿区生物学特性。王艳超等通过不同恢复模式对铁尾矿和酶活性影响的研究,表明人工林下的酶活性显著高于自然恢复,植被恢复可以有效缩短铁尾矿修复的年限[5]。土壤微生物是土壤形成过程最活跃的生物成分,能促进土壤结构的形成和养分的循环,所以土壤微生物在铁尾矿修复中占重要地位。王艳超在不同植被恢复模式下对铁尾矿物种多样性、土壤养分及生物因子进行研究,结果表明土壤微生物在铁尾矿治理过程中有不可替代的作用[6]。阎爱华等通过对不同自然定居植被对铁尾矿微生物数量、酶活性和生物多样性影响的研究,表明土壤微生物在铁尾矿修复起到关键作用[7]。由此可见,植被恢复和土壤微生物对于铁尾矿修复都具有重要作用,利用植物与土壤微生物的协同作用来进行铁尾矿修复非常具研究价值。
很多矿区选择对铁尾矿进行植被恢复,忽略土壤微生物的作用。目前,利用植物与微生物协同作用对铁尾矿进行修复的研究较少。因此,本试验利用李雯等筛选出的高效固氮菌Ecl[8]为基础,进一步进行分子鉴定,并将其在铁尾矿基质下接种于紫花苜蓿上进行盆栽试验,探究接种高效固氮菌对植株生长、土壤酶活性以及土壤养分的作用规律,同时植物与微生物协同作用能为尾矿改善提供理论指导,为铁尾矿废弃地的生态治理提供科学依据。
1材料与方法
1.1材料和试验设计
试验材料为紫花苜蓿(Medicago sativa L.)种子,由河北农业大学林学院提供。试验设置5个处理:CK为空白对照,处理A为未灭菌未接菌,处理B为未灭菌接菌,处理C为灭菌未接菌,处理D为灭菌接菌。盆栽试验在河北农业大学温室中进行。于2016年8月将花盆装满土,土壤基质为尾矿砂和土壤按质量比1 ∶1混合,(灭菌尾矿砂+灭菌土壤、未灭菌尾矿砂+未灭菌土壤)。用水浸透花盆,挑选出颗粒饱满、健康的紫花苜蓿种子,用55 ℃温水浸泡种子约30 min,于阳光下暴晒,裁剪滤纸,用蒸馏水浸湿滤纸,将浸湿的滤纸平铺在培养皿中,晚上将种子置于培养皿中,维持种子湿度。待培养的大部分种子开始膨胀时,将种子与含1%的羧甲基纤维素钠的菌悬液按1 g ∶10 mL混合拌种,至混合均匀。将接种菌和未接种菌的种子埋入各处理土壤深度为2 cm处,每个处理15盆。试验期间,进行正常浇水除草,保证植株正常生长。于2016年11月,随机挑选各个处理的3个植株测定其生物量:首先,分别称量植株地上部分和地下部分的鲜质量;然后,装入信封袋,放于烘箱(已预热)内,于100~105 ℃下杀青 10 min,待温度降至70~80 ℃时,烘干至恒质量,取出、冷却至室温并称干质量。同时,对植株株高、侧根数、最长侧根长等指标进行测量并记录数据。
1.2试验方法
1.2.1Ecl的分子鉴定
1.2.1.1Ecl系统进化分析在美国国立生物技术信息中心(National Center for Biotechnology Information,简称NCBI)进行BLAST同源查找,获得与Ecl同源的菌株,然后利用MEGA 5.0软件进行的多序列比对,构建系统发育树。
1.2.1.216S rDNA PCR扩增首先将细胞裂解液作为鉴定固氮菌属的PCR模板。取1个1.5 mL艾本德(Eppendorf)管,依次加入200 μL无菌水、一环新鲜的单菌落和0.5~1.0 mm 玻璃珠,混匀振荡3 min,沸水浴下放置10 min,冰浴下冷却30 min。随后,在预冷的离心机中,于4 ℃、11 000 r/min 下,离心1 min,吸取上清液,作为固氮菌属的PCR模板。采用片段大小为1 500 bp左右的16S rDNA通用引物(上海生物工程有限公司),正向引物为27f:5′-GAGATTTGATCCTGGCTCAG-3′,反向引物为1492r:5′-CTACGGCTACCTTGTTACGA-3′。采用表1、表2的体系和条件进行扩增克隆,循环数为35个(重复步骤2~4)。
重复表1、表2的PCR热循环扩增过程。采用1%琼脂糖凝胶电泳对PCR产物进行检测。取其4 μL PCR扩增产物和1 μL上样缓冲液(loading buffer)混合均匀后点样,设置电压110 V、电泳20 min,在凝胶成像分析仪系统下观察结果并保存。
1.2.1.3PCR回收产物与T载体连接
PCR回收产物与T载体连接操作遵从试剂盒的操作进行。在1.0 mL的离心管内,依次加入1.5 μL酶溶液(solution),4.5 μL回收产物,0.5 μL pMD18-T Vector(高效克隆PCR产物的专用载体),然后在37 ℃培养箱中连接。
1.2.1.4转化吸取连接产物10 μL于1.0 mL的离心管内,依次加入试剂A 20 μL、无菌水70 μL、大肠杆菌40 μL,冷冻30 min,室温放置20 min,加入LB液体培养基400 μL,于37 ℃培养箱内培养45 min,再在已预冷的离心机中于 7 000 r/min、4 ℃下离心2 min,去掉上清液。用枪头吹吸剩余沉淀使其均匀分布。均匀涂抹在LB培养基上,于37 ℃培养箱放置16~18 h,把单菌落挑取至含有Amp+的LB液体培养基。
1.2.1.5质粒提取按照提取质粒试剂盒的操作进行。采用1%琼脂糖凝胶电泳对PCR产物进行检测。
1.2.2土壤化学性质和酶活性的测定
用0.5 mol/L NaHCO3法、1 mol/L NH4OAc浸提法、碱解扩散法分别测定土壤速效磷、速效钾、碱解氮含量。用苯酸钠比色法、3,5-二硝基水杨酸比色法、磷酸苯二钠比色法分别测定脲酶、蔗糖酶、碱性磷酸酶活性。
1.3数据处理
所收集的数据用Excel 2016/SPSS 23.0软件统计处理,用ANOVA、Duncan s新复极差法方法进行单因素方差分析与显著性检验(α=0.05),数据均以“平均值±标准误”表示。
2结果与分析
2.1Ecl分子鉴定结果
16S rDNA PCR扩增产物如图1所示,片段大小约为 1 600 bp。在NCBI网站利用BLAST工具查找与Ec1同源性高的菌株,采用MEGA 6.06软件进行多序列比对并构建系统发育树(图2)。可知,与Ec1同源性较高的菌株有15株,其同源性均在98%以上,同源性最高为98.74%,菌株是Azotobacter tropicalis strain。细菌分类学家认定为当16S rDNA序列的同源性高于97%时,可断定是属内同种;同源性低于95%时,则断定为属外种。由此可断定Ec1属于自生固氮菌,加上16S rDNA序列鉴定以及扩增产物,可以断定Ec1为固氮菌属(Azotobacter)。这与Biolog的鉴定结果一致。
2.2Ecl对紫花苜蓿生长的影响
由表2可知,植株地上干质量、地下干质量、株高、侧根数、最长侧根长度、主根长度平均值的大小顺序均为处理D>处理B>处理C>处理A;灭菌后接种Ecl植株地上干质量比未接种的植株高83.43%;处理D、处理B与处理C、处理A的植株地上干质量存在显著性差异,说明无论土壤是否灭菌,加入Ecl对植株的地上干质量均有显著影响。
灭菌后接种Ecl植株地下干质量比未接种的植株高 91.02%。处理D、处理B与处理C、处理A的植株地下干质量存在显著性差异,说明无论土壤是否灭菌,加入Ecl对植株的地下干重均有显著影响。
灭菌后接种Ecl植株的株高比未接种的植株高74.08%。处理D的植株株高最高,且显著高于与其他处理;处理B次之,其株高显著高于未接种的处理C和A;说明无论土壤是否灭菌,加入Ecl对植株株高均有显著影响。
灭菌后接种Ecl植株的侧根数比未接种的植株多 56.70%。处理D、处理B与处理C、处理A植株侧根数存在显著性差异,说明无论土壤是否灭菌,加入Ecl对植株侧根数均有显著影响。
灭菌后接种Ecl植株的最长侧根长度比未接种的植株长,长46.77%。处理D、处理B与处理C、处理A植株侧根数存在显著性差异,说明无论土壤是否灭菌,加入Ecl对植株最长侧根长度均有显著影响。
灭菌后接种Ecl植株的主根长度比未接种的植株长,长48.54%。处理D、处理B与处理C、处理A植株侧根数存在显著性差异,说明无论土壤是否灭菌,加入Ecl对植株主根长度均有显著影响。
综上所述,接种高效固氮菌Ecl能够显著促进植株地下干质量、地上干质量、株高、侧根数、最长侧根长度、主根长度的增加,说明接种高效固氮菌促进了植株的生长发育。韩志顺等通过接种不同根瘤菌对紫花苜蓿固氮效能及生物量影响的研究表明,接种根瘤菌后,土壤中可供植株吸收的营养元素含量提高,植株生长得到促进,即菌株对干草增产效果明显[9]。员子晶等通过油松幼苗菌根优良磷钾细菌的筛选及对油松促生作用的研究表明,接种后土壤中酶活性提高,微生物运动活跃,有利于油松吸收营养,促进植株的伸长,即接种处理可以促进油松的生长[10],可见该菌对油松有促生效果。本试验中,促进植株生长的原因可能是接种高效固氮菌后土壤养分含量增高,进而使得土壤微生物代谢活跃,供植物所需的营养元素含量增加,植株的生长代谢得到促进。
2.3Ecl对土壤化学性质的影响
2.3.1对土壤碱解氮的影响
由图3可知,处理D(植株接菌)与处理C(植物未接菌)的土壤碱解氮含量分别为25.21、19.47 mg/kg,即接种植株比未接种植株的土壤碱解氮含量高29.48%。处理D、处理B的土壤碱解氮含量显著高于与其他处理,处理A、处理C显著高于CK。可知,土壤是否灭菌对土壤碱解氮含量无显著性影响。
2.3.2對土壤速效磷的影响
由图4可知,处理D与处理C的土壤速效磷含量分别为18.34、11.62 mg/kg,即接种植株比未接种植株的土壤速效磷含量增加57.83%。处理D、处理B的土壤速效磷含量显著高于与其他处理,处理A、处理C与CK的土壤速效磷含量差异不显著。说明土壤是否灭菌对土壤中速效磷含量无显著性影响。
2.3.3对土壤速效钾的影响
由图5可知,处理D与处理C的土壤速效钾含量分别为56.42、49.83 mg/kg,即接种植株比
未接种植株的土壤速效钾含量增加13.22%。处理D、处理B的土壤速效磷含量显著高于与其他处理,处理A、处理C与CK的土壤速效磷含量差异不显著。说明土壤是否灭菌对土壤中速效钾含量无显著性影响。
综上所述,接种高效固氮菌可以提高土壤养分含量。接种高效固氮菌后,土壤微生物运动活跃,土壤养分含量提高,本试验结果与叶少萍的研究结果[11]一致。
2.4Ecl对土壤酶活性的影响
土壤酶是一种具有特殊催化能力的蛋白质[12]。土壤内的任何化学反应都是在酶的参与下完成的,土壤酶活性可以体现土壤中所有生化反应进行的方向与强度,是土壤的属性之一[13]。
2.4.1对土壤蔗糖酶的影响
由图6可知,处理D与处理C的土壤蔗糖酶活性分别为0.082、0.052 mg/(g·d),即接种植株比未接种植株的土壤蔗糖酶活性提高0.03 mg/(g·d)。CK与其他处理差异显著,虽然处理A与处理B、处理D差异不显著,但处理B、处理D的蔗糖酶含量明显高于处理A,且处理B、处理D差异不显著,表明无论土壤是否灭菌,接种Ecl均可明显提高土壤蔗糖酶活性。处理A与处理C之间无显著差异性,说明土壤灭菌对蔗糖酶含量无显著性影响。
2.4.2对土壤脲酶的影响
由图7可知,处理D与处理C的土壤脲酶活性分别为7.35、3.40 μg/(g·h),即接种植株比未接种植株的土壤脲酶活性提高3.95 μg/(g·h)。处理B、处理D的土壤脲酶活性与其他处理均有显著性差异,表明无论土壤是否灭菌,接种Ecl均可显著提高土壤脲酶活性。处理A与处理C之间无差异,说明土壤是否灭菌对脲酶含量无显著性影响。
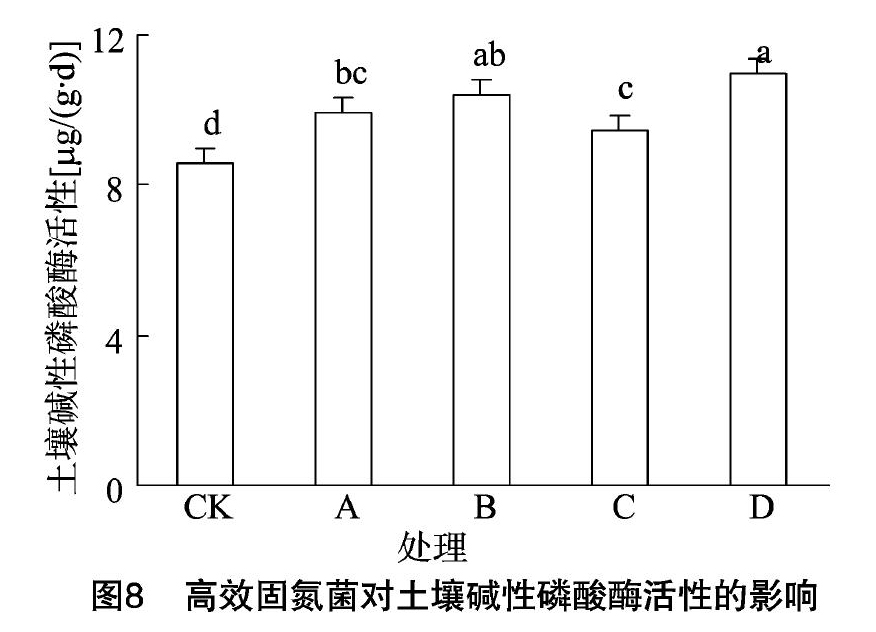
2.4.3对土壤磷酸酶的影响
由图8可知,处理D与处理C的土壤磷酸酶活性分别为10.98、9.48 μg/(g·h),即接种植株比未接种植株的土壤磷酸酶活性提高1.50 μg/(g·h)。CK的土壤磷酸酶活性均显著低于其他处理;处理C与处理B、处理D差异显著;处理A与处理D差异显著,与处理B差异不显著;但处理B、处理D的土壤磷酸酶活性明显高于处理A、处理C。说明无论土壤是否灭菌,接种Ecl均可明显提高土壤碱性磷酸酶活性。
接种高效固氮菌后,土壤微生物数量增加,土壤酶活性增强。一些研究表明,土壤微生物的种类和数量能在一定程度上反映土壤酶的活性,土壤微生物数量多,土壤酶活性高,土壤有效养分供给充足[14-15]。初佳芮研究了链霉菌769对大豆生长过程疫霉根腐病抗性及土壤微环境的影响,表明施用链霉菌769能提高土壤中脲酶、磷酸酶、蔗糖酶、过氧化氢酶等生物酶的活性,说明该菌可改善土壤微环境[16]。本试验结果与之相符。
2.5接菌植株生长、土壤化学性质与酶活性的相关性
由表5可知,接菌后的植株各生长指标之间均呈极显著正相关关系。植株生长指标与土壤养分含量之间呈正相关关系,其中碱解氮含量与地下干质量、侧根数呈显著正相关;速效磷与生长的各指标呈显著正相关;速效钾含量与地上干质量、地下干质量、最长侧根数呈显著正相关,与株高和主根长度呈极显著正相关。植株生长指标与土壤酶活性呈显著或极显著正相关,其中磷酸酶活性与各指标均呈极显著正相关;脲酶活性与株高、最長侧根数呈极显著正相关;蔗糖酶活性与最长侧根数、主根长度呈极显著正相关。磷酸酶活性与土壤速效钾质量、速效磷质量呈极显著正相关,土壤有机磷转化是多个因子共同作用的结果,磷酸酶参与转化过程可加速进程。土壤磷酸酶活性是评价磷素生物转化方向强度的指标之一。脲酶活性与土壤碱解氮含量呈极显著正相关,土壤脲酶属于水解酶,与氮素的转化过程有关。蔗糖酶活性与土壤速效磷呈极显著正相关。
3讨论与结论
本试验从铁尾矿中筛选1株Ecl并进行16S rDNA序列对比分析,结果表明,Ecl与Azotobacter tropicalis strain的同源性为98.74%,初步断定其为固氮菌属。
盆栽接种试验表明,与未接菌的处理相比,接种Ecl的紫花苜蓿植株地上干质量、地下干质量、株高、侧根数、最长侧根长度、主根长度均显著增加,可见接种高效固氮菌Ecl可以促进植株生长。其原因可能有以下几点:第一,植株接种菌株后,能有效地将土壤基质中的无效磷和氮转化成植株生长所需的必要元素P、N[17-18];第二,菌株可分泌细胞分裂素(CTK)、生长素等植物激素,这些激素通过影响植物代谢、呼吸机制,刺激植物根系生长发育,吸收营养物质来促进植株生长[19-20];第三,菌株可促进植物根系分泌质子,提高植物对矿质元素Fe的吸收,以此促进植物的生长[21-22];第四,菌株可以调节根系内酶活性、ATP等指标,增加植株活性,提高植株的增长[23];第五,菌株可改善盆栽基质微生态环境,接种菌后可定殖在植株根际,抑制有害微生物的入侵,保护植物免受其干扰[24-26]。以上5种Ecl哪个起到主导作用,有待进一步研究。
由土壤化学性质和酶活性的试验可知,与未接种的处理相比,接种高效固氮菌Ecl,土壤脲酶、碱性磷酸酶、蔗糖酶含量均明显增加,说明高效固氮菌对土壤活化有积极作用,该菌可在短时间内活化土壤,改善铁尾矿,因此,高效固氮菌Ecl对于铁尾矿的改良具有重要的意义。接种高效固氮菌Ecl,土壤碱解氮、速效磷、速效钾含量显著增加,土壤养分提高,可见接种高效固氮菌可有效改善铁尾矿基质中土壤的化学性质。此外,与直接施用化肥相比,接种高效固氮菌Ecl有对生态环境无污染、低消耗、低成本等特点,且该菌株能快速适应铁尾矿这种恶劣的环境。综上所述,利用植物与土壤微生物协同作用来进行铁尾矿修复的研究具有巨大的应用前景,引入微生物可以改善生态退化区的土壤基质,有助于科学有效地改良尾矿沙微生态环境,营造铁尾矿区人工林,,为铁尾矿废弃地的改良提供科学的理论指导。
参考文献:
[1]李敏. 铁尾矿土壤化利用过程中重金属污染的植物修复和土壤改良技术[D]. 济南:山东大学,2017.
[2]朱欣然. 铁矿尾矿资源开发利用经济分析[D]. 北京:中国地质大学,2010.
[3]李晓莹,徐学华,郭江,等. 不同造林树种对铁尾矿基质理化性质和土壤动物的影响[J]. 生态学报,2014,34(20):5746-5757.
[4]马云波,牛聪傑,许中旗. 人工与自然植被恢复下尾矿土壤微生物及酶活性的时空变化[J]. 林业科学,2016,52(6):93-1829.
[5]王艳超,李玉灵,王辉,等. 不同植被恢复模式对铁尾矿微生物和酶活性的影响[J]. 生态学杂志,2008,27(10):1826-1829.
[6]王艳超. 不同植被恢复模式下铁尾矿物种多样性、土壤养分及生物因子研究[D]. 保定:河北农业大学,2009.
[7]阎爱华,李雯,李玉灵. 不同自然定居植被对铁尾矿微生物数量、酶活性和生物多样性的影响[J]. 河北农业大学学报,2014,37(4):20-24.
[8]李雯,阎爱华,黄秋娴,等. 尾矿区不同植被恢复模式下高效固氮菌的筛选及Biolog鉴定[J]. 生态学报,2014,34(39):2329-2337.
[9]韩志顺,郑敏娜,梁秀芝. 接种不同根瘤菌对紫花苜蓿固氮效能及生物量的影响[J]. 华北农学报,2016,31(4):214-219.
[10]员子晶. 油松幼苗菌根围优良磷钾细菌的筛选及对油松的促生作用[D]. 呼和浩特:内蒙古农业大学,2011.
[11]叶少萍. 接种AM菌剂对意大利黑麦草根际影响及对后作水稻生长效应研究[D]. 广州:中山大学,2011.
[12]关松萌,张德生,张志明. 土壤酶及其研究法[M]. 北京:农业出版社,1986:14.
[13]周礼恺. 土壤酶学[M]. 北京:科学出版社,1987:116-122.
[14]许光辉,郑宏元,张德生,等. 长白山北坡自然保护区森林土壤微生物生态分布及其生化特性的研究[J]. 生态学报,1984,4(3):207-222.
[15]张培. 流溪河水库库区不同植被类型土壤化学与微生物学特性研究[D]. 武汉:华中农业大学,2008.
[16]初佳芮. 链霉菌769对大豆生长过程中疫霉根腐病抗性及土壤微环境的影响[D]. 长春:吉林农业大学,2015.
[17]范阳. 根际促生菌强化植物修复技术治理重金属污染[J]. 边疆经济与文化,2014(4):171-172.
[18]Adams P,Nelson D E,Yamada S,et al. Growth and development of Mesembryantheumumo crystallinum(Aizoaceae)[J]. New Phytologist,1998,138(2):171-190.
[19]Rasul G,Mirza M S,Latif F,et al. Identification of plant growth hormones produced by bacterial isolates from rice,wheat and kallar grass[M]// Malik K A,Mirza M S,Ladha J K. Nitrogen fixation with nonlegumes . Dordrecht:Springer,1998:25-37.
[20]劉佳莉. 植物根际促生细菌的筛选及其缓解紫花苜蓿盐碱胁迫的作用研究[D]. 哈尔滨:哈尔滨师范大学,2017.
[21]王明元. 丛枝菌根真菌对柑橘铁吸收的效应及其作用机理[D]. 武汉:华中农业大学,2008.
[22]Siebner-Freibach H,Hadar Y,Chen Y. Siderophores sorbed on Ca-montmorillonite as an iron source for plants[J]. Plant and Soil,2003,251(1):115-124.
[23]Arshad M,Frankenberger W T J. Plant growth- regulating substance in the rhizosphere:microbial production and function[J]. Advances in Agronomy,1998,62:145-151.
[24]杜立新,冯书亮,曹克强,等. 枯草芽孢杆菌BS-208和BS-209菌株在番茄叶面及土壤中定殖能力的研究[J]. 河北农业大学学报,2004,27(6):80-82.
[25]杨合同,陈凯,李纪顺,等. 重组巨大芽孢杆菌在小麦根际的定殖及其对植物真菌病害的防治效果[J]. 山东科学,2003,16(3):12-17.
[26]Kamilova F,Validov S,Azarova T,et al. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria[J]. Environmental Microbiology,2005,7(11):1809-1817.
- 会计电算化对会计实务的影响研究
- 大数据时代下的煤矿国企云会计应用
- 关于事业单位编制部门预算项目资金的若干思考
- 浅析云数据分析在经济统计中的应用
- 浅议医院移动支付内部控制建设
- 工业企业成本核算研究
- “营改增”对建筑施工企业的影响及措施研究
- 基于规划与土地价值利用的矿山环境治理探究
- 刍议煤炭企业全面预算管理现状及对策
- 技能大赛深化校企合作对高职会计专业人才培养的作用研究
- 内管干部经济责任审计存在的问题及对策
- 论平衡计分卡在我国的应用
- 试析信息技术工具对高校工商管理类课程的改造路径及选择
- 高校教师特征对学生评教影响的多因素方差分析
- 基于大数据对企业管理决策影响研究
- 以岗定薪:新体制带来的活力之变
- 浅谈竞争性谈判的心理“陷阱”及应对方法
- 廉洁风险防控体系在企业经营活动中的建设探析
- 新形势下企业管理创新的策略研究
- 基层电力企业党建工作着力点探讨
- 浅析以职工代表大会为基本形式的国有企业民主建设的发展路径
- 我国环境管理体制中存在的问题及其解决途径
- 企业内部岗位价值评估与实施方法
- 论电力工程项目内控管理
- 结合电气工程及其自动化剖析机器人设计
- be cruel to
- be crying out for
- be cured
- be cut off/down in your prime
- be cut out for
- be cut out for sth; be cut out to be sth
- bed
- b.ed.
- bedandbreakfast
- bed and breakfast
- bed and breakfasts
- be daylight robbery
- bedclothes
- bedcovers
- bedded
- bedded-down
- bedding
- bedding-down
- beddings
- bed-down
- bed down
- be dead in the water
- be dead on your feet/be ready to drop
- be dead to the world
- be/deal a blow to
- 天字一号
- 天字教
- 天字第一号
- 天孙
- 天孙云锦
- 天孤
- 天宇
- 天安门
- 天安门事件
- 天安门前的石狮子——明摆着
- 天安门广场
- 天宗
- 天官
- 天官景从
- 天官赐福
- 天定
- 天定的缘分
- 天宝
- 天宝地珍
- 天宝当年
- 天宪
- 天宪口衔
- 天宫
- 天宫失了火——人难救
- 天害