兰家萍 赵详 刘鸯 杨美玲 王绍明

摘要:以滴灌和大水漫灌2种不同灌溉方式下红花根际土和非根际土为研究对象,采用Biolog-ECO微平板检测法对土壤微生物群落功能多样性进行研究。结果显示,2种不同灌溉方式下红花根际土含水率以及全氮、全钾、全磷、有机质、碱解氮、速效钾、速效磷含量均高于非根际土壤,而电导率、pH值则低于非根际土,滴灌下红花根际土中大部分理化因子的含量大于大水漫灌;滴灌下的过氧化氢酶、碱性磷酸酶、纤维素酶活性显著高于大水漫灌;滴灌下平均颜色变化率(AWCD)、香农多样性指数(H)、丰富度指数均整体高于大水漫灌。说明滴灌有助于改善微生物的生存环境,提高土壤微生物群落功能多样性,进而增强应对外界环境影响的能力。
关键词:新疆栽培红花;微生物功能多样性;滴灌;大水灌溉
中图分类号: S154.3? 文献标志码: A? 文章编号:1002-1302(2019)10-0301-04
红花(Carthamus tinctorius L.)别称草红花和菊红花,是菊科红花属中唯一的栽培品种,是菊科植物的干燥管状花,属于双子叶植物,为一年或两年生草本植物。在我国,红花是一种传统的药材,同时是集饲料、油料、染料等多种功能为一体的重要经济作物,有著广阔的开发前景[1]。红花喜温暖干燥、土壤排水性能好的生态环境,具有耐寒、耐旱、耐盐碱等特性,同时其对土壤的肥力要求也不是特别高,因此栽培管理比较简便。目前红花已被广泛栽种于全球范围内,调查结果显示,我国4个主要的红花产地分别为新疆吉木萨尔、河南新乡、四川简阳、云南巍山。其中,新疆占据我国红花栽培面积和产量的第1位,种植区主要分布于吉木萨尔、伊利、塔城、呼图壁等地。新疆是我国红花的主要产区,产量约占全国的80%,被誉为“中国红花之乡”[2]。干红花远销全国各个省份,并有部分出口国外。红花以其较高的经济和药用价值受到国内外研究者的关注[3]。迄今为止,研究发现,红花中主要含有黄酮醇及其苷类、查耳酮类、链烷双烯醇类、脂肪酸类、聚炔类、甾体类等成分。然而,目前对于红花的研究主要集中在其药理、化学成分、种质资源保存、遗传多样性、品种选育、高效栽培管理技术以及防病防害等方面,近年来,对红花土壤根区微生物群落多样性的研究逐渐增多。郭欢等研究发现,丛枝菌根(arbuscular mycorrhiza,AM)从时间和空间上影响红花根围微生物的多样性[4]。
目前在全球范围内,干旱或水资源短缺已经成为限制作物产量的主要因素之一,随着经济和社会的发展以及全球气候变暖的加剧,干旱缺水形势日益严峻[5]。新疆昌吉州吉木萨尔县位于新疆维吾尔自治区天山北麓东端,为红花的主要产地之一,该地区干旱缺水,水资源短缺成为土地开发利用的主要限制因素之一[6]。由于技术落后、资金短缺等方面原因,传统落后的大水漫灌一直沿用至今。但是,随着水资源紧缺与需水量逐年增加之间矛盾的日益加剧,大水漫灌正在逐渐被现代化节水模式所取代。随着我国节水灌溉技术的普及和发展,近几年,滴灌在我国逐渐被重视并得到了前所未有的推广。滴灌不仅是干旱缺水地区一种有效利用水资源的灌溉方式,同时也是现代化农业技术措施的有效载体。滴灌能够遵从作物耗水规律,均匀缓慢、适时适量地供水,使作物根层土壤保持最佳的水分含量、通气状态、养分含量等,为作物生长发育创造良好的环境[7]。20世纪以来,人们认识到不同植物之间和相同植物不同品种之间存在水分利用效率差异。为此,进行滴灌和大水漫灌2种不同灌溉方式下新疆栽培红花根区微生物功能多样性研究,以期为提高红花产量和优化栽培管理措施提供一定的理论参考依据。
土壤微生物群落对土壤中的物质和能量循环发挥着至关重要的作用,是土壤生态系统中最为活跃的部分[8],90%左右的土壤反应过程都有微生物的参与[9-10]。根际是一个由根系分泌物输入高能量而使得微生物剧烈活动的生态系统,同时是植物和微生物进行物质与能量交流较活跃的土壤微区,也是近年来国内外土壤微生物研究的热点[11]。根际土壤微生物可以影响土壤营养的分解、转化以及植物对营养物质的吸收利用,是衡量土壤肥力和养分含量的重要指标。各级土壤微生物群落结构与作物产量密切相关,微生物种群结构失衡是导致药用作物发病和减产的主要原因之一[1]。土壤微生物多样性对土壤生态系统的结构和功能有一定的影响,参与维持土壤生产力,是评价土壤质量的重要参考指标之一。研究作物与其根际土壤微生物多样性之间的关系,对进一步了解作物品种遗传性、土壤适应性和制定栽培管理方案具有重要参考意义。
Garland等首次采用Biolog微孔板对微生物群落功能多样性进行描述[12],此后该技术被广泛用于评价环境微生物群落功能多样性[13]。目前Biolog技术已被广泛应用于对土壤微生物群落功能多样性的评价,例如比较不同土壤类型、同类土壤不同植物物种根际、不同植被根际土壤微生物群落的功能多样性。
本研究采用Biolog-ECO微平板检测法,以滴灌和大水漫灌2种不同灌溉方式下栽培红花根际土和非根际土为研究对象,探讨2种不同灌溉方式下红花分区微生物的多样性。
1 研究区概况
研究区位于新疆昌吉州吉木萨尔县北庭镇农六师红旗农场分厂一连,该区位于新疆维吾尔自治区天山北麓东端,准噶尔盆地东南缘(88°30′~89°30′E,43°30′~45°30′N)。属温带大陆性气候,冬季长而严寒,夏季短而炎热,春秋季节不明显,干旱且降水量少,昼夜温差大。年平均气温为7.0 ℃,年平均日照时数为2 861.1 h。
2 研究方法
2.1 样品采集
灌溉方式为滴灌、大水漫灌,以2016年6月在新疆昌吉州吉木萨尔县北庭镇红旗农场随机选取的长势、株丛大小等相似的红花地作为样地。在样地内设置3个5 m×5 m的样方,在每个样方内随机选取5~10株植株作为样本,在植株根处挖取与根系深度(约为20 cm)相同的土壤剖面(注意采集植物根系土壤时要小心地进行),剔除植物残根、石砾以及周围的杂土,将完整的根系装入无菌封口袋内,迅速带回实验室,将根系上剥离的土(控制在根系周围1.0~2.5 mm以内)作为根际土壤样品;同时在每个样方内采集与植株根系等深度的外围土壤并进行混合。根际土壤样品与其外围土壤样品均放入4 ℃冰箱内保存,用于土壤理化性质、微生物功能多样性分析[14]。将试验中用到的土壤分别命名为滴灌红花根际土(DG)、滴灌红花非根际土(DF)、大水漫灌红花根际土(SG)、大水漫灌红花非根际土(SF)。
2.2 土壤理化性质的测定
土壤含水率采用烘干法测定;电导率采用电导法测定;土壤中有机质含量的测定采用重铬酸钾容量法-外加热法;土壤全氮含量的測定采用半微量凯氏法;碱解氮含量的测定采用碱解扩散法;全磷含量的测定采用酸溶-钼锑抗比色法;速效磷含量的测定采用NaHCO3浸提-钼锑抗比色法;全钾含量的测定采用HF-HClO4消煮-火焰光度计法;速效钾含量的测定采用乙酸铵浸提-火焰光度计法;土壤pH值测定时的水土体积比为2.5 ∶ 1.0[15]。
2.3 土壤中酶活性的测定
土壤蔗糖酶、纤维素酶活性的测定采用3,5-二硝基水杨酸比色法;脲酶活性的测定采用苯酚钠比色法;过氧化氢酶活性的测定采用高锰酸钾滴定容量法;碱性磷酸酶活性采用磷酸苯二钠比色法测定。
2.4 土壤微生物功能多样性Biolog测定
本试验采用Biolog-ECO微平板检测法(Biolog-ECO Plate TM)进行土壤微生物活性和功能多样性测定。每个Biolog-ECO板内包含96个小孔,设3次重复,每组重复含1个对照和31种碳源[16]。
将Biolog-ECO平板(BIOLOG公司)从冰箱中取出,预热至25 ℃,称取相当于10 g干质量的鲜土,将其加入到装有90 mL无菌NaCl溶液(质量浓度为0.85%)的三角瓶中,封口后在170 r/min摇床上振荡15 min,静置10 min后,取上清,将土壤溶液按10倍梯度依次稀释至10-3稀释度,用8道移液器取150 μL土壤溶液稀释液分别加入Biolog-ECO平板的微孔中。最后将接种好的微孔板置于25 ℃恒温培养箱中避光培养168 h,每隔12 h在Biolog-ECO Plate TM读盘机上用Biolog Reader 4.2软件读取590 nm波长下的吸光度(D590 nm)[17]。
2.5 数据分析
培养72 h的土壤微生物处于代谢旺盛期,因此将该培养条件下的数据用于土壤微生物碳源利用分析和主成分分析。
(1)Biolog-ECO平板上每个微孔的平均颜色变化率(AWCD)可用于表示微生物种群碳源代谢强度,是反映土壤微生物活性及功能多样性的一个重要指标[18],计算公式如下:
式中:Ci表示Biolog-ECO平板上每个微孔在590 nm波长下的光密度值;R表示空白微孔Ai的光密度值,其中Ci-R小于0.06的数值按0处理;31表示Biolog-ECO平板上碳源的种类数为31。
(2)微生物多样性指数(H)采用Shannon-Wiener指数法计算,用于评估物种的丰富度,称为香农多样性指数(H),计算公式[13]如下:
式中:pi为第i孔相对吸光度与整个平板相对吸光度总和的比率;pi=(Ci-Ri)/∑(Ci-Ri),Ri为对照孔的吸光度。
(3)微生物均匀度指数(E),计算公式如下:
式中:S为Biolog-ECO平板上有颜色变化的孔数。
(4)微生物优势度指数(D)用于评估某些最常见种的优势度,计算公式如下:
D=1-∑pi2。
(5)丰富度指数(S):微生物群落利用碳源种类的数目,即Biolog-ECO平板上有颜色变化的孔数。
所有数据的计算与处理采用Microsoft Excel 2007软件,差异显著性分析采用SPSS 19.0软件,画图采用Microsoft Excel 2007和Origin 8.5软件。
3 结果与分析
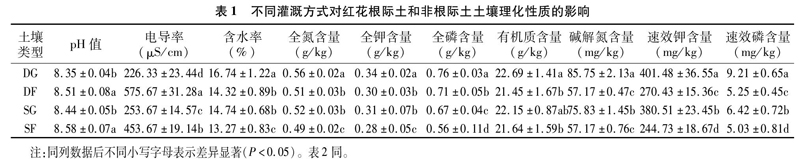
3.1 不同灌溉方式下栽培红花根区土壤理化性质的比较
从表1可以看出,滴灌下红花根际土的电导率、pH值比非根际土低349.34 μS/cm、0.16,根际土含水率及全氮、全钾、全磷、有机质、碱解氮、速效钾、速效磷含量均高于非根际土;大水漫灌红花根际土pH值、电导率低于非根际土,含水率及全氮、全钾、全磷、有机质、碱解氮、速效钾、速效磷含量均高于非根际土。滴灌方式下的根际土土壤理化性质指标除
pH值和电导率外均大于大水漫灌方式。
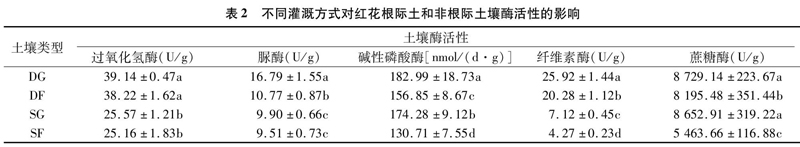
3.2 不同灌溉方式下栽培红花根区土壤中酶活性比较
从表2可以看出,滴灌、大水漫灌红花根际土过氧化氢酶活性与非根际土没有显著性差异,但滴灌下的过氧化氢酶活性显著高于大水漫灌。大水漫灌红花根际土的脲酶活性与非根际土没有显著性差异,而滴灌红花根际土的脲酶活性显著大于非根际土。滴灌红花根际土的碱性磷酸酶和纤维素酶活性显著高于非根际土,大水漫灌也有类似的结果,且滴灌下的纤维素酶活性显著高于大水灌溉。滴灌、大水漫灌红花根际土蔗糖酶活性不存在显著性差异,但2种灌溉方式下红花根际土蔗糖酶活性均显著高于非根际土,其中大水漫灌下红花根际土的蔗糖酶活性约是非根际土的1.6倍。
3.3 不同灌溉方式下栽培红花根区微生物的AWCD比较
AWCD是反映土壤微生物对总体碳源利用效率的指标,在一定程度上能够体现土壤微生物种群的数量和结构特征[19]。培养开始后,每隔12 h测定1次AWCD,得到AWCD随时间的动态变化趋势。由图1可知,从接种到培养36 h,滴灌、大水漫灌红花根际土、非根际土的AWCD均没有明显的变化,对碳源的利用能力整体随时间的延长而增强。随着培养时间的延长,4种不同土壤样品中的土壤微生物群落的AWCD均整体呈增长趋势,其中滴灌红花根际土微生物群落的AWCD升高得最快,其非根际土的AWCD次之,而大水漫灌红花根际土和非根际土的土壤微生物群落AWCD变化趋势相近,较滴灌方式缓慢,表明滴灌方式下红花根区土壤微生物活性较大水灌溉方式下高。
3.4 不同灌溉方式下栽培红花根区土壤微生物群落功能多样性的比较
土壤微生物群落功能多样性是表示土壤微生物群落状态与功能的指标,反映了土壤微生物的生态特征。香农多样性指数(H)、均匀度指数(E)、优势度指数(D)和丰富度指数(S)等可以从不同的方面反映土壤微生物群落功能多样性,均为应用较为广泛的群落多样性指数。表3中列出了2种不同灌溉方式下红花根际土、非根际土在培养72 h后所利用碳源的多样性指数。
从表3可以看出,滴灌、大水漫灌红花根际土的微生物香农多样性指数高于非根际土;滴灌条件下根际土的微生物香农多样性指数高于大水漫灌条件下。微生物均匀度指数表现为滴灌红花非根际土(DF)>大水漫灌红花根际土(SG)>大水漫灌红花非根际土(SF)>滴灌红花根际土(DG)。微生物丰富度指数均表现为滴灌红花根际土(DG)>大水漫灌红花根际土(SG)>滴灌红花非根际土(DF)>大水漫灌红花非根际土(SF)。2种灌溉方式下微生物优势度指数无明显差异,但根际土的微生物优势度指数均低于非根际土。
4 结论与讨论
土壤微生物群落在土壤生态系统中发挥着关键作用,例如在地球化学循环及能量流动、土壤肥力演变、土壤有机质的代谢等方面都起着重要作用。根际是植物和微生物进行物质和能量交流的活跃土壤区域,植物根际及微生物组成了一个微生态系统,根际微生物可以影响土壤营养物质的分解和转化、植物根系对土壤营养物质的分解和转化、植物根系对土壤营养物质的吸收利用,其多样性是衡量土壤肥力和养分的一个重要指标[20]。徐鸿斌等的研究结果显示,红花根际土壤微生物磷脂脂肪酶生物标记组成丰富,且不同基因型的拟南芥之间根际微生物群落差异显著[20]。彭振宝等的研究结果表明,根际土壤微生物对于农药甲拌磷的污染干扰能力强于非根际土壤[21]。研究根际土壤微生物种群结构和功能,对于了解农作物生态系统的活动性和稳定性十分重要。
土壤微生物与红花的生长密切相关,目前人们对红花的研究多集中在其药理或栽培技术等方面,而对红花微生物的研究相对较少。陆爽等对新疆栽培红花不同生长期的土壤微生物群落结构进行研究,结果发现,微生物总数由大到小依次为伸长期、种子成熟期、莲座期、花期[22]。郭欢等研究了水肥处理对红花根际化学计量特征的影响,结果显示,施肥对土壤中主要营养元素如C、N、P等的含量有提高作用,合理有效的水肥管理對土壤养分的提高有着显著意义[4]。罗丽朦等以扁穗冰草为研究对象,分析比较其根鞘土壤和周围环境土壤的理化性质,结果发现,根鞘土壤的有机质、全氮、速效氮、速效钾含量均高于周围环境土壤[23]。
本研究结果表明,无论是在滴灌还是大水漫灌方式下,根际土的含水率高于非根际土,这有助于确保红花生长环境中土壤养分的有效性;根际土中有机质、全氮、速效钾、全磷、速效磷含量均高于非根际土,说明根际土中植物生长的必要养分含量高于非根际土,能够更有效地发挥其保持土壤养分和肥力的功能,这一点与徐鸿斌等的研究结果[20]是一致的。而关于植物根际及土壤微生物组成的特殊微生态系统中复杂的关系,还需要进一步研究。
Biolog技术通过测定微生物对不同碳源利用程度来表征其代谢活性及其功能多样性,通过AWCD值来表示微生物群落对碳源的代谢能力,且AWCD值可作为土壤微生物活性的有效指标。采用香农多样性指数及均匀度指数表示群落的丰富度,其值越大说明群落多样性越高。植物根系的代谢活动能为微生物提供多种营养物质和稳定的生长条件,且对土壤微生物群落的生长与代谢具有激活作用[16]。微生物群落多样性指数可综合性体现物种的均匀度和丰富度,多样性指数的变化可以反映微生物群落功能多样性的变化,然而选择分析的多样性指数不同,得出的试验结果也会有所差异。
本研究中,AWCD在培养的36 h内无明显变化,在0~36 h 微生物处于适应期阶段,在36 h之后,微生物逐渐进入对数增长期,并在72 h后基本进入稳定期,不同土壤样品的AWCD随时间的变化曲线基本呈近S型,这符合微生物利用基质生长的一般规律。在36~72 h范围内,AWCD呈现上升趋势,说明在培养的36~72 h内微生物对碳源的利用能力强,代谢活性高。在不同的灌溉方式下,根际土的AWCD均整体高于非根际土,说明根际土中较高的有机质含量可以提高土壤微生物群落的代谢活性。微生物丰富度指数表现为滴灌红花根际土>大水漫灌红花根际土>滴灌红花非根际土>大水漫灌红花非根际土,表明植物根际土的微生物丰富度高于非根际土,说明植物根际土微生物群落的多样性较高[14]。
新疆是我国红花的主产区之一,种植面积占全国的60%以上,产量已占全国总产量的80%。其干爽的气候,丰富的光热资源,较大的昼夜温差,为红花的生长栽培提供了非常适宜的条件,红花已成为新疆塔城地区、兵团农六师等地的支柱产业之一。然而,新疆的红花栽培也不断面临着新的问题,部分红花品种在长期的栽培过程中不断退化,并且长期的粗放栽培管理以及缺乏科学规划的灌溉和施肥等,造成红花生长受到胁迫,降低了红花药材质量。谭勇等对不同栽培方式下的红花产量和品质进行了研究,结果发现,滴灌栽培条件下红花的产量较高[3]。
本研究比较2种灌溉方式下红花根际土和非根际土的微生物群落多样性,结果发现,不论是根际土还是非根际土,在滴灌下土壤全氮、全钾、速效钾、全磷、速效磷含量均高于大水漫灌灌溉方式,说明滴灌下土壤中植物生长的必要养分含量高于大水漫灌,可以更有效地发挥其保持土壤养分和肥力的功能。同时AWCD、丰富度指数在滴灌方式下均整体较大水灌溉高。表明滴灌下红花的有机质含量、根区土壤微生物功能多样性大部分高于大水漫灌条件下,这与已有的研究结果[22]一致。
总之,根际是植物和微生物进行物质和能量交流的活跃土壤区域,根际微生物较非根际微生物更能影响土壤肥力、微生物功能多样性。与大水漫灌相比,滴灌可以提高根际土壤有机质含量,改善微生物的生存环境,提高土壤微生物群落功能多样性,进而增强应对外界环境影响的能力。
参考文献:
[1]徐鸿斌,王绍明,蒋 静,等. 新疆栽培红花根际土壤微生物群落磷脂脂肪酸生物标记多样性分析[J]. 江苏农业科学,2014,42(12):364-368,441.
[2]朱明娟. 新疆红花的研究进展及发展前景[J]. 科技信息(科学教研),2008(25):40,47.
[3]谭 勇,王 恒,高宝博,等. 不同栽培方式对红花产量和品质的影响[J]. 中国林副特产,2011(2):4-6.
[4]郭 欢,曾广萍,刘红玲,等. 丛枝菌根真菌对红花根围微生物多样性特征的影响[J]. 微生物学通报,2013,40(7):1214-1224.
[5]董宝娣,师长海,乔匀周,等. 不同灌溉条件下不同类型冬小麦产量水分利用效率差异原因分析[J]. 中国生态农业学报,2011,19(5):1096-1103.
[6]王真真,李 宏,苗乾乾,等. 坐果期不同灌溉条件下枣树光合特性研究[J]. 中南林业科技大学学报,2015,35(5):59-63,69.
[7]贺 伟. 不同灌溉方式对燕麦光合及土壤生物特性的影响[D]. 呼和浩特:内蒙古农业大学,2013.
[8]Coleman D C,Crossley D A,Hendrix P F,et al. Fundamentals of soil ecology[M]. London:Academic Press,1996:48-77.
[9]Konopka A,Oliver L,Turco R F,et al. The use of carbon substrate utilization patterns in environmental and ecological microbiology[J]. Microbial Ecology,1998,35(2):103-115.
[10]Pankhurst C E,Ophel-Keller K,Doube B M,et al. Biodiversity of soil microbial communities in agricultural systems[J]. Biodiversity and Conservation,1996,5(2):197-209.
[11]Cocking E C. Endophytic colonization of plant roots by nitrogen-fixing bacteria[J]. Plant and Soil,2003,252(1):169-175.
[12]Garland J L,Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology,1991,57(8):2351-2359.
[13]王文鹏,毛如志,陈建斌,等. 种植方式对玉米不同生长期土壤微生物群落功能多样性的影响[J]. 中国生态农业学报,2015,23(10):1293-1301.
[14]任美霖,王绍明,张 霞,等. 准噶尔盆地南缘两种典型禾本科植物根鞘土壤微生物群落功能多样性[J]. 生态学报,2017,37(17):5630-5639.
[15]乔胜英. 土壤理化性质实验指导书[M]. 武汉:中国地质大学出版社,2012:20-72.
[16]郑丽萍,龙 涛,林玉锁,等. Biolog-ECO解析有机氯农药污染场地土壤微生物群落功能多样性特征[J]. 应用与环境生物学报,2013,19(5):759-765.
[17]李忠佩,吴晓晨,陈碧云. 不同利用方式下土壤有機碳转化及微生物群落功能多样性变化[J]. 中国农业科学,2007,40(8):1712-1721.
[18]党 雯,郜春花,张 强,等. Biolog法测定土壤微生物群落功能多样性预处理方法的筛选[J]. 中国农学通报,2015,31(2):153-158.
[19]董 艳,董 坤,汤 利,等. 小麦蚕豆间作对蚕豆根际微生物群落功能多样性的影响及其与蚕豆枯萎病发生的关系[J]. 生态学报,2013,33(23):7445-7454.
[20]徐鸿斌,王绍明,赵维奇,等. 红花根际微生物群落磷脂脂肪酸(PLFAs)特征分析[J]. 新疆农业科学,2015,52(1):72-78.
[21]彭振宝,赵思峰,危常州,等. 甲拌磷残留对加工番茄根际与非根际微生物活性的影响[J]. 石河子大学学报(自然科学版),2010,28(3):303-309.
[22]陆 爽,张 霞,谭 勇,等. 栽培红花生长期土壤微生物与土壤理化因子动态[J]. 草业科学,2011,28(12):2084-2091.
[23]罗丽朦,王 瑾,王丽学,等. 扁穗冰草根鞘与其环境土壤理化性质和微生物数量的比较[J]. 草地学报,2013,21(6):1109-1112.
- 浅谈10kV及以下电网建设工程概预算管理系统的开发与应用
- 电力系统安全角度下的变电检修技术研究
- 配电自动化终端设备在电力配网自动化的应用探讨
- 试析水利水电施工中机电安装出现的问题及对策
- 水利水电工程施工质量全过程控制分析
- 试论电缆敷设技术在10kV电力配电工程中的应用分析
- 浅谈智能配电网自愈控制技术
- 数据挖掘技术在电网运营监控平台建设中的应用
- 锅炉过热器管子变形乱排原因分析及解决方案
- 电厂热工控制系统应用中的抗干扰技术分析
- 电力工程高压输电线路的施工管理及质量控制
- 浅谈10kV配网电力工程的质量、安全、进度管理
- 火电厂锅炉金属氧化皮剥落问题及防范措施研究
- 城市配网自动化与配网规划分析
- 电力领域语义搜索系统的构建方法
- 10kV线路过电压保护器运维及故障原因的分析
- 大运行背景下电网调控运行安全风险管理探讨
- 10kV配电设备运行与检修管理的研究
- 电力系统中PLC自动化装备常见问题及维护探讨
- 火电厂汽轮机组节能措施研究与应用
- 10kV配网电力电缆运行有效管理模式的分析
- 10kV配电线路线损因素与降损方案分析
- 如何加强电网调控运行安全风险管控分析
- 变电站电气自动化控制系统分析及其应用
- 中川机场一次风切变天气成因分析
- seˌlective distribution
- seˌlective perception
- seˌquential sampling
- sfa
- sgd
- sgml
- sgt
- sgt.
- sh
- shabbier
- shabbiest
- shabbily
- shabbiness
- shabbinesses
- shabby
- shabbyish
- shack
- shacked
- snore
- snored
- snoreless
- snorer
- snorers
- snores
- snoring
- 抱团儿
- 抱在怀里
- 抱在怀里的西瓜
- 抱大腿
- 抱头
- 抱头大哭
- 抱头痛哭
- 抱头缩项
- 抱头鼠窜
- 抱奇怀能
- 抱奶奶经
- 抱委屈
- 抱子
- 抱子弄孙
- 抱孙弄子
- 抱学
- 抱孩子进当铺——把人不当人
- 抱孩子进当铺(抱木偶打狗)——拿人不当人
- 抱定
- 抱宝怀珍
- 抱屈
- 抱屈含冤
- 抱屈衔冤
- 抱山公路
- 抱布