李凤 刘芸芸 李爱峰 孙爱玲 柳仁民
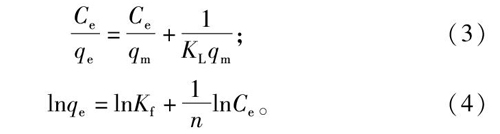

摘要:拟研究大孔吸附树脂纯化大黄中游离蒽醌的最佳工艺。先以大黄中总游离蒽醌和苯乙烯酸的静态吸附率和解吸率为指标,对6种不同型号的大孔吸附树脂进行筛选,然后通过静态和动态吸附解吸试验优化纯化工艺。结果表明,HPD-400型大孔吸附树脂对大黄中游离蒽醌和苯乙烯酸的吸附与解吸性能较好,且其吸附等温线方程较符合Langmuir模型;确定最佳吸附条件如下:pH值4.5,上样液浓度4 mg/mL,最大上样量7 BV;最佳洗脱条件如下:先用70 BV的0.2 mol/L NaHCO3溶液从大黄中分离出苯乙烯酸及杂质,再用15 BV的95%乙醇洗脱游离蒽醌;总游离蒽醌纯度由41.17%提高到了82.60%。HPD-400型大孔吸附树脂可以有效纯化大黄游离蒽醌。
关键词:大黄;游离蒽醌;大孔吸附树脂;纯化;Langmuir模型
中图分类号: R284.2文献标志码: A
文章编号:1002-1302(2019)19-0203-06
收稿日期:2018-07-10
基金项目:国家自然科学基金(编号:21675071);山东省重点研发计划(编号:2016GSF202007)。
作者简介:李 凤(1990—),女,山东菏泽人,硕士研究生,主要从事药物分离与分析研究。E-mail:lifeng8129@163.com。
通信作者:柳仁民,博士,教授,主要从事药物分离与分析研究。E-mail:renminliu@126.com。
大黄(Radix et Rhizoma Rhei)为临床常用的传统中药,具有清热退火、活血化瘀、减肥降脂等功效[1-2]。现代药理学研究表明,大黄具有保肝、利胆、抗肿瘤、免疫调节等功能[3]。大黄的主要药用成分为蒽醌类衍生物,分为游离型蒽醌和结合型蒽醌,游离型蒽醌主要有大黄酸、大黄素、大黄酚、芦荟大黄素、大黄素甲醚[4-5];结合型蒽醌有番泻苷A、B、C、D及大黄酸-8-葡萄糖苷、大黄素葡萄糖苷等[4-5]。
近年来,大孔吸附树脂的应用越来越广泛,尤其是在天然产物有效成分分离方面,它具有分离纯化效果优良的应用特点[6-8]。目前,国内利用大孔吸附树脂对大黄成分的研究主要集中在对总蒽醌的纯化,方法是使用大孔吸附树脂以不同浓度的乙醇進行洗脱[9-10],但以大孔吸附树脂用NaHCO3除去大黄中的苯乙烯酸和杂质进而纯化蒽醌类化合物的研究尚未见报道。本研究采用无水乙醚和20%硫酸水溶液混合液(体积比1 ∶5)回流提取,以HPD-400型大孔吸附树脂使用NaHCO3溶液就可以将杂质以及苯乙烯酸分离出来,然后用95%乙醇纯化得到高纯度的总蒽醌类化合物。采用高效液相色谱法同时测定其中的苯乙烯酸和5种蒽醌类物质的峰面积,从而对其进行定量分析。
1 材料与方法
1.1 试验材料
粗提物制备及大孔吸附树脂分离纯化所用的溶剂均为分析纯,购自烟台远东精细化工有限公司;所用试剂NaHCO3、Na2CO3、NaOH为分析纯,购自天津市风船化学试剂科技有限公司;HPLC(高效液相色谱法)分析用的甲醇为色谱纯,购自美国TEDIA试剂公司;试验用水为娃哈哈纯净水。ADS-7型、HPD-500型、HPD-826型、HPD-400型、HPD-100型和AB-8型大孔吸附树脂,购自沧州恩宝化工有限公司。大黄药材购于聊城利民大药店总店,经山东中医药大学张永清教授鉴定为正品药材。
1.2 试验仪器
Thermo UitiMate 3000高效液相色谱仪,美国戴安公司;色谱柱SPHERIGEL ODS C18(250 mm×4.6 mm ID,5 μm),大连江申分离科学技术公司;RE-3000旋转蒸发仪,上海亚荣生化仪器厂;THZ-82水浴恒温振荡器,金坛市杰瑞尔电器有限公司。
1.3 分析方法
采用高效液相色谱仪测定目标成分的峰面积进行定量分析(成分的峰面积与浓度呈线性关系)。SPHERIGEL ODS C18色谱柱(250 mm×4.6 mm ID,5 μm),流动相使用甲醇-水(含0.1%磷酸)梯度洗脱(甲醇0~30 min,65%~85%;30~50 min,85%~95%),流速为1.0 mL/min,检测波长为 254 nm,柱温为25 ℃,进样量为15 μL。
1.4 大黄提取物溶液的制备
称取约200 g大黄药材,经高速药物粉碎机粉碎至约40目,采用无水乙醚和20%硫酸水溶液混合液(体积比1 ∶5)回流提取3次,每次1.5 h,料液比为1 g ∶6 mL,合并乙醚回流提取液,浓缩得浸膏,冷藏备用。
1.5 大孔吸附树脂型号的筛选
1.5.1 大孔树脂的预处理
新购的大孔树脂用95%乙醇浸泡24 h,装玻璃层析柱。先用乙醇洗脱至洗脱液加水不出现混浊,接着用去离子水洗至洗脱液无乙醇味,备用。
1.5.2 静态吸附解吸性能的比较
因为成分的峰面积与浓度呈线性关系,因此对6个目标成分的峰面积进行定量分析。大孔树脂吸附率和解吸率的计算公式如下:
吸附率=(原液的总峰面积-吸附后药液的总峰面积)/原液的总峰面积×100%;(1)
解吸率=解吸后药液的总峰面积/(原液的总峰面积-吸附后药液的总峰面积)×100%。(2)
准确称取经预处理的6种型号的大孔树脂:ADS-7型、HPD-500型、HPD-826型、HPD-400型、HPD-100型和AB-8型各5 g,分别装入100 mL具塞磨口三角瓶中,各加入相同浓度的大黄提取物溶液50 mL。置于水浴恒温振荡器上,30 ℃恒温振荡12 h,分别取吸附后的溶液,用高效液相色谱仪检测。经计算得到各树脂对6个目标成分的吸附量和吸附率。分别取上述吸附饱和的树脂,各加入95%乙醇 50 mL,用与吸附试验同样的条件进行解吸12 h。解吸完全后,取解吸液用高效液相色谱仪检测。经计算得到各树脂对6个目标成分的解吸率。
1.6 静态吸附解吸工艺的考察
1.6.1 静态吸附pH值的考察
准确称取7份预处理过的HPD-400型大孔樹脂各5 g,分别加入含药量相同的pH值分别为1、3、4.5、6.5、8.5、10.5、11.5的溶液50 mL进行静态吸附。
1.6.2 吸附动力学的考察
准确称取经预处理过的HPD-400型大孔树脂10 g,加入大黄提取物溶液100 mL,按在“1.6.1”节中确立的最佳pH值下进行静态吸附,每隔30 min取样1 mL,用HPLC进行分析检测。
1.6.3 吸附等温线的考察
取浓度分别为0.25、0.30、0.35、0.40、0.50、0.60 g/mL的大黄提取物溶液各20 mL,各加入1 g HPD-400树脂,分别置于25、35、45 ℃恒温摇床上振摇进行静态吸附至饱和,测其吸附量,绘制吸附等温线。为进一步了解树脂对大黄中目标成分的吸附,选择2种标准理论模型(Langmuir和Freundlich模型[11]),对25 ℃时的吸附等温线进行拟合,来探讨25 ℃下树脂与大黄蒽醌的吸附行为。Langmuir吸附等温线模型,假定吸附剂的孔隙表面是均匀的,并且吸附分子之间的相互作用力可忽略不计,它适用于单分子层吸附[11];Freundlich模型,假设表面具有吸附热不均匀分布的异质表面,用于描述单分子层以及多分子层的吸附行为[11]。2种吸附等温线模型的公式如下:
式中:qe为平衡吸附量,g/g;Ce为平衡浓度,g/mL;qm为最大吸附量,g/g;KL为Langmuir吸附平衡常数,L/g;Kf为Freundlich系数,L/g;n为表观常数。
1.6.4 纯化溶剂的考察
取18 g树脂置于60 mL大黄提取物溶液中,在“1.6.3”节中确立的最优吸附温度下静态吸附至饱和(其余吸附条件同“1.6.3”节),从中取3份吸附饱和的树脂各5 g,分别加入60 mL、0.2 mol/L NaHCO3、Na2CO3、NaOH溶液进行静态解吸,在1 min、5 min、10 min、30 min、1 h、2 h各取1 mL溶液,调节pH值至中性后用甲醇定容,用HPLC进行检测。
1.7 动态吸附及洗脱行为的考察
1.7.1 上样液浓度的考察
取3份20 g预处理过的HPD-400树脂分别装柱(30 cm×1.7 cm),分别加入含药量为3、4、5 mg/mL的大黄提取物溶液,调节流速为1 mL/min,分别收集流出液,以1/2个柱体积作为1个流份,收集至流出液中各目标成分含量不再变化。分别经HPLC测定各流份中苯乙烯酸和5种蒽醌类物质的峰面积。绘制HPD-400型树脂在不同浓度下的动态吸附曲线。
1.7.2 泄漏曲线的考察
准确称取20 g预处理过的HPD-400树脂装柱(30 cm×1.7 cm),加入含药量为4 mg/mL的大黄提取物溶液,调节流速为1 mL/min,收集流出液,以1/2个柱体积作为1个流份,收集至流出液中6个目标成分含量不再变化。
1.7.3 洗脱剂用量的考察
取HPD-400树脂按“1.7.2”节确立的吸附条件进行上柱吸附至饱和。使用0.2 mol/L NaHCO3溶液动态洗脱苯乙烯酸及杂质,收集流出液,直到流出液中几乎不含有苯乙烯酸。再用95%乙醇动态洗脱蒽醌类物质,收集流出液,直到5种蒽醌类物质被洗脱完全。
1.8 验证试验
准确称取20 g预处理的HPD-400树脂,装柱(30 cm×1.7 cm),在各项优选条件下进行试验。
2 结果与分析
2.1 色谱条件
如图1所示,采用“1.3”节确立的HPLC条件,各成分分离良好,主要得到6个目标成分。由前人研究结果可知,峰1至峰6分别是苯乙烯酸、芦荟大黄素、大黄酸、大黄酚、大黄素甲醚、大黄素,其中峰2至峰6为蒽醌类物质[12-13]。
2.2 大孔吸附树脂型号的筛选
由表1可知,HPD-400型、HPD-100型和AB-8型树脂的静态吸附率和静态解吸率均高于其他3种树脂。其中 HPD-400型树脂静态吸附率最高,且HPD-400型树脂对目标成分的静态解吸率也在65%以上。因此,选择HPD-400型树脂纯化大黄中的游离蒽醌。
2.3 静态吸附解吸工艺的考察
2.3.1 静态吸附pH值的考察
从图2中可以看出,在pH值为4.5时,6个目标成分的吸附率均达到了最高值,之后呈现下降趋势,主要原因是蒽醌类物质大多含有酚羟基因而呈现一定的酸性,在弱酸性条件下游离蒽醌容易被HPD-400型树脂吸附,而在碱性条件下游离蒽醌则易发生分解及氧化,故不易被HPD-400型树脂吸附。因此,确立HPD-400型树脂静态吸附的pH值为4.5。
2.3.2 吸附动力学的考察
由图3可知,初始阶段吸附量增长幅度大,随着时间的延长,吸附量增长幅度变得缓慢,在3 h以后树脂吸附达到平衡,吸附量基本保持不变。因此,吸附时间确定为3 h。
2.3.3 吸附等温线的考察
由图4可知,随着大黄提取物溶液浓度的增加,吸附量先迅速增加,然后增长幅度越来越缓慢。同时可以看出,随着温度的升高,树脂的吸附量降低。可能的解释是,树脂对大黄蒽醌的吸附过程是放热的,温度的升高不利于吸附。由表2可知,Langmuir吸附等温线模型拟合的r2(0.971 3~0.998 7)大于用Freundlich模型拟合的 r2(0.862 2~0.950 6)。因此,Langmuir吸附等温线模型能更好地描述HPD-400型大孔树脂对大黄蒽醌的吸附作用。
2.3.4 纯化溶剂的考察
如图5所示,与使用Na2CO3、NaOH溶液相比,使用NaHCO3溶液只有苯乙烯酸被解吸出来,蒽醌类化合物完全没有被解吸出来。因此,使用 0.2 mol/L NaHCO3作为纯化蒽醌类物质的溶剂,能够使苯乙烯酸与蒽醌类物质分离,从而提高蒽醌类物质的纯度。
2.4 动态吸附及洗脱行为的考察
2.4.1 上样液浓度的考察
从图6可以看出,随着大黄提取物溶液浓度的增加,大黄中6个目标成分对HPD-400树脂的穿透点提前,即达到饱和吸附量的吸附时间减少;吸附速率随着溶液浓度的增加而增加。但是如果浓度太大,会造成传质阻力增加,上样困难,为提高效率最终选择4 mg/mL上样浓度。
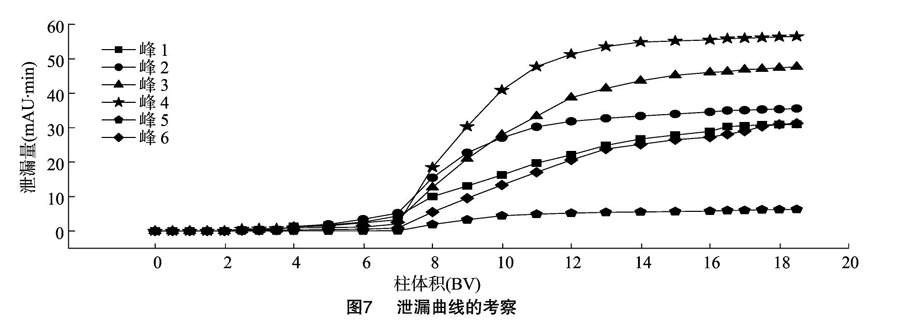
2.4.2 泄露曲线的考察
从图7可以看出,在4 BV时出现了少量的6个目标成分,到7~8 BV时,达到泄漏点,即达到平衡浓度时的1/10,16 BV时,HPD-400树脂对目标成分的吸附达到饱和。因此,确定上样量为7 BV的样品液。
2.4.3 洗脱剂用量的考察
由图8-a可知,70 BV的 0.2 mol/L NaHCO3溶液可以将大黄中的苯乙烯酸完全洗脱下来。由图8-b可知,当用95%乙醇洗脱到3 BV时,大黄中总游离蒽醌洗脱量最大;当用95%乙醇洗脱到[KG*5]15[KG*3]BV[KG*5]时,
HPD-400树脂将大黄总游离蒽醌基本洗脱完全。因此,选择70 BV的0.2 mol/L NaHCO3溶液洗脱大黄中的苯乙烯酸和杂质,选择15 BV的95%乙醇洗脱大黄中的总游离蒽醌。
2.5 验证试验
称取20 g预处理好的HPD-400型大孔吸附树脂装柱,量取7 BV浓度为4 mg/mL的大黄提取物溶液(pH值为4.5左右)上样,吸附饱和后,先用70 BV的0.2 mol/L NaHCO3溶液洗脱并收集洗脱液,再用15 BV的95%乙醇洗脱并收集洗脱液,然后用高效液相色谱仪检测(图9),采用HPLC面积归一化法计算95%乙醇洗脱部分的游离蒽醌的纯度。由图9可知,本验证试验较好地实现了苯乙烯酸与大黄中总游离蒽醌的分离, 提高了总游离蒽醌的纯度,其纯度由41.17%提高到了82.60%。
3 结论
本研究通过对大孔树脂分离纯化的主要工艺参数进行考察,确立了最佳工艺,并对优选工艺进行了验证试验,结果表明,选择的最佳工艺达到了纯化大黄中游离蒽醌类物质的目的,总游离蒽醌类物质的纯度由41.17%提高到了82.60%。使用本试验确立的分离纯化方法,只需2步洗脱就可以纯化大黄中的总游离蒽醌。第1步洗脱使用NaHCO3溶液作为洗脱剂,只有苯乙烯酸被洗脱出来,蒽醌类化合物完全没有被洗脱出来,第2步使用15 BV的95%乙醇洗脱游离蒽醌,避免了大黄游离蒽醌不必要的损失,与依次使用不同浓度的乙醇进行洗脱来纯化总游离蒽醌相比,洗脱步骤更加便捷,且方法操作简单、重复性好、纯化效果优良。本试验确立的纯化方法可以为进一步研究大黄中的成分提供参考。
参考文献:
[1]国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2010:282.
[2]童婷婷,谭玉柱,赵高琼,等. 大孔树脂纯化大黄地上部位总蒽醌的工艺研究[J]. 中成药,2013,35(4):848-852.
[3]叶殷殷,曾元儿,曹 骋,等. 不同型号大孔树脂分离大黄蒽醌类成分的研究[J]. 中成药,2011,33(1):168-170.
[4]刘月红,黄政海,董 玲,等. 高效液相色谱法同时测定大黄中14种成分的含量[J]. 中国中药杂志,2017,42(23):4514-4519.
[5]颜永刚,尹立敏,王红艳,等. HPLC法同时测定大黄炮制品中10种化学成分的含量[J]. 中国药房,2016,27(27):3839-3842.
[6]樊 秦,夏鹏飞,彭雪晶,等. 大孔吸附树脂分离纯化党参中苍术内酯Ⅰ和苍术内酯Ⅱ的工艺研究[J]. 天然产物研究与开发,2017,29(9):1602-1607.
[7]赖红芳,潘立卫,吕贵密,等. 大孔树脂纯化翠云草中穗花杉双黄酮的工艺[J]. 江苏农业科学,2018,46(7):201-204.
[8]师仁丽,于文龙,梁 娜,等. 大孔吸附树脂分离纯化金丝小枣总黄酮工艺研究[J]. 江苏农业科学,2017,45(8):172-175.
[9]钟 旭,王 丽,徐广涛,等. 大黄游离蒽醌的大孔吸附树脂纯化工艺研究[J]. 中华中医药学刊,2013,31(6):1402-1404.
[10]曹 骋,葉殷殷,王浩龙,等. DM301型大孔吸附树脂分离纯化大黄总蒽醌的研究[J]. 中国现代中药,2010,12(8):37-40.
[11]Zhu S,Bo T T,Chen X Y,et al. Separation of succinic acid from aqueous solution by macroporous resin adsorption[J]. Journal of Chemical and Engineering Data,2016,61(2):856-864.
[12]孙爱玲,于琳琳,李爱峰,等. 一种从大黄中分离纯化蒽醌类化合物和苯乙烯酸的方法:104909999B[P]. 2015-09-16.
[13]毛春芳,施 忠,罗 琳,等. HPLC法同时测定大黄中芦荟大黄素等11种成分的量[J]. 中草药,2014,45(16):2400-2403.
- 农民投资理财的特征及引导建议
- 新媒体对大学生执政党认同的挑战及对策
- 浅谈当代大学生文化自信的培养
- 提升内高生自律能力的几点思考
- 地方政务微信的发展问题与应对策略探析
- 现阶段“农校对接”的困境和对策
- 少数民族学生汉语素养的培养与提高
- 内黄县农村小学体育教学存在的问题及对策
- 农民工子女学习适应性与社会支持、自我效能感的关系研究
- 基于扩散理论的农民参与科技创新对策研究
- 鱼类糖类营养研究进展
- 浅析电商模式下农村经纪人的角色转变
- 大学生微商从业情况调查研究
- 推进农产品零售市场公益性建设的几点建议
- 秦安县蜜桃营销问题研究
- 丰县大沙河红富士苹果网络营销策略研究
- 农村电子商务推动新型城镇化的动力机制研究
- 基层供销社和乡镇农合联融合发展的路径分析及对策建议
- 浅谈古树名木现状与保护
- 浅析襄阳地区山桐子产业发展前景
- 黑龙江省国有林区林业产业发展对职工收入带动研究
- 筇竹生物多样性保护地生态补偿意愿调查与分析
- 贵州省能源消费强度演变及其影响因素分析
- 我国农民不合理消费行为及对策
- 精准扶贫中农户争当贫困户的原因分析
- confidence trick
- confidencetrick
- confidency
- confident
- confidential
- confidentialities
- confidentiality
- confidentially
- confidentialness
- confidentialnesses
- confidently
- confident/not confident
- confidents
- confider
- confiders
- confides
- configurable
- configuration
- configurational
- configurationally
- configurations
- configure
- con-figured
- configured
- configures
- 上涨率
- 上涨的水流
- 上清
- 上清三境
- 上清传子
- 上清童子
- 上游
- 上溢下漏
- 上溯
- 上满了发条的钟表
- 上满发条的钟表——分秒不息
- 上漆
- 上漆先去锈
- 上漏下湿
- 上演
- 上濑
- 上火
- 上火儿
- 上灯
- 上灯圆子落灯糕
- 上灶
- 上炎
- 上炕不脱鞋,必是袜子破
- 上炕不脱鞋,必是袜底破
- 上烂药