陆宁海 杨蕊 郎剑锋
摘要:为探索小麦不同生长时期根际土壤微生物数量的动态变化规律,通过稀释分离法分析健康植株和患病植株根际土壤真菌、细菌和放线菌数量。结果表明,患病植株根际土壤真菌种群数量在小麦不同生长时期比健康植株根际土壤真菌数量多,从返青期到成熟期,真菌种群数量逐渐增加,孕穗期达到最大值,健康植株根际土壤真菌数量为 10.21×103 CFU/g,患病植株根际土壤真菌数量为14.27×103 CFU/g。患病植株根际土壤细菌、放线菌数量在小麦不同生长时期比健康植株根际土壤细菌、放线菌数量少,从返青期到成熟期,种群数量逐渐增加,在扬花期达到最大值,健康植株根际土壤细菌数量为50.78×106 CFU/g,放线菌数量为28.44×103 CFU/g,患病植株根际土壤细菌数量为36.68×106 CFU/g,放线菌数量为22.67×103 CFU/g。因此,小麦茎基腐病的发生与根际土壤微生物数量有一定的关系,其中当真菌数量较多,细菌和放线菌数量较少时,有可能加重病害的发生。
关键词:小麦茎基腐病;根际土壤;微生物;稀释分离法
中图分类号: S435.121.4 ?文献标志码: A ?文章编号:1002-1302(2019)22-0113-04
小麦茎基腐病(crown rot,简称CR)是由多种病原真菌引起的一种土传病害,别称旱地脚腐病(dry land foot rot)、镰刀根腐病(Fusarium root rot)和镰刀茎基腐病(Fusarium crown rot)等[1]。该病是一种世界性的重要病害,已有10多个国家报道其发生,包括美国、澳大利亚、意大利、土耳其、加拿大等[2]。在我国江苏地区曾报道小麦茎基褐腐病的危害,但其病原以根腐蠕孢菌为主,与国外报道的以镰刀菌为主要病原的小麦茎基腐病明显不同[3]。Li等首次在我国报道了由假禾谷镰刀菌(Fusarium pseudograminearum)引起的小麦茎基腐病[4]。有调查显示,近年来,随着秸秆还田及免耕少耕等耕作措施的大面积推广,小麦茎基腐病在各大麦区发生普遍并造成了一定的经济损失,已逐步引起重视[5-6]。
大量的研究表明,田间环境是影响病害发展和流行的重要因素,主要包括播期、土壤类型、土壤湿度、营养状况等[7]。另外,品种抗性也在一定程度上影响发病程度。有研究表明,早播会使病害加重发生,而适当晚播可减轻病害的发生程度。茎基腐病在所有土壤类型中均可发生,尤以黏性土壤最为普遍。地势低洼、排水不良可促进其发病[8]。土壤湿度是影响茎基腐病田间发病率和严重度的主要因素。湿润的表层土壤是病害苗期侵染的必要条件,土壤湿度高有利于发病[9]。有资料显示,小麦播种后遭遇阴雨天气以及扬花期至成熟期遇到干旱天气有利于茎基腐病的发生[10]。氮和锌是影响茎基腐病发病率和发病严重程度的主要营养元素。施用氮肥过多、植物缺锌均有利于小麦茎基腐病的发生[11-12],在茎基腐病严重发生的地区,适当增施锌肥可有效减轻茎基腐病的发生。但有关根际土壤微生物数量对小麦茎基腐病的影响还未见报道。因此,本研究探讨根际土壤微生物数量对小麦茎基腐病的影响。
1 材料与方法
1.1 根际土壤微生物的采集
试验地点设在河南省新乡市新乡县洪门镇乔谢村的试验田,在小麦生长返青期、拔节期、孕穗期、扬花期、成熟期分别采集患病和健康小麦植株根际土壤,采用5点取样法,每点随机选择50株小麦,收集其根际土壤,轻抖带土植株掉落土样,该土样为非根际土壤,黏附在植株根系上的土样则为根际土壤[13]。采样后将根际土壤装入无菌袋中并编号,带回实验室后,将統一处理的5个样品混合,将土样过1 mm筛后放入 4 ℃ 环境下保存,用于根际土壤微生物的分离。
1.2 培养基的选择
真菌的分离采用马铃薯葡萄糖(PDA培养基)培养基,细菌的分离采用牛肉膏蛋白胨培养基,放线菌的分离采用高氏一号合成培养基[14]。
马铃薯葡萄糖培养基配方[15]:200 g马铃薯,10~20 g葡萄糖,17~20 g琼脂,1 000 mL自来水,自然pH值。
牛肉膏蛋白胨培养基配方[14]:3 g牛肉浸膏,5~10 g蛋白胨,1 000 mL水,17~20 g琼脂,自然pH值。
高氏一号合成培养基配方[14]:20 g可溶性淀粉,1.0 g KNO3,0.5 g K2HPO4,0.5 g MgSO4·7H2O,0.5 g NaCl,0.01 g FeSO4·7H2O,1 000 mL水,20 g琼脂,自然pH值。
1.3 根际土壤微生物的分离
(1)用稀释分离法[16]从根际土壤中分离细菌。将牛肉膏蛋白胨培养基放在微波炉里加热,待完全融化后取出,在无菌操作台上倒空白平板。冷凝后,用微量移液枪吸取已经梯度稀释过的土壤悬浮液中,从低浓度到高浓度依次吸取10-6、10-5、10-4各0.1 mL,用涂抹棒涂抹均匀。置于28 ℃培养箱中培养,在第2天至第7天每天观察统计细菌菌落数量与种类。
(2)用稀释分离法[16]从根际土壤中分离真菌。将灭过菌的250 mL PDA培养基放在微波炉里加热,待完全融化后取出,加入1 mL链霉素,轻摇,使链霉素与培养基充分混匀,然后倒空白平板。冷凝后,用微量移液枪吸取已经梯度稀释过的土壤悬浮液,从低浓度到高浓度依次取10-3、10-2、10-1各 0.1 mL,用涂抹棒涂抹均匀。置于25 ℃培养箱中培养,在第2天至第7天每天观察统计真菌菌落数量与种类。
(3)用稀释分离法[16]从根际土壤中分离放线菌。将高氏一号合成培养基放在微波炉里加热,待完全融化后取出,在无菌操作台上倒空白平板。冷凝后,用微量移液枪吸取已经梯度稀释过的土壤悬浮液,从低浓度到高浓度依次取10-3、10-2、10-1各0.1 mL,用涂抹棒涂抹均匀。放在28 ℃培养箱中培养,在第2天至第7天每天观察统计放线菌菌落数量与种类。每个处理重复3次,土壤中微生物数量以每克土壤样品所含的菌落数表示,单位为CFU/g。试验所用器材均为事先灭过菌的。
1.4 小麦茎基腐病发病情况调查
在小麦返青期、拔节期、孕穗期、扬花期、成熟期分别调查记录各小区小麦茎基腐病的发病情况,按对角线5点取样法进行,每点取50株,调查小麦茎基腐病的发生情况。按茎基腐病的发病程度分为0~5级,即0级:无明显症状;1级:第1叶鞘褐枯小于叶鞘长度10%;2级:第1叶鞘褐枯占叶鞘长度11%~25%;3级:第1叶鞘褐枯占叶鞘长度26%~50%;4级:第2叶鞘有明显褐枯;5级:第3叶鞘有明显褐枯或全株枯死[17]。然后计算发病率和病情指数[18]。
病情指数=100×∑(各级病叶数×各级代表值)/(调查总叶数×最高级代表值);
发病率=调查染病株数/调查总株数×100%。
2 结果与分析
2.1 小麦茎基腐病在不同时期的发病率和病情指数分析
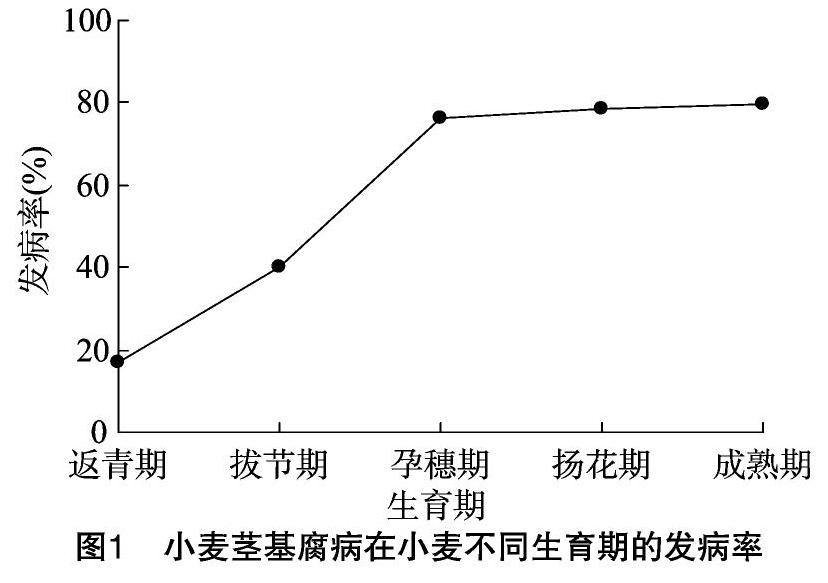
由图1可知,在小麦的整个生育期中,小麦茎基腐病的发生呈先迅速上升而后趋于平稳的变化动态。从返青期到孕穗期,茎基腐病的发生流行较快,返青期、拔节期、孕穗期的发病率分别为17.11%、40.12%、76.26%,在孕穗期达到高峰,孕穗期后发病率相对稳定,扬花期、成熟期的发病率分别为 78.33%、79.54%。
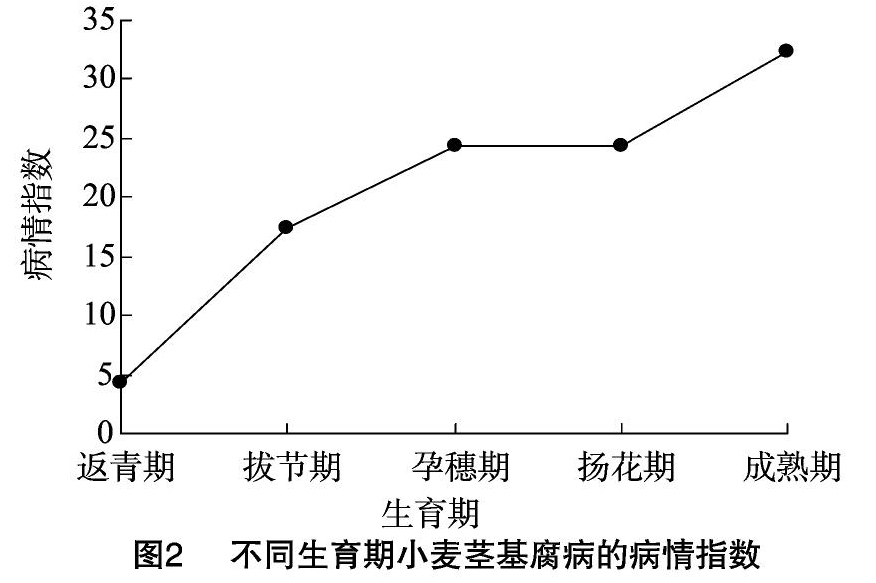
由图2可知,在小麦的不同生长发育时期,小麦茎基腐病的病情指数(即严重度)呈持续上升趋势,在成熟期达到高峰。从返青期到拔节期,小麦的病情指数急剧增长,从4.24增长到17.43,孕穗期、扬花期、成熟期,病情逐渐加重,但增幅较小,病情指数分别为24.33、27.41、32.41。
2.2 小麦返青期根际土壤微生物的数量分析
由表1可知,返青期患病小麦植株根际土壤与健康小麦植株根际土壤中的微生物数量有显著差异。小麦返青期健康小麦根际土壤中的细菌数量明显比患病小麦根际土壤中的细菌数量多,健康植株根际土壤中的细菌数量为4.64×106 CFU/g,患病植株根际土壤中的细菌数量为3.23×106 CFU/g;患病小麦根际土壤中的真菌数量明显比健康小麦根际土壤中的真菌数量多,健康小麦根际土壤中的真菌数量为1.67×103 CFU/g,患病小麦根际土壤中的真菌数量为3.51×103 CFU/g;健康小麦根际土壤中放线菌的数量明显比患病小麦根际土壤中放线菌的数量多,健康小麦根际土壤中放线菌的数量为1.32×103 CFU/g,患病小麦根际土壤中放线菌的数量为 1.06×103 CFU/g。
2.3 小麦拔节期根际土壤微生物的数量分析
由表2可知,拔节期患病小麦植株根际土壤与健康小麦植株根际土壤中的微生物数量有显著差异。小麦拔节期健康植株根际土壤中的细菌数量明显比患病植株根际土壤中的细菌数量多,健康植株根际土壤中的细菌数量为14.35×106 CFU/g,患病植株根际土壤中的细菌数量为10.12×106 CFU/g;患病植株根际土壤中的真菌数量明显比健康植株根际土壤中的真菌数量多,患病植株根际土壤中的真菌数量为5.98×103 CFU/g,健康植株根际土壤中的真菌数量为3.74×103 CFU/g;健康植株根际土壤中放线菌的数量明显比患病植株根际土壤中放线菌的数量多,健康植株根际土壤中放线菌的数量为5.12×103 CFU/g,患病植株根际土壤中放线菌的数量为 4.18×103 CFU/g。
2.4 小麦孕穗期根际土壤微生物的数量分析
由表3可知,孕穗期患病小麦植株根际土壤与健康小麦植株根际土壤中的微生物数量有显著差异。小麦孕穗期健康植株根际土壤中的細菌数量明显比患病植株根际土壤中的细菌数量多,健康植株根际土壤中的细菌数量为32.69×106 CFU/g,患病植株根际土壤中的细菌数量为19.79×106 CFU/g;患病植株根际土壤中的真菌数量明显比健康植株根际土壤中的真菌数量多,患病植株根际土壤中的真菌数量为11.26×103 CFU/g,健康植株根际土壤中的真菌数量为8.62×103 CFU/g;健康植株根际土壤中放线菌的数量明显比患病植株根际土壤中放线菌的数量多,健康植株根际土壤中放线菌的数量为13.78×103 CFU/g,患病植株根际土壤中放线菌的数量为 11.56×103 CFU/g。
2.5 小麦扬花期根际土壤微生物的数量分析
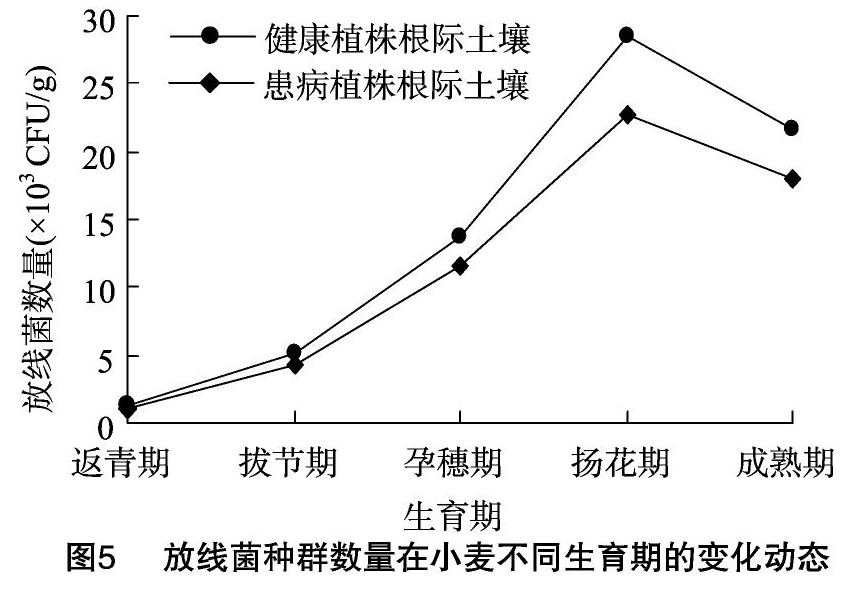
由表4可知,扬花期患病小麦植株根际土壤与健康小麦植株根际土壤中的微生物数量有显著差异。小麦扬花期健康植株根际土壤中的细菌数量明显比患病植株根际土壤中的细菌数量多,健康植株根际土壤中的细菌数量为50.78×106 CFU/g,患病植株根际土壤中的细菌数量为36.68×106 CFU/g;患病植株根际土壤中的真菌数量明显比健康植株根际土壤中的真菌数量多,患病植株根际土壤中的真菌数量为14.27×103 CFU/g,健康植株根际土壤中的真菌数量为10.21×103 CFU/g;健康植株根际土壤中放线菌的数量明显比患病植株根际土壤中放线菌的数量多,健康植株根际土壤中放线菌的数量为28.44×103 CFU/g,患病植株根际土壤中放线菌的数量为 22.67×103 CFU/g。
2.6 小麦成熟期根际土壤微生物的数量分析
由表5可知,成熟期患病小麦植株根际土壤与健康小麦植株根际土壤中的微生物数量存在显著差异。小麦成熟期健康植株根际土壤中的细菌数量明显比患病植株根际土壤中的细菌数量多,健康植株根际土壤中的细菌数量为35.14×106 CFU/g,患病植株根际土壤中的细菌数量为28.95×106 CFU/g;患病植株根际土壤中的真菌数量明显比健康植株根际土壤中的真菌数量多,患病植株根际土壤中的真菌数量为11.17×103 CFU/g,健康植株根际土壤中的真菌数量为9.56×103 CFU/g;健康植株根际土壤中放线菌的数量明显比患病植株根际土壤中放线菌的数量多,健康植株根际土壤中放线菌的数量为21.56×103 CFU/g,患病植株根际土壤中放线菌的数量为 19.79×103 CFU/g。
参考文献:
[1]周海峰,杨 云,牛亚娟,等. 小麦茎基腐病的发生动态与防治技术[J]. 河南农业科学,2014,43(5):114-117.
[2]Burgess L W,Backhouse D,Summerell B A,et al. Crown rot of wheat[M]. Paul:Aps Press,2001:271-294.
[3]李 伟,陈 莹,张晓祥,等. 小麦茎基褐腐病病原菌组成及其致病力研究[J]. 麦类作物学报,2011,31(1):170-175.
[4]Li H L,Yuan H B. First report of Fusarium pseudograminearum causing crown rot of wheat in Henan,China[J]. Plant Disease,2012,96(7):1065.
[5]陈厚德,王彰明,袁树忠,等. 小麦茎基褐腐病的发生特点及其对产量的影响[J]. 扬州大学学报(自然科学版),2001,4(4):43-46.
[6]李冬梅,曹克强,王爱英,等. 河北省小麦根病发生现状及致病病原种类调查[J]. 河北农业大学学报,2001,24(3):38-42.
[7]Klein T A,Burgess L W,Ellison F W. The incidence of crown rot in wheat,barley and triticale when sown on two dates[J]. Australian Journal of Experimental Agriculture,1989,29(4):559-563.
[8]Wallwork H. Cereal root and diseases[M]. Adelaide:Sardi-Grdc Press,1996:26-31.
[9]Klein T A. Burgess L W,ellison F W.The incidence and spatial patterns of wheat plants infectd by Fusarium graminearum gyoup1 and the effect of crown rot on yield[J]. Australain Journal of Agricultural Research,1991,42(3):399-407.
[10]Paulitz T C,Smiley R W,Cook R J. Insights into the prevalence and management of soilbome cereal pathogens under direct seeding in the Pacific Northwest,U.S.A.[J]. Canadian Journal of Plant Pathology,2002,24(4):416-428.
[11]Verrell A,Moore K J,Backhouse D,et al. Water and Nitrogen affect the incidence and severity of crown rot in wheat[M]. Tamworth:Nsw Agriculture Press,2003:63-64.
[12]Sparrow D H,Graham R D. Susceptibility of zine-deficient wheat plants to colonization by Fusarium graminearum Schw.group1[J]. Plant and Soil,1988,112(2):261-266.
[13]Maaritn R,Heiskanen I,Walleniusk,et al. Extraction and purification of DNA in rhizosphere soil samples for PCR-DGGE analysis of bacteria consortia[J]. Journal of Microbiological Methods,2001,45(3):155-165.
[14]徐瑞富,陸宁海,杨 蕊,等. 土壤类型及生育时期对小麦根际土壤微生物数量的影响[J]. 河南农业科学,2013,42(12):75-78.
[15]陆宁海,徐瑞富,吴利民,等. 不同培养基对小麦纹枯病菌生长繁殖及致病力的影响[J]. 中国农学通报,2005,21(2):262-263,283.
[16]向万胜,吴金水,肖和艾,等. 土壤微生物的分离、提取与纯化研究进展[J]. 应用生态学报,2003,14(3):453-456.
[17]张 鹏,霍 燕,周淼平,等. 小麦禾谷镰孢菌茎基腐病抗源的筛选与评价[J]. 植物遗传资源学报,2009,10(3):431-435.
[18]孙海燕,李 琦,杜文珍,等. 不同杀菌剂拌种防治小麦全蚀病研究[J]. 植物保护,2012,38(3):155-158,175.
- 房地产企业预算管理存在的问题及对策研究
- 试论公立医院经济管理中成本效益分析法的应用
- 中国-东盟跨境流域治理项目
- 浅析中小企业内部控制问题及解决方案
- 试论新时代乡村振兴战略的实施路径及策略
- 多元统计分析方法在企业管理中的应用
- 咨询行业质量管理改进建议
- 移动互联时代企业培训模式创新思考分析
- 国防预研项目申报与管理工作探讨
- 民办高职院校优劣势与内部治理策略分析
- 如何看待企业内控管理
- 集中采购的优势、不足及对策
- 试论集中供热收费难的原因及对策
- 果树在园林绿化中的应用
- 企业供应链管理和供应链战略研究
- 计算机软件数据接口的实现思路和策略分析
- 浅论知识产权在企业发展中的作用
- 海洋工程业务中“单船公司”模式的操作和法律风险研究
- 高校档案管理信息化创新探讨
- 公共事业管理发展现状及策略研究
- 行政事业单位绩效管理中存在的问题及优化措施探讨
- 教育机构信息化建设研究
- “一带一路”背景下榆林市对外能源合作存在的问题及对策分析
- 现代智慧物流平台在国际贸易中的应用研究
- 高新技术企业资金管理问题及对策
- get on / get along
- get on/onto sth
- get on or off a bus, plane etc
- get on sb's nerves
- get onto
- get on top of sth
- get onto/reach the statute book
- get on to sb (about sth)
- get onto sb/sth
- get on with
- get on with sth
- getout
- get out
- getoutclause
- get-out clause
- get out / get out of sth
- get out of
- get out of bed
- get out of hand
- get out of here!
- get out of here
- get out (of something)
- get out of sth
- get out (of sth)
- get out of sth/doing sth
- 神吹海聊
- 神呼(乎)其神
- 神和子
- 神品
- 神品第一
- 神哗鬼叫
- 神器
- 神嚎鬼哭
- 神团
- 神圣
- 神圣同盟
- 神圣工巧
- 神圣的事
- 神圣的太阳
- 神圣的法度
- 神圣的计算者
- 神圣的雕刻
- 神圣社会
- 神圣罗马帝国
- 神圣而明智
- 神圣而洁净
- 神圣而纯洁
- 神圣英明,无所不知
- 神坛
- 神坰